Содержание
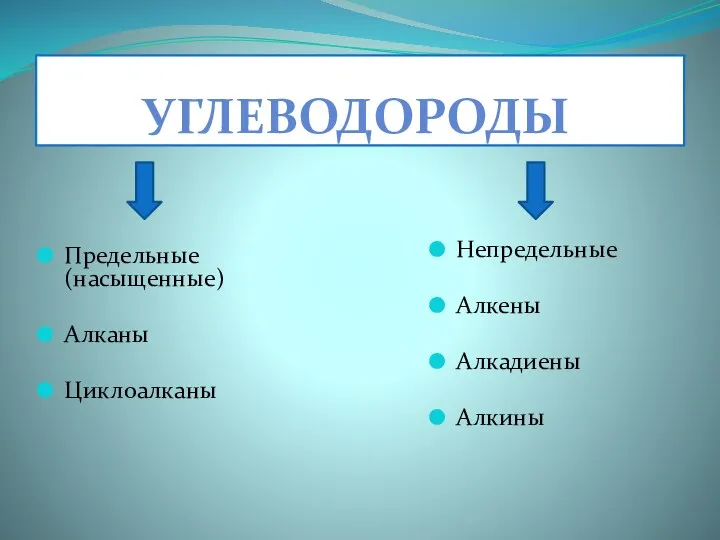
- 3. УГЛЕВОДОРОДЫ Предельные (насыщенные) Алканы Циклоалканы Непредельные Алкены Алкадиены Алкины
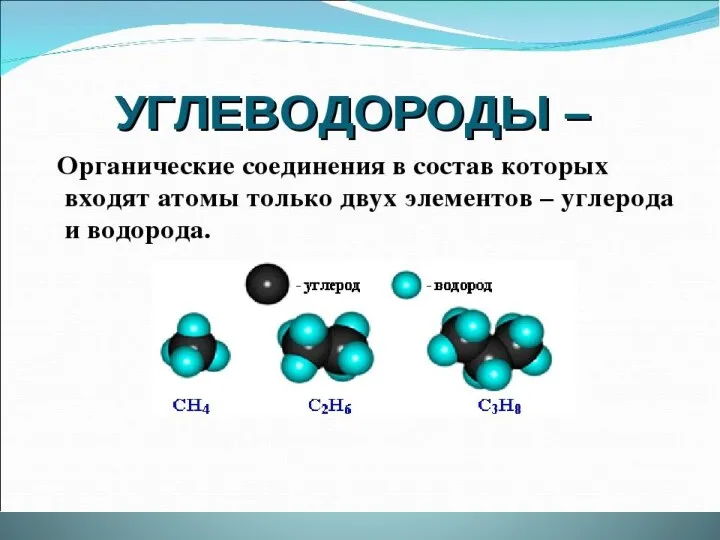
- 4. Алканы (парафины) Общая формула CnH2n+2 К алканам (парафинам) относятся соединения с открытой цепью, в которых атомы
- 5. Углы между орбиталями равны 109*28. Связи С-Н несколько короче. В молекулах алканов все атомы углерода находятся
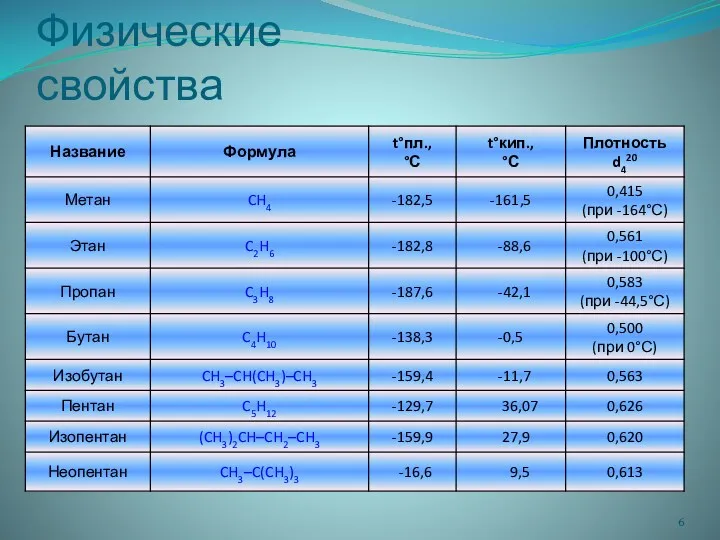
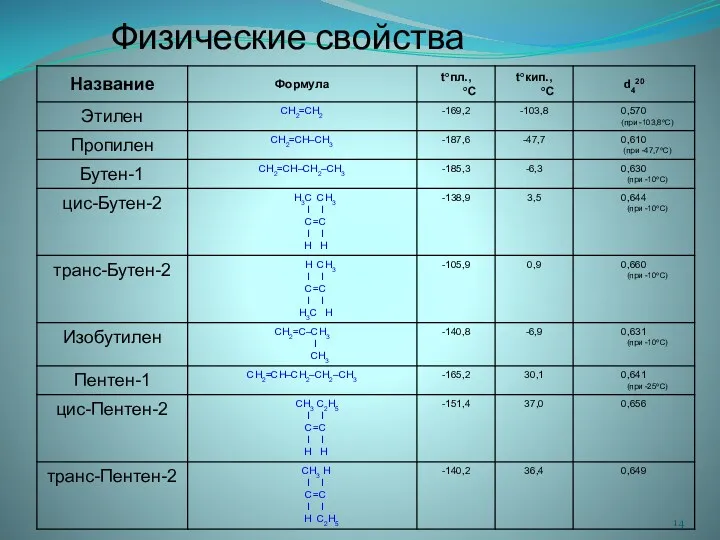
- 6. Физические свойства
- 7. Химические свойства Изомеризация:CH3 – CH2– CH2– CH2– CH3 CH3 – CH– CH2 – CH3 Реакции замещения:
- 8. Применение Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и
- 9. Циклоалканы (циклопарафины) Общая формула В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды
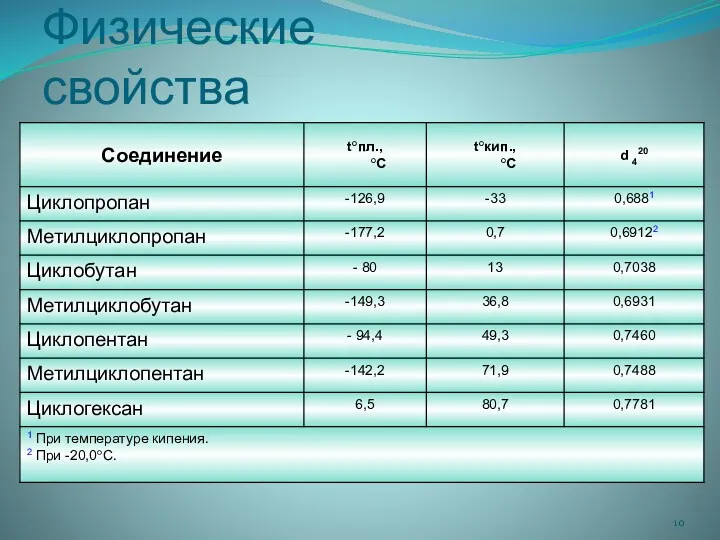
- 10. Физические свойства
- 11. Химические свойства Гидрирование: Галогенирование: Гидрогалогенирование: Дегидрирование: (циклопропан) + H2 ––120ºC,Ni→ CH3–CH2–CH3(пропан) + Br2 → BrCH2–CH2–CH2Br (1,3-
- 12. Применение Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама,
- 13. Алкены Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в молекуле одну двойную связь. Общая
- 14. Физические свойства
- 15. Химические свойства Галогенирование: H2C=CH2 + Br2 → BrCH2–CH2Br (1,2-дибромэтан) Гидрирование: CH3–CH=CH2 + H2 ––Ni→ CH3–CH2–CH3 (пропан)
- 16. Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры
- 17. Диеновые углеводороды (Алкадиены) Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод -
- 18. 1) углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода. Например, пропадиен или аллен
- 19. Физические свойства Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется
- 20. Алкины Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь. Общая формула
- 21. Физические свойства
- 22. Химические свойства Реакции присоединения: Гидрирование: Галогенирование: Гидрогалогенирование: Тримеризация : 3HC≡CH → С6 Н6 (бензол) CH3–C≡CH (пропин)
- 23. Применение При горении ацетилена в кислороде температура пламени достигает 3150°C, поэтому ацетилен используют для резки и
- 25. Скачать презентацию

















 Химические свойства алкенов
Химические свойства алкенов Фосфор и его соединения. 11 класс
Фосфор и его соединения. 11 класс Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Химический дискуссионный клуб. Викторина
Химический дискуссионный клуб. Викторина Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Карбонаты и гидрокарбонаты. Тест – экспресс
Карбонаты и гидрокарбонаты. Тест – экспресс Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Кислород
Кислород Химия в повседневной жизни человека
Химия в повседневной жизни человека Дефекты в твердых телах
Дефекты в твердых телах Ауыр түсті металдар
Ауыр түсті металдар Катализ и катализаторы. (Лекция 10)
Катализ и катализаторы. (Лекция 10) Значение периодического закона и периодической системы Д.И. Менделеева
Значение периодического закона и периодической системы Д.И. Менделеева Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Реакции ионного обмена
Реакции ионного обмена В мире криссталлов
В мире криссталлов Жескость воды
Жескость воды Кристаллические решетки
Кристаллические решетки Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса Комплексные соединения
Комплексные соединения Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Франций (Francium)
Франций (Francium) Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия