Содержание
- 2. Тест – экспресс 1) Электронная конфигурация атома углерода 2) Разновидности простого вещества, образованные одним и тем
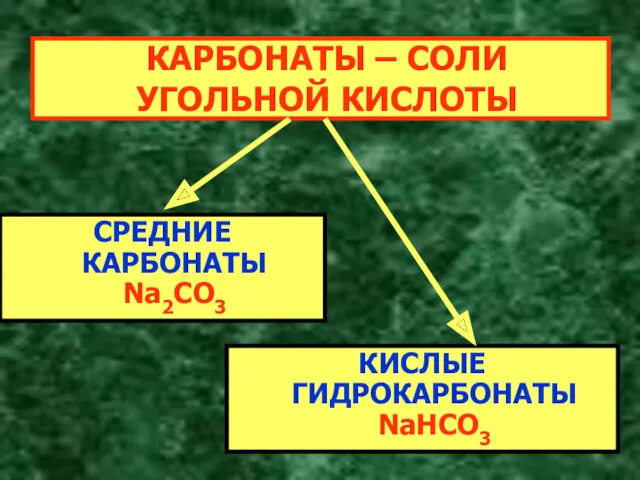
- 4. КАРБОНАТЫ – СОЛИ УГОЛЬНОЙ КИСЛОТЫ СРЕДНИЕ КАРБОНАТЫ Na2CO3 КИСЛЫЕ ГИДРОКАРБОНАТЫ NaHCO3
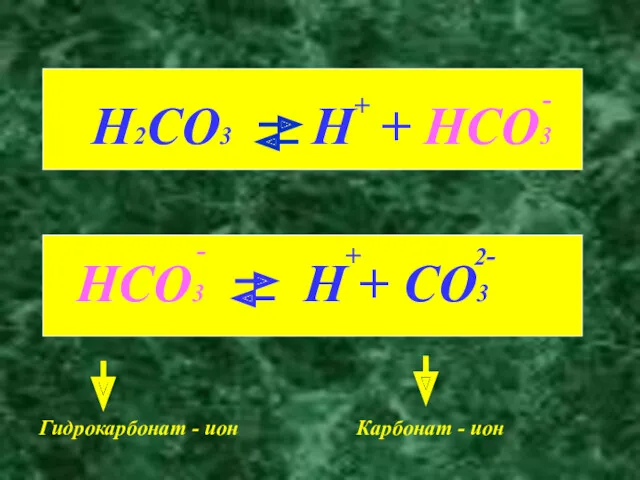
- 5. Гидрокарбонат - ион Карбонат - ион
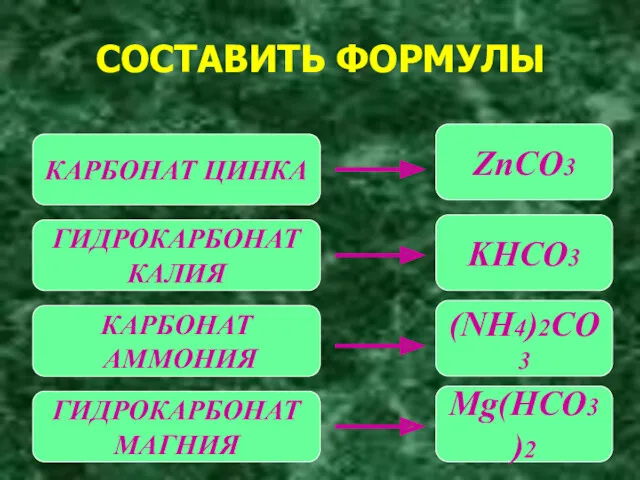
- 6. СОСТАВИТЬ ФОРМУЛЫ КАРБОНАТ ЦИНКА ГИДРОКАРБОНАТ КАЛИЯ КАРБОНАТ АММОНИЯ ГИДРОКАРБОНАТ МАГНИЯ ZnCO3 KHCO3 (NH4)2CO3 Mg(HCO3)2
- 8. Ca(OH)2+CO2 CaCO3 +H2O CaCO3+CO2+H2O Ca(HCO3)2 Получение карбонатов, гидрокарбонатов
- 9. Взаимодействие с сильными кислотами CaCO3+2HCl = CaCl2 +H2O+CO2 Качественные реакции
- 10. Превращение гидрокарбонатов в карбонаты а) при нагревании 2NaHCO3 Na2CO3 + H2O+CO2 б) при действии щёлочи NaHCO3
- 11. Na2 CO3+BaCl2 BaCO3 +2NaCl Взаимодействие с растворами солей Разложение карбонатов MgCO3 MgO + CO2
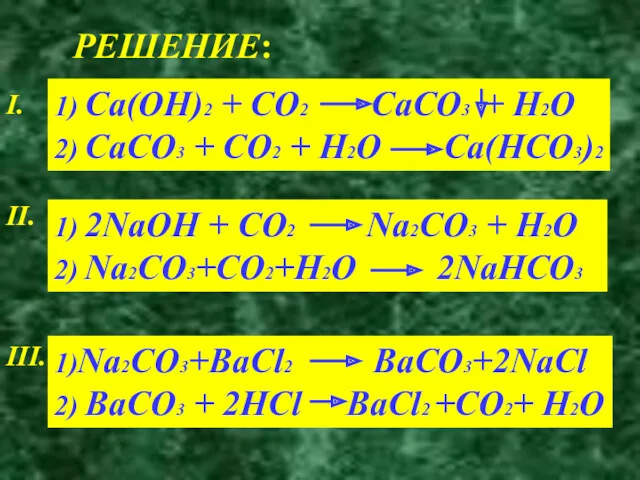
- 12. ОСУЩЕСТВИТЕ ПРЕВРАЩЕНИЕ I. Ca(OH)2 CaCO3 Ca(HCO3)2 II. NaOH Na2CO3 NaHCO3 III. Na2CO3 BaCO3 CO2
- 13. РЕШЕНИЕ: I. 1) Ca(OH)2 + CO2 CaCO3 + H2O 2) CaCO3 + CO2 + H2O Ca(HCO3)2
- 14. 1,7% земной коры – карбонатные породы
- 15. КОРАЛЛОВЫЕ ПОЛИПЫ – CaCO3
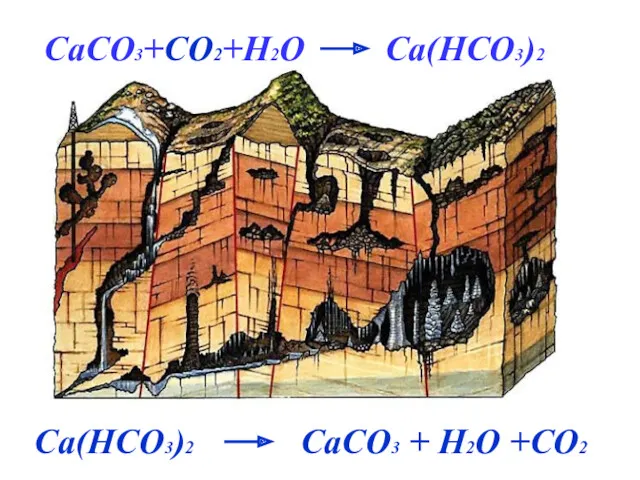
- 16. CaCO3+CO2+H2O Ca(HCO3)2 Ca(HCO3)2 CaCO3 + H2O +CO2
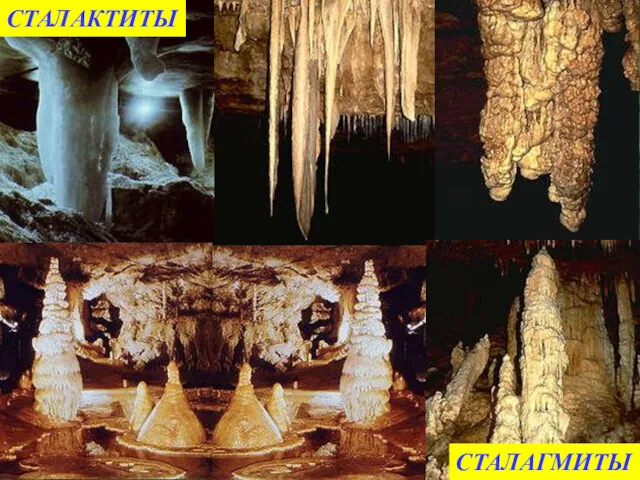
- 17. СТАЛАКТИТЫ СТАЛАГМИТЫ
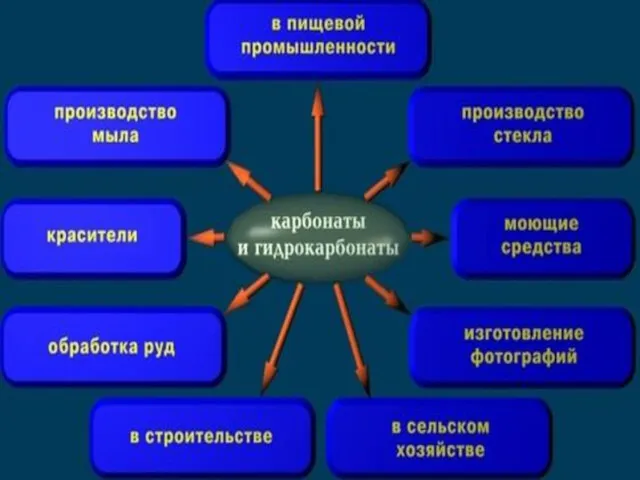
- 18. Применение
- 19. ИЗВЕСТНЯК – CaCO3
- 20. Малахит Cu2(ОН)2CO3 – хрупкий, цвет ярко-зеленый, темно-зеленый, блестит. Из него изготовляют художественно-декоративные предметы,используют для получения меди.
- 22. Кальцинированная сода Na2CO3– белый порошок, используется в производстве стекла, мыла, бумаги, моющих средств.
- 23. Na HCO3 – ПИТЬЕВАЯ СОДА NaHCO3 + HCl = NaCl + CO2 + H2O
- 25. 1)Какие минералы содержат кальций карбонат? Мрамор, известняк, мел. 2) Зачем хозяйки добавляют питьевую соду в тесто?
- 26. 3) Что такое сталактиты? Каменные сосульки в пещерах состоящие из карбоната кальция. 4) Как химическим путем
- 28. Скачать презентацию















 Введение в ЭТМ и основы строения и свойств материалов. (1)
Введение в ЭТМ и основы строения и свойств материалов. (1) Окислы и их свойства
Окислы и их свойства Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Роль воды в химических реакциях
Роль воды в химических реакциях Сера и ее соединения
Сера и ее соединения Химия s-элементов. Общая характеристика
Химия s-элементов. Общая характеристика Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура
Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Предмет органической химии. Основные положения теории химического строения органических соединений
Предмет органической химии. Основные положения теории химического строения органических соединений Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5)
Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5) Химические свойства воды
Химические свойства воды Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Валентность и степень окисления
Валентность и степень окисления Арены. Бензол и его гомологи
Арены. Бензол и его гомологи Химическая промышленность
Химическая промышленность Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии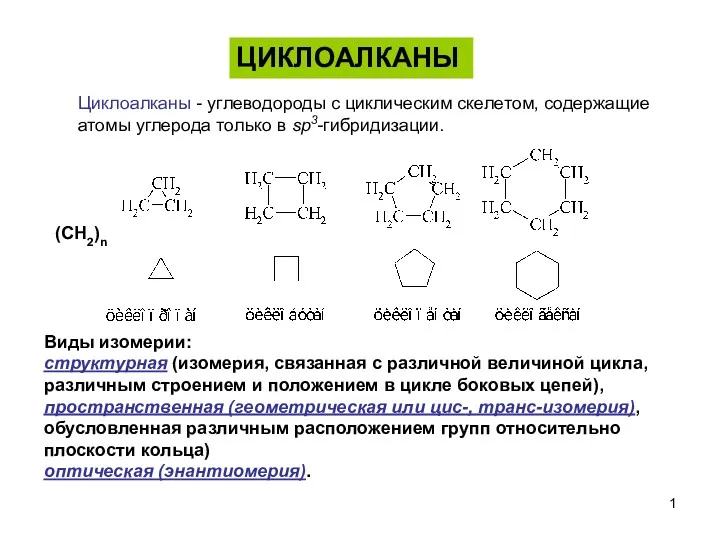 Циклоалканы
Циклоалканы Ионная химическая связь
Ионная химическая связь Применение водорода. Будущие водородные технологии. Урок химии в 8 классе
Применение водорода. Будущие водородные технологии. Урок химии в 8 классе Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Химическая связь и ее типы. Основные классы неорганических соединений
Химическая связь и ее типы. Основные классы неорганических соединений Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Основные характеристики клеев
Основные характеристики клеев Задачи
Задачи Химический состав клетки
Химический состав клетки Аллотропия
Аллотропия