Содержание
- 2. Степень окисления Определяется количеством электронов, которое может отдавать или принимать элемент, вступая в соединение Условный заряд
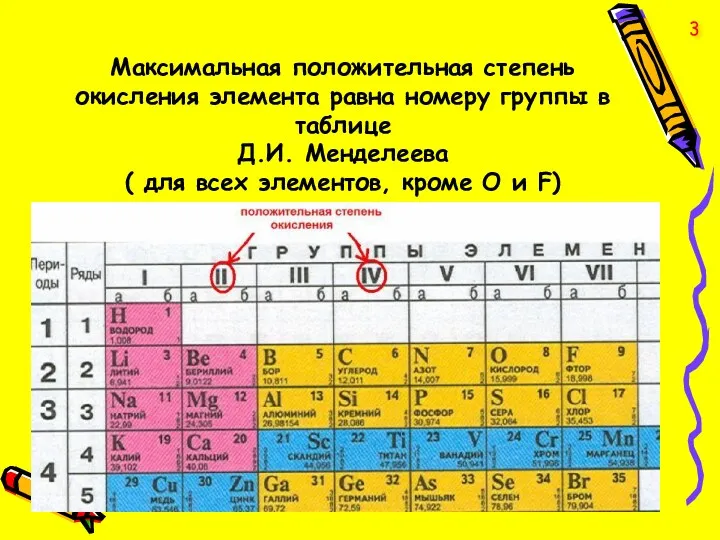
- 3. Максимальная положительная степень окисления элемента равна номеру группы в таблице Д.И. Менделеева ( для всех элементов,
- 4. ЗАДАНИЕ 2. Определить положительные степени окисления элементов: Al Zn Mg Si Li О 4
- 5. Проверим Al +3 , Zn +2 , Mg+2 , Si +4 , Li +1 5
- 6. Отрицательную степень окисления могут проявлять только неметаллы. Отрицательная степень окисления = № группы - 8 ЗАДАНИЕ
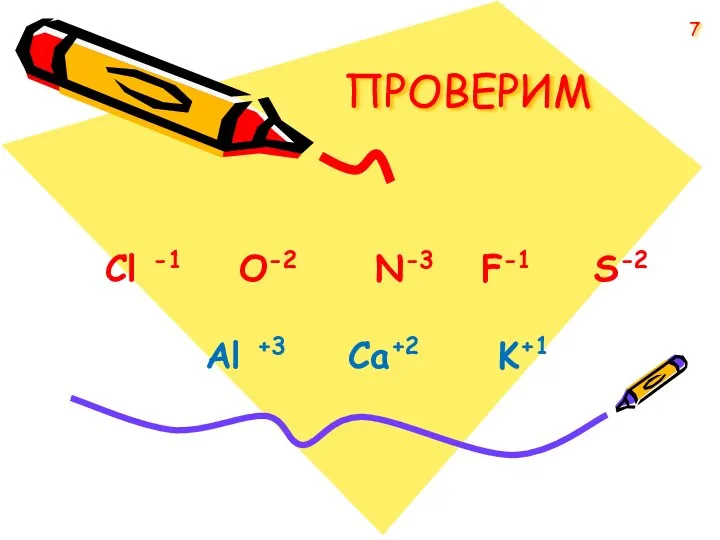
- 7. ПРОВЕРИМ Cl -1 O-2 N-3 F-1 S-2 Аl +3 Ca+2 K+1 7
- 8. Бинарное соединение - сложное вещество, состоящее из 2 химических элементов. 8
- 9. На первое место в формуле ставится элемент, с меньшей электроотрицательностью ЗАДАНИЕ 4. Составить формулы веществ, образованных:
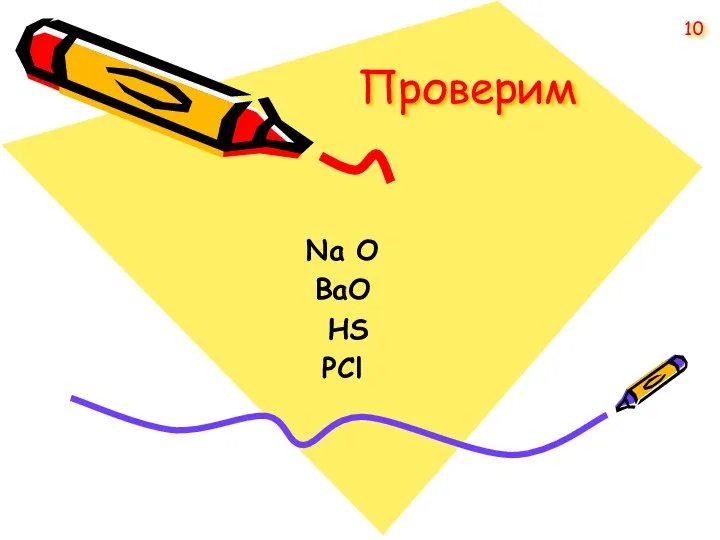
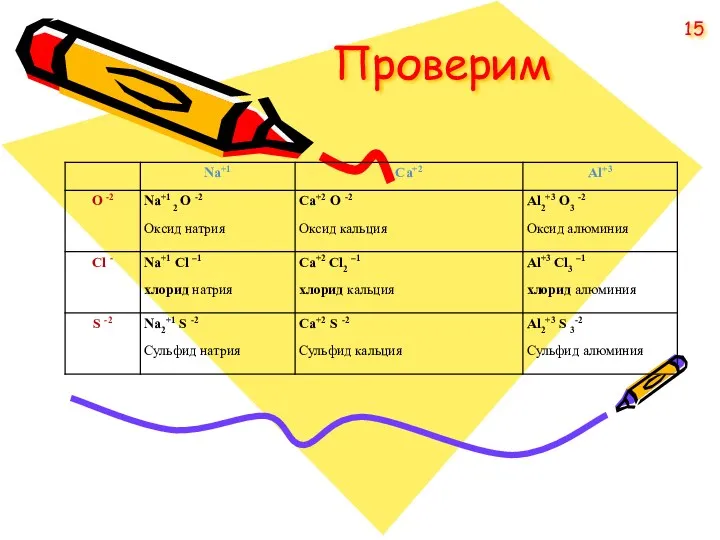
- 10. Проверим Na O BaО HS PCl 10
- 11. На первом месте в формуле принято писать элемент с положительной степенью окисления, на последнем месте –
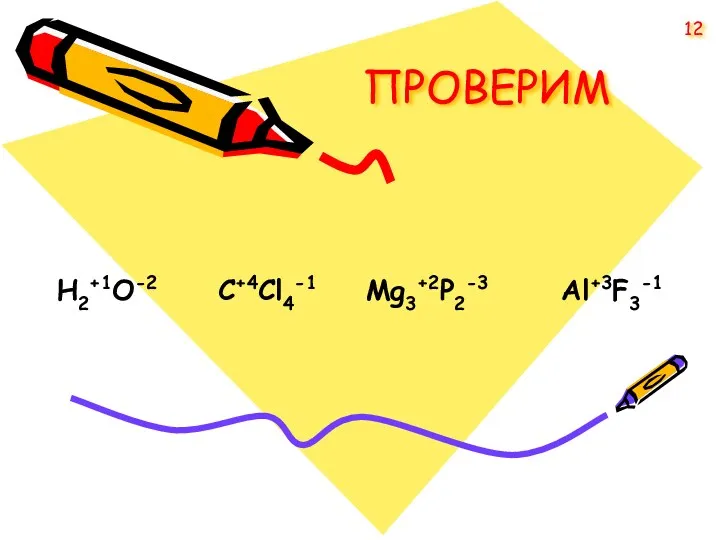
- 12. ПРОВЕРИМ H2+1O-2 C+4Cl4-1 Mg3+2P2-3 Al+3F3-1 12
- 13. Названия бинарных соединений На втором месте в формуле: Cl – хлорид O – оксид S –
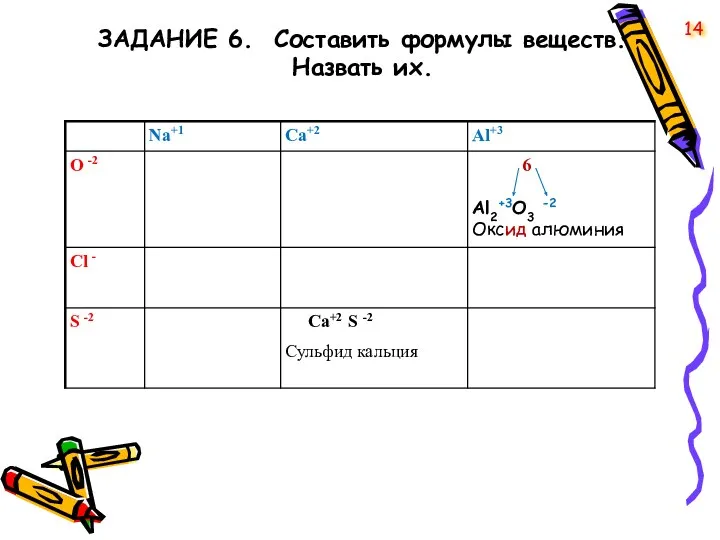
- 14. ЗАДАНИЕ 6. Cоставить формулы веществ. Назвать их. 14
- 15. Проверим 15
- 16. Некоторые элементы могут проявлять несколько положительных степеней окисления (переменную). Например, медь Cu +1 и +2, сера
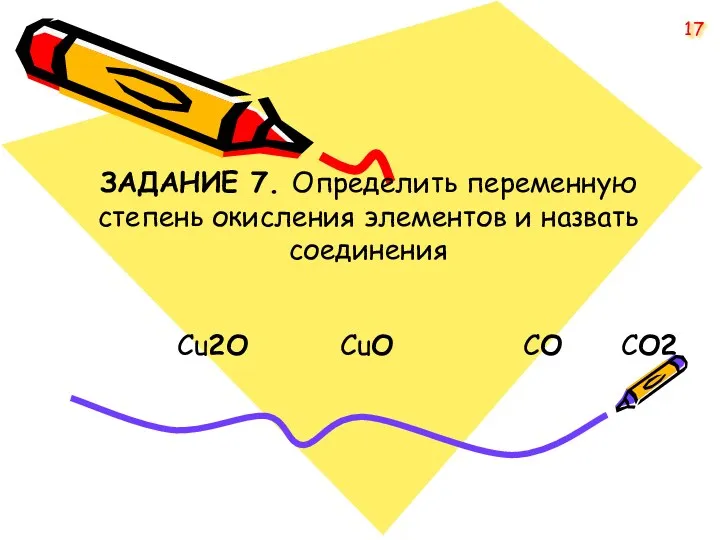
- 17. ЗАДАНИЕ 7. Определить переменную степень окисления элементов и назвать соединения Cu2O CuO СO СО2 17
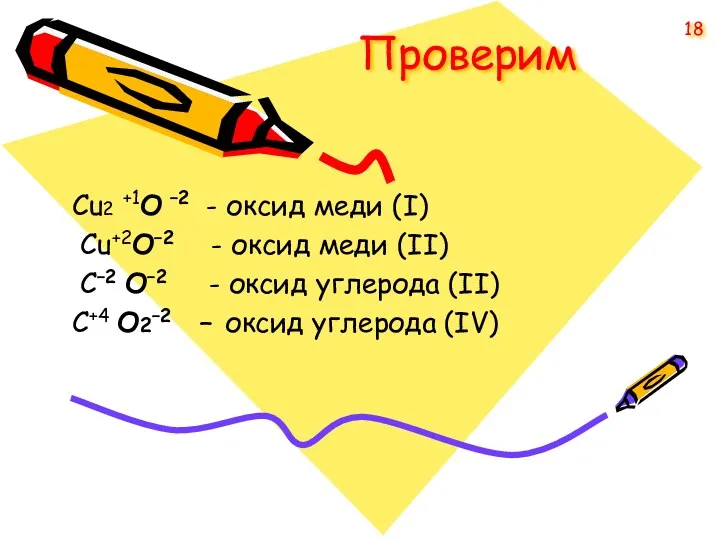
- 18. Проверим Cu2 +1O –2 - оксид меди (I) Cu+2O–2 - оксид меди (II) С–2 O–2 -
- 19. ЗАДАНИЕ 8. Составить формулы бинарных соединений хлорид кальция оксид железа (III) оксид азота (V) 19
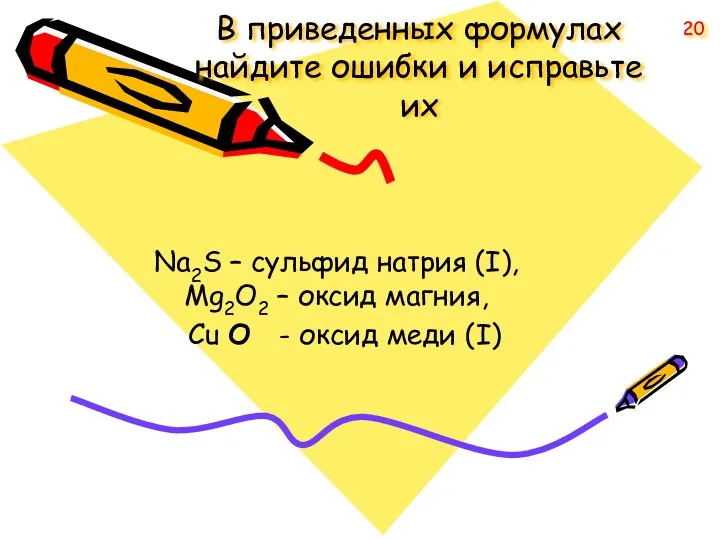
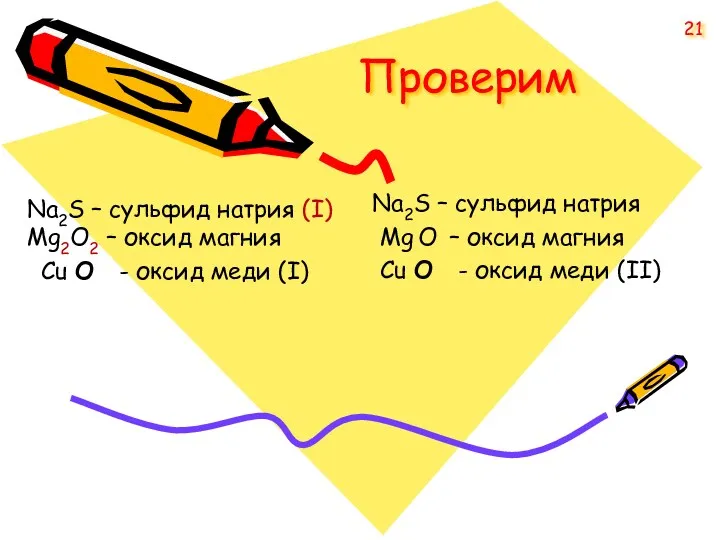
- 20. В приведенных формулах найдите ошибки и исправьте их Na2S – сульфид натрия (I), Mg2O2 – оксид
- 21. Проверим Na2S – сульфид натрия Mg O – оксид магния Cu O - оксид меди (II)
- 23. Скачать презентацию










 Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Строение атома углерода
Строение атома углерода Органические вещества: производные углеводородов
Органические вещества: производные углеводородов Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Водород. Химический элемент
Водород. Химический элемент Соли. Определение солей
Соли. Определение солей Строение атома и атомного ядра. Изотопы
Строение атома и атомного ядра. Изотопы Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Кислоты. 8 класс
Кислоты. 8 класс Первичная переработка нефти
Первичная переработка нефти Строение и электрический заряд коллоидных частиц. Электрокинетические явления
Строение и электрический заряд коллоидных частиц. Электрокинетические явления Химия и косметика
Химия и косметика Нуклеиновые кислоты
Нуклеиновые кислоты Соли как производные кислот и оснований
Соли как производные кислот и оснований Применение серной кислоты
Применение серной кислоты Химия вокруг нас
Химия вокруг нас Устойчивость дисперсных систем
Устойчивость дисперсных систем Химия нефти и газа
Химия нефти и газа Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Стойкие органические загрязнители
Стойкие органические загрязнители Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн
Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Химическая связь и ее типы. Кристаллические решётки
Химическая связь и ее типы. Кристаллические решётки Окисно-відновні реакції та їхнє значення
Окисно-відновні реакції та їхнє значення Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Алюминий и его соединения
Алюминий и его соединения Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены)