Содержание
- 2. Классификация веществ до XIX в. (Абу Бакрар-Рази) Животные Минеральные Растительные Историческая справка
- 3. Долгое время считали, что органические вещества содержатся только в организмах (витализм)
- 4. Берцелиус Йёнс Якоб (1779-1848) Впервые ввел термин органическая химия и органические вещества. Органическую химию определил как
- 5. В середине 19 столетия были проведены первые синтезы органических веществ: 1828 г. нем. химик Ф. Вёлер
- 6. Органическая химия - это химия соединений углерода (Кекуле, середина XIX в.)
- 7. Особенности органических веществ.
- 8. 1) В состав органических веществ входят углерод и водород. 2) Они горючи и при горении образуют
- 9. 4) Органические вещества построены более сложно, чем неорганические, и многие имеют огромную молекулярную массу.
- 10. Самая большая формула: C5750 H7227 О4131 N2215 S690 В составе ДНК бактериофагов (19913 атомов!)
- 11. Строение атома углерода. Валентные состояния атома углерода.
- 12. Графическая и электронная формула внешнего энергетического уровня атома углерода +6С 1s2 2s2 2p2 ……
- 13. Графическая и электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии С* 1s2 2s1 2p3
- 14. Гибридизация – взаимное выравнивание электронных облаков в атоме углерода по форме и энергии (Л.Полинг, 20-е годы
- 15. Типы гибридизации: sp3-гибридизация sp2-гибридизация sp-гибридизация
- 16. Первое валентное состояние 4 гибридных облака Н │ Н – С – Н │ Н
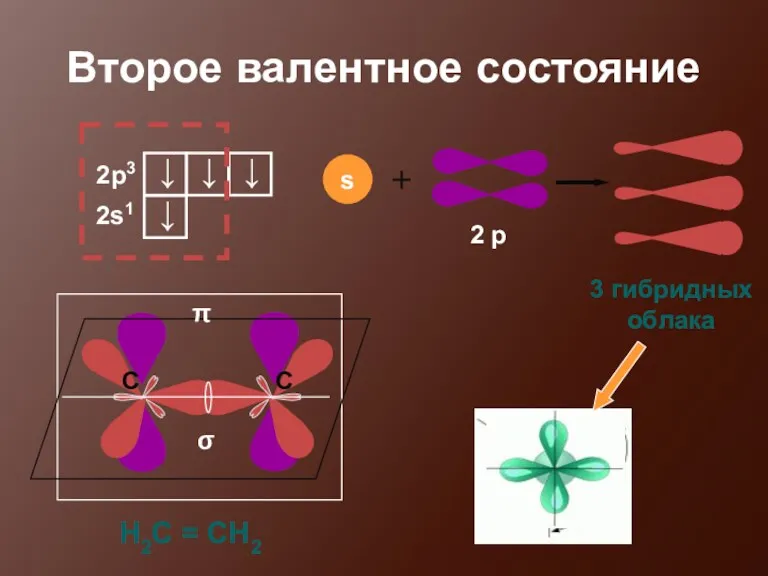
- 17. Второе валентное состояние 3 гибридных облака σ π Н2С = СН2
- 18. σ и π - связи Осевое перекрывание атомных орбиталей, при котором максимальная электронная плотность располагается на
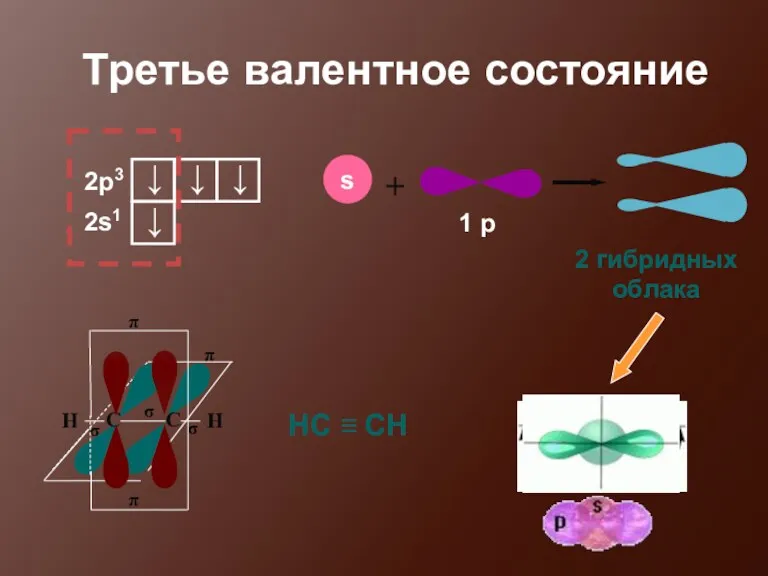
- 19. Третье валентное состояние 2 гибридных облака НС ≡ СН
- 20. ! Чем больше перекрывается электронных областей, тем больше выделяется энергии – тем прочнее связь L C
- 21. Проблемный вопрос: каким образом можно определить величину энергии связи? Е С – С – 339 кДж/моль
- 23. Скачать презентацию


















 Carbohydrates (sugars)
Carbohydrates (sugars) Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение
Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Алюминий. Строение
Алюминий. Строение Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Коллигативные свойства растворов
Коллигативные свойства растворов Элементы теории горения
Элементы теории горения Physiology lab
Physiology lab Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Высокомолекулярные соединения
Высокомолекулярные соединения Сахароза
Сахароза Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Соединения железа
Соединения железа Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Значение органической химии в жизни человека
Значение органической химии в жизни человека Степень окисления в органической химии
Степень окисления в органической химии Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Ионная связь
Ионная связь Строение атома
Строение атома Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химический элемент титан
Химический элемент титан