Содержание
- 2. Мета. Сформувати знання про окисно-відновні реакції. Сформувати поняття про процеси окиснення, відновлення. Навчити розрізняти які з
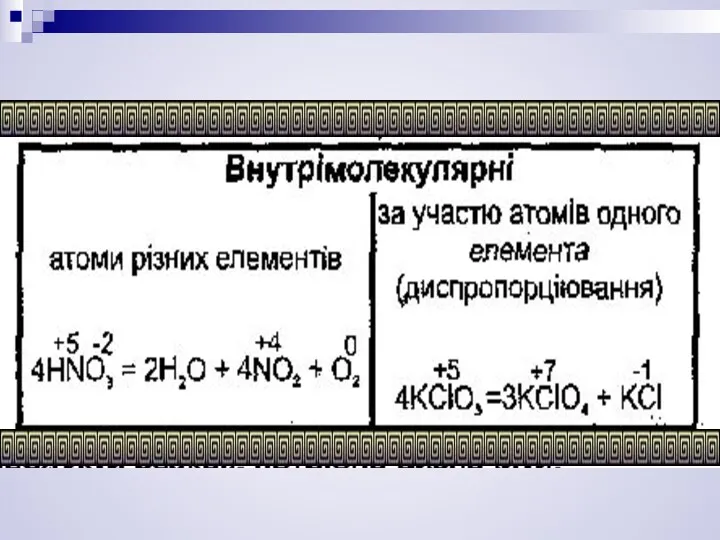
- 3. Окисно - відновними реакціями (ОВР) називають процеси, які здійснюються при переході електронів або атомів від одних
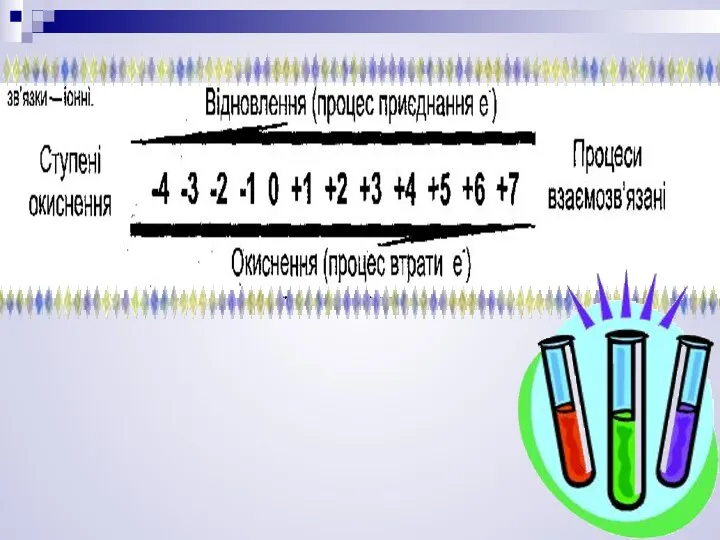
- 15. Ступінь окиснення (С.О.) — умовна величина, що показує заряд того чи іншого елемента в сполуці .
- 16. Низша с.о.= 8 – № групи Нульова с.о.в простих речовинах. Позитивна с.о.= номеру групи.
- 17. С.о. оксигену в оксиді =-2. С.о. водню в сполучені з неметалами=+1. С.о. металів 1 групи гол.підгр.
- 18. Правила складання хімічної формули: 1. На першому місці знаходиться элемент с позитивним ступенем окиснення. 2. На
- 19. H2СO3 H С +1 О -2 +1 -2 Х 2 . (+1) + Х + 3
- 20. Бинари – Оксиди Гідриди Хлориди Сульфіди Нітриди Фосфіди Карбіди Силіциди -2 O -1 H -1 Cl
- 22. Скачать презентацию

















 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей