Содержание
- 2. Взаємодія катіонів чи аніонів солі з молекулами води. В результаті утворюється слабкий електроліт. Сіль– це продукт
- 3. Нерозчинні солі Солі, утворені сильною основою (лугом) і сильною кислотою (HCl, HClO4 , HNO3, H2SO4 )
- 4. 1)Солі, утворені сильною основою і слабкою кислотою (HClO, HNO2, H2S, H2SiO3, H2CO3 включаючи органічні кислоти) гідроліз
- 5. Визначення реакції середовища розчинів солей універсальним індикатором
- 6. 1. Скласти рівняння дисоціації солі, визначити йон слабкого електроліту. AlCl3↔Al3++3Cl- Al3+ - катіон алюмінію, слабка основа,
- 7. Na2CO3↔2Na++CO2 − 3 CO2 − 3 – карбонат - аніон, слабка кислота, гідроліз по аніону. CO2
- 8. У випадку гідролізу солі , утвореної слабкою основою і слабкою кислотою, утворюються кінцеві продукти– слабка основа
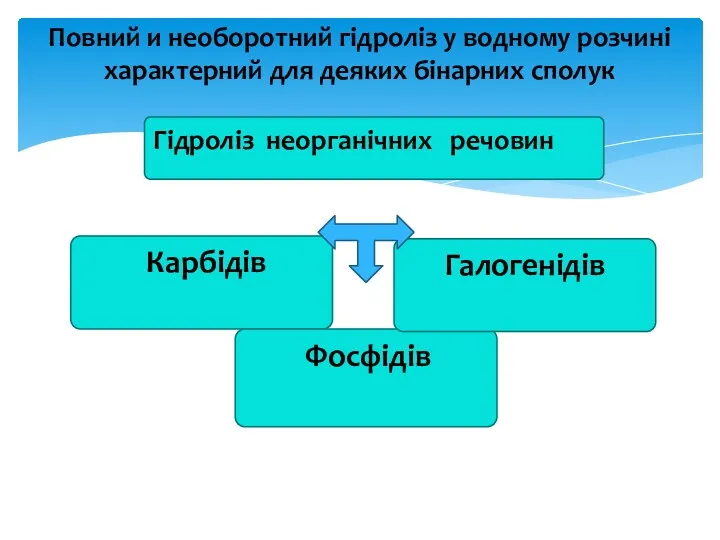
- 9. Гідроліз неорганічних речовин Повний и необоротний гідроліз у водному розчині характерний для деяких бінарних сполук Карбідів
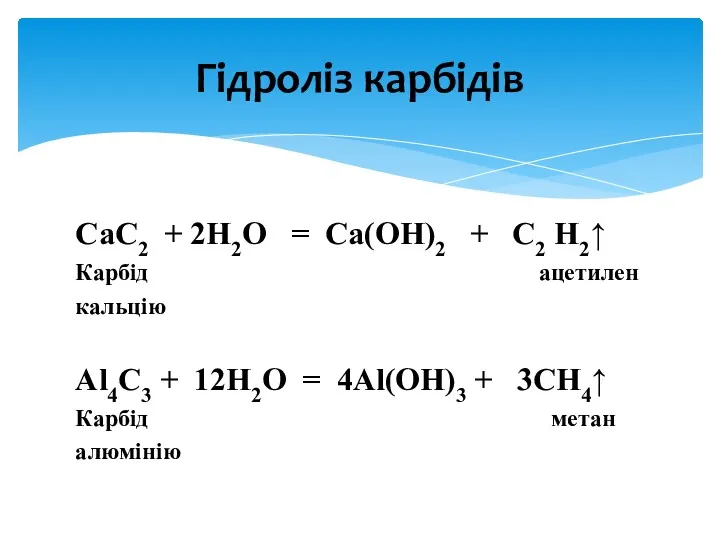
- 10. CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбід ацетилен кальцію Al4C3 + 12H2O = 4Al(OH)3
- 11. SiCl4 + 3H2O = H2SiO3↓ + 4HСl хлорид силікатна силіцію (+4) кислота Са3P2 + 6H2O =
- 12. Умови посилення і послаблення гідролізу: Для оборотного гідролізу умови зміщення рівноваги визначаються принципом Ле Шателье
- 13. Як зміститься хімічна рівновага в системі Zn2+ + H2O↔ ZnOH+ + H+ – Q 1) при
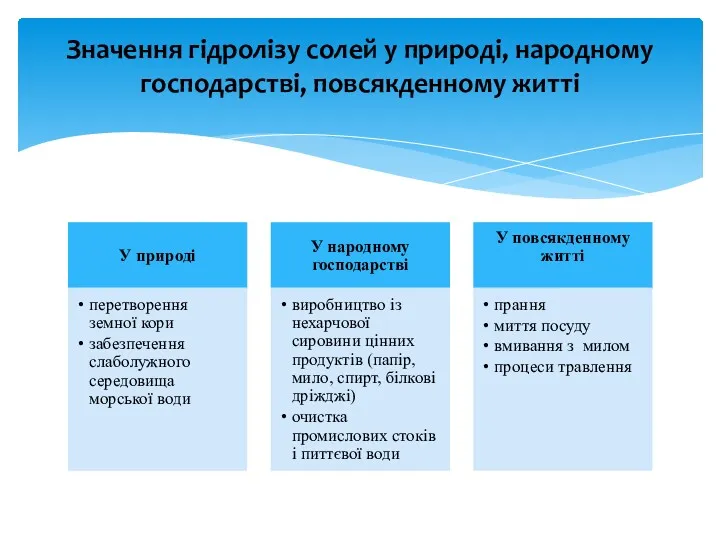
- 14. Значення гідролізу солей у природі, народному господарстві, повсякденному житті
- 15. 1. Сьогодні я дізнався … 2. Було цікаво … 3. Було складно… 4.Я зрозумів, що …
- 17. Скачать презентацию











 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей