Содержание
- 2. Как же химики судят о том, является ли данное вещество кислотой? Растворы всех кислот на вкус
- 3. 1)Что такое индикаторы? 2)Какие индикаторы вы знаете? 3) Как индикаторы меняют цвет в щелочной среде?
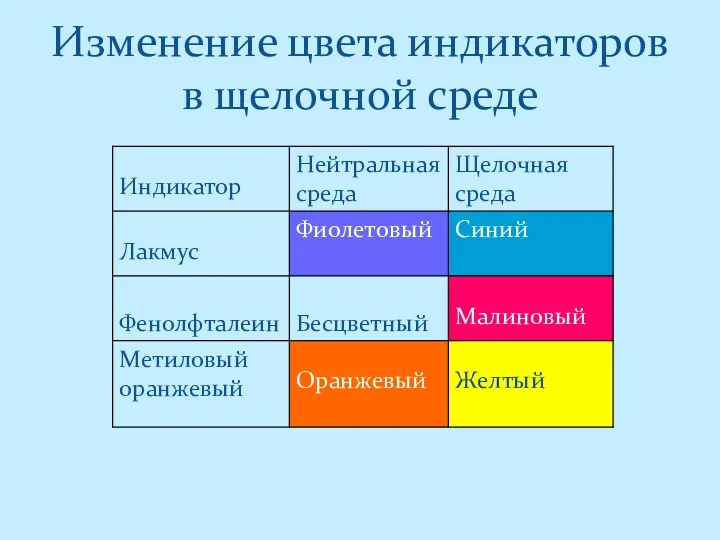
- 4. Изменение цвета индикаторов в щелочной среде
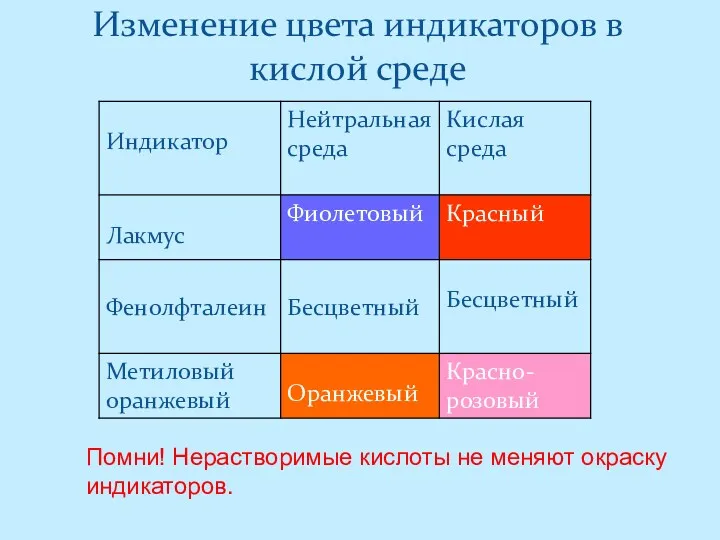
- 5. Изменение цвета индикаторов в кислой среде Помни! Нерастворимые кислоты не меняют окраску индикаторов.
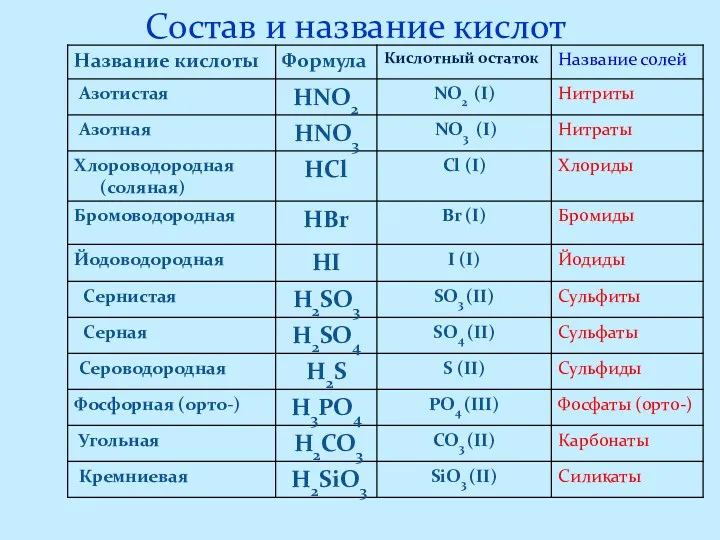
- 6. Состав и название кислот
- 7. Кислоты – это сложные вещества, молекулы которых состоят из одного или нескольких атомов водорода, способных заместиться
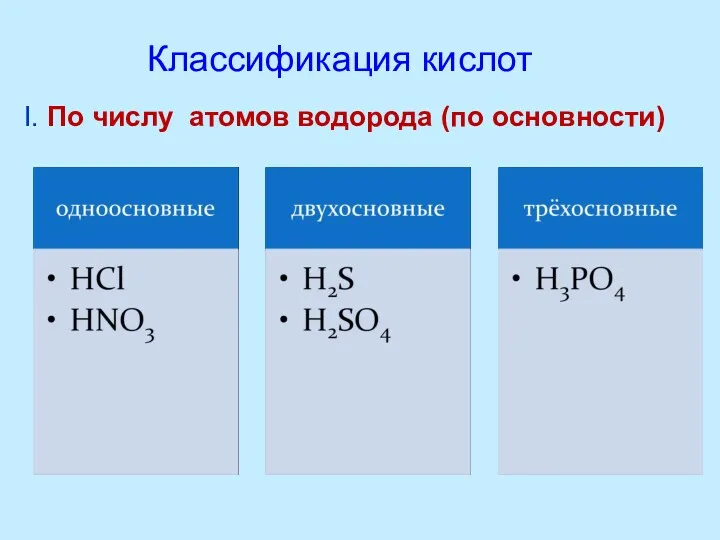
- 8. I. По числу атомов водорода (по основности) Классификация кислот
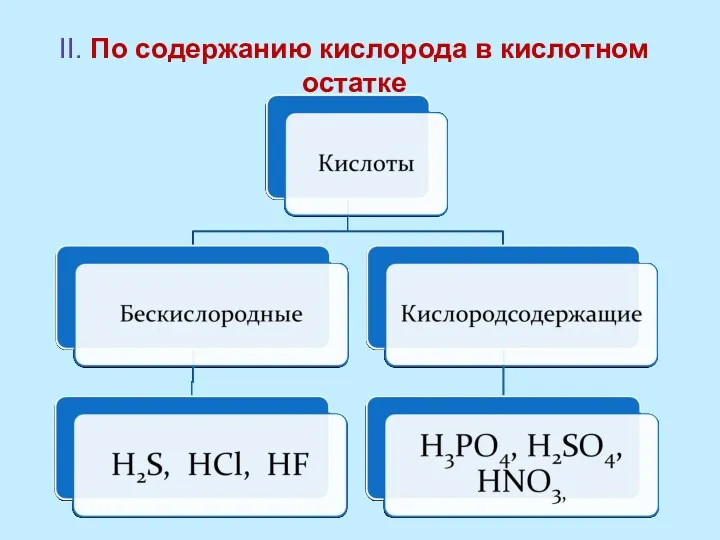
- 9. II. По содержанию кислорода в кислотном остатке
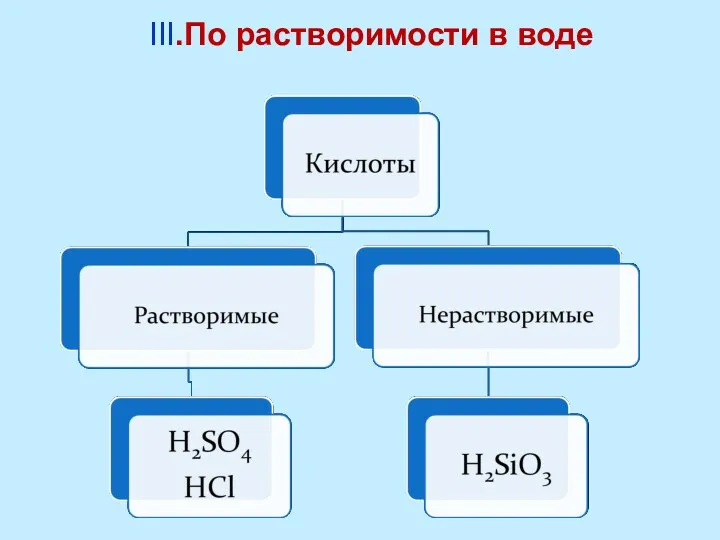
- 10. III.По растворимости в воде
- 13. Серная кислота - двухосновная, кислородсодержащая кислота. Физические свойства: бесцветная, вязкая жидкость, без запаха, вдвое тяжелее воды,
- 14. Обугливание лучинки серной кислотой (конц.)
- 15. Обугливание сахара конц. серной кислотой
- 16. Соляная кислота Соляная кислота содержится в желудочном соке, способствует пищеварению и убивает болезнетворные бактерии. Соляная кислота
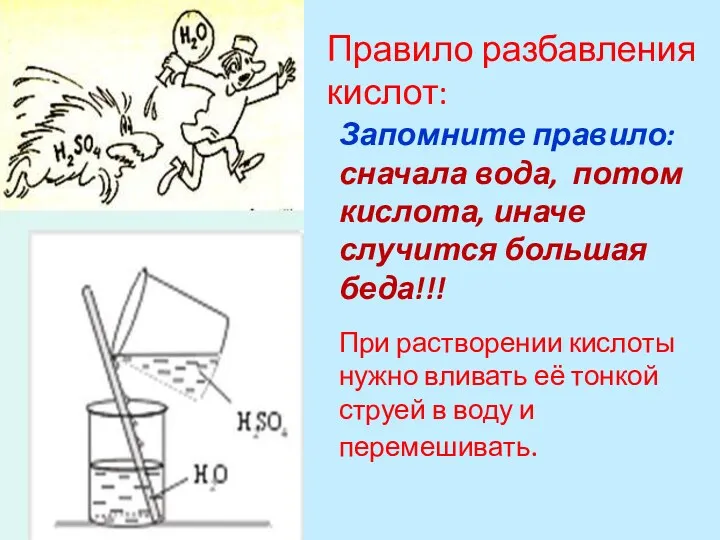
- 17. Правило разбавления кислот: При растворении кислоты нужно вливать её тонкой струей в воду и перемешивать. Запомните
- 19. ЕСЛИ КИСЛОТА ПОПАЛА НА КОЖУ: Поражённый участок кожи промывают сильно скользящей струей холодной воды в течение
- 20. H2CO3 CO2↑ + H2O H2SO3 SO2↑ + H2O В свободном виде угольная и сернистая кислоты не
- 21. Как узнать, какие оксиды соответствуют данным кислотам? Помните, что суммарная степень окисления атомов всех элементов в
- 22. Проверь себя Выберите группу веществ, в состав которой входят только кислоты: 1) HCl, SO3, NaOH,CuCl2 2)HNO3,
- 23. Проверь себя Выберите группу веществ, в состав которой входят только двухосновные кислоты: 1) HNO3, H2S, HCl,
- 24. 1) HNO3, H2S, HCl, H2CO3 2)HCl, H2SO4, H2SiO3, H2SO3 3)H2S, HNO3, H2SO3, H3PO4 4)HNO3, H2SO4, H3PO4,
- 25. Проверь себя В кислой среде синий лакмус становится: 1) фиолетовым 2) красным 3) малиновым 4) не
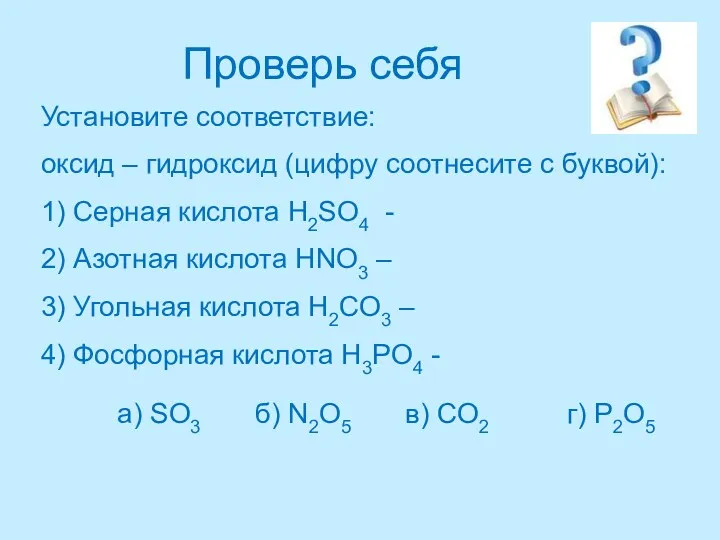
- 26. Проверь себя Установите соответствие: оксид – гидроксид (цифру соотнесите с буквой): 1) Серная кислота H2SO4 -
- 27. Вспомните правило разбавления кислот
- 29. Скачать презентацию

















 Неметаллические материалы
Неметаллические материалы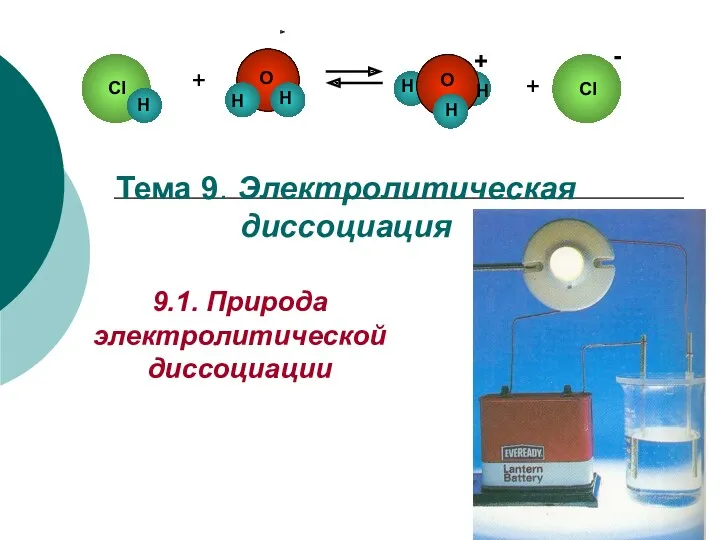 Электролитическая диссоциация
Электролитическая диссоциация Основные характеристики клеев
Основные характеристики клеев Взаємодія кисню із складними речовинами
Взаємодія кисню із складними речовинами Полимеры. Мономер
Полимеры. Мономер Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Инструменты и приспособления для химической завивки волос
Инструменты и приспособления для химической завивки волос Хлорид натрия
Хлорид натрия Органическая химия. Жиры
Органическая химия. Жиры Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Продукция UNIL
Продукция UNIL Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Химический элемент кремний
Химический элемент кремний Магматические горные породы
Магматические горные породы Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Углеводы. Сn(H2O)m – общая формула углеводов
Углеводы. Сn(H2O)m – общая формула углеводов Общая электронная формула внешнего слоя
Общая электронная формула внешнего слоя Простые вещества
Простые вещества Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Незвичайна вода
Незвичайна вода Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Алкадиены
Алкадиены Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Коррозия металлов
Коррозия металлов ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс)