Содержание
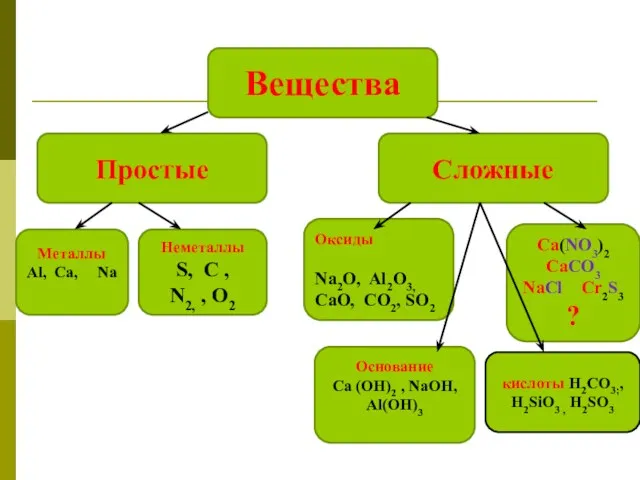
- 2. Вещества Простые Сложные Металлы Аl, Ca, Na Неметаллы S, С , N2, , О2 Оксиды Na2O,
- 3. СОЛИ , как производные кислот и оснований.
- 4. Цель урока: Изучить состав, названия солей, классификацию, свойства и применение. План 1.Соли. Их состав и номенклатура
- 5. 1. Соли. Их состав и номенклатура (название).
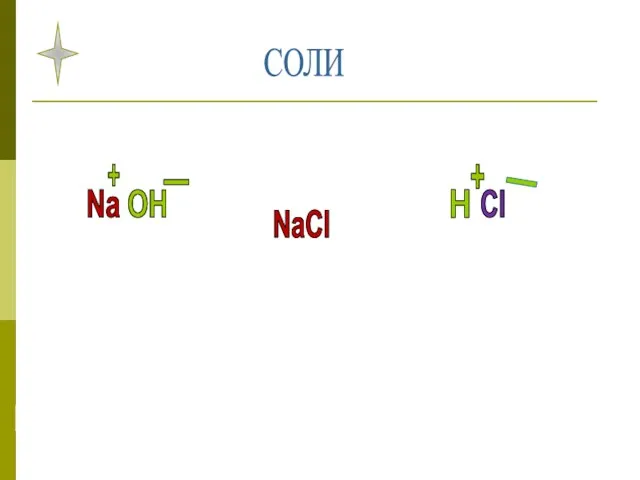
- 6. СОЛИ Na OH H Cl NaCl + - + _
- 7. Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
- 8. 1 задание. Определить : почему у солей разное количество кислотных остатков Дайте обоснованный ответ. NaNO3 Ca
- 9. Ответ на 1 задание. Na+1 Ca+2 Al+3 Имеют разную степень окисления. (см. таблицу растворимости)
- 10. задание 2. Определить : почему у солей разное количество ионов металла? Дайте обоснованный ответ. NaNO3 Na
- 11. Ответ на задание 2 Так как кислотные остатки имеют свою степень окисления: (см. таблицу растворимости) NO2-1-
- 12. Выведем общую формулу солей? Ме+n (К. О.-m)n
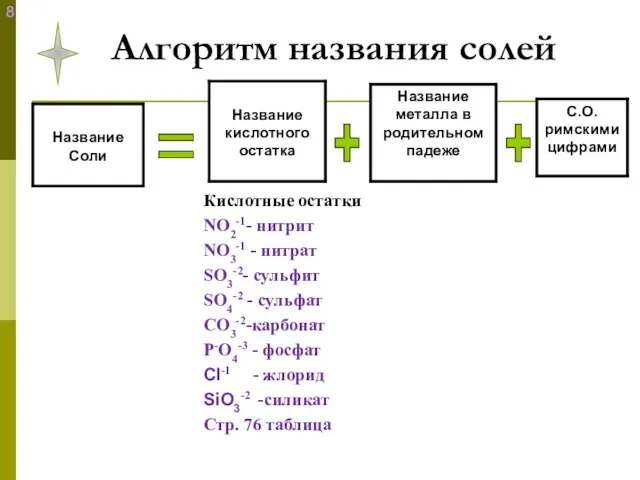
- 13. Алгоритм названия солей + + =
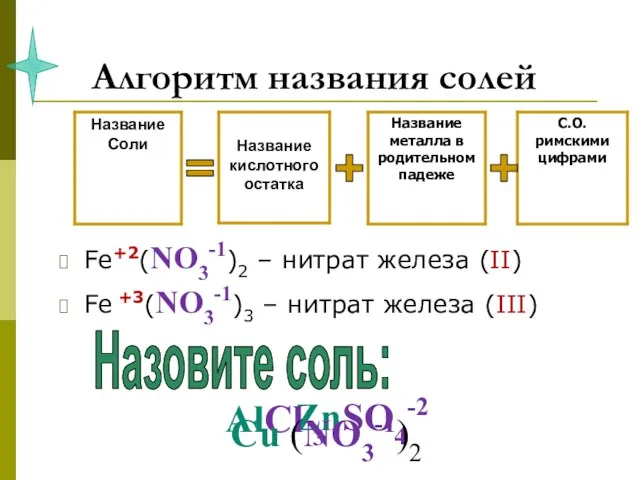
- 14. Алгоритм названия солей Fe+2(NO3-1)2 – нитрат железа (II) Fe +3(NO3-1)3 – нитрат железа (III) = +
- 15. задание 5. НАЗОВИТЕ СОЛИ NaCl Fe +2SO4 Al3(PO4)3 Ca(NO3)2 Cu+2CO3 Cr2+3S3 Na2SO4 Ba(NO3 )2
- 16. задание 5. НАЗОВИТЕ СОЛИ NaCl - хлорид натрия Fe +2SO4 - сульфат железа (II) Al3(PO4)3 –
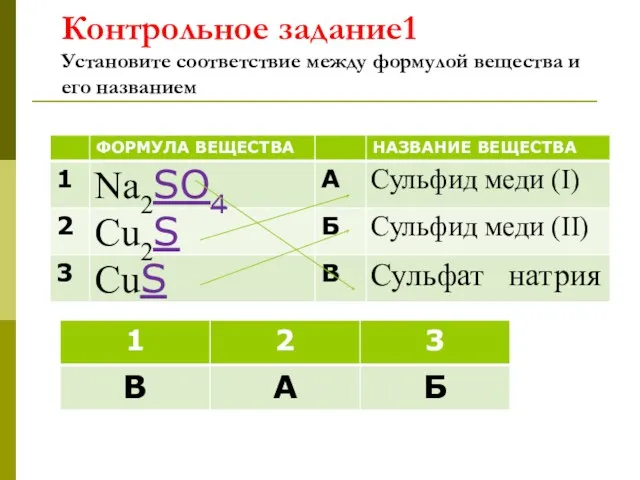
- 17. Контрольное задание1 Установите соответствие между формулой вещества и его названием
- 18. 2. Составление формул солей по их названиям.
- 19. 1. Запиши рядом знаки химических элементов, которые входят в состав вещества. Алгоритм составления формул солей: Составить
- 20. 2. Над знаками химических элементов поставь их степень окисления. Пример: Fe SO4 +3 -2 Второй пункт
- 21. 3. Определи Н.О.К. чисел выражающих степень окисления этих элементов. Запиши Н.О.К. в квадратике над формулой. Пример:
- 22. 4. Раздели Н.О.К. на степень окисления каждого элемента. Запиши полученный индекс. Пример: Составить химическую формулу сульфата
- 23. Составить формулу сульфата алюминия: (второй способ) Составьте формулы: Упр. 3 стр. 78 Al 2 + SO
- 24. Составьте формулу хлорида кальция СаCl2 Составьте формулу нитрата натрия NaNO3 Zn(SO4)2 Cu NO3 Составьте формулу сульфата
- 25. NaCl
- 26. "Среди всех природных минеральных солей, самая главная та, которую мы называем просто “соль” А.Е.Ферсман
- 27. За 4 года человек съедает пуд соли (в год человек с пищей потребляет 3-5,5 кг соли)
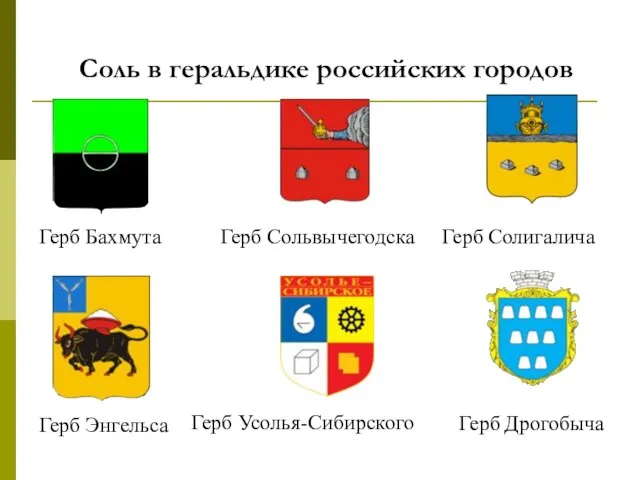
- 28. Соль в геральдике российских городов Герб Бахмута Герб Солигалича Герб Сольвычегодска Герб Энгельса Герб Усолья-Сибирского Герб
- 29. Добыча соли из соляных шахт из соленых озер
- 30. На озере Баскунчак ежегодно добывается около 5 млн. тонн соли
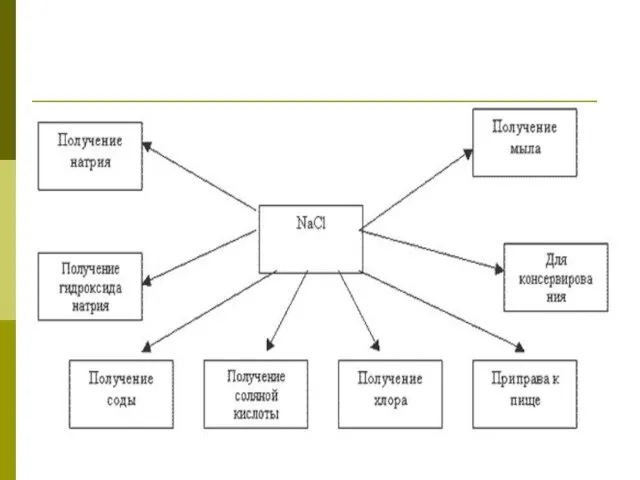
- 31. Применение NaCl
- 32. CaCO3
- 33. Моллюски, раки, радиолярии, кораллы – все имеют известковый скелет
- 34. Большой Барьерный риф в Австралии
- 35. Меловые горы
- 36. Минералы карбоната кальция находятся в горных породах: Известняк Мел Мрамор Мрамор Мрамор Мрамор Травертин
- 37. Мрамор – строительный материал Единственное в России здание, полностью построенное из нешлифованного мрамора — железнодорожный вокзал
- 38. Фосфат кальция - основа минералов фосфоритов и апатитов
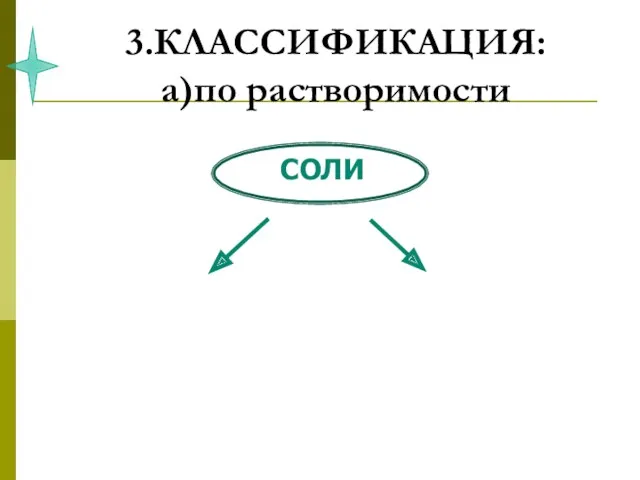
- 39. 3.КЛАССИФИКАЦИЯ: а)по растворимости
- 40. 3.КЛАССИФИКАЦИЯ: а)по растворимости NaCl CaCO3 таблица растворимости
- 41. а)по составу
- 42. Лабораторный опыт. №2 Определите в какой из трех пробирок находятся кислота, в какой щелочь, в какой
- 44. Скачать презентацию































 Кислоты
Кислоты Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Аналитическая химия. Количественный анализ (ч.1. титриметрия)
Аналитическая химия. Количественный анализ (ч.1. титриметрия) Растворение. Растворы. Физическая теория
Растворение. Растворы. Физическая теория Хімічний зв’язок. Типи хімічного зв’язку
Хімічний зв’язок. Типи хімічного зв’язку Синтетичні волокна
Синтетичні волокна Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Кислотно-основное титрование. Алкалиметрия
Кислотно-основное титрование. Алкалиметрия Хроматографические методы в радиохимии
Хроматографические методы в радиохимии Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар Кислородные соединения азота
Кислородные соединения азота Изомерия биоорганических соединений. Структура и функции биолекул
Изомерия биоорганических соединений. Структура и функции биолекул Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Теория резонанса в неорганической химии
Теория резонанса в неорганической химии Бордың адам ағзасына әсері. Бор дегеніміз не?
Бордың адам ағзасына әсері. Бор дегеніміз не? Предмет физической и коллоидной химии. Термодинамика
Предмет физической и коллоидной химии. Термодинамика Поверхностно-активные вещества (ПАВ)
Поверхностно-активные вещества (ПАВ) Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Аморфные материалы
Аморфные материалы Органические вещества
Органические вещества Элементы термодинамики. Кинетика химических реакций
Элементы термодинамики. Кинетика химических реакций Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Кислотність твердих тіл. Основні методи дослідження. Суперкислотність
Кислотність твердих тіл. Основні методи дослідження. Суперкислотність Этиловый спирт в жизни человека
Этиловый спирт в жизни человека Уравнения химических реакций
Уравнения химических реакций