Содержание
- 2. Гілберт Ньютон Льюїс (23.10.1875(23.10.1875 — 23.03.(23.10.1875 — 23.03.1946) — видатний американський фізикохімік Йоханнес-Ніколаус Бренстед (22.02 (22.02.1879
- 3. Кислоти та основи Льюїса
- 4. Взаємний перехід Льюїсових та Бренcтедових центрів Ls+ + Н2О = (L:OH) + Нs+. Кислотний поверхневий центр
- 5. Міра кислотності твердих речовин Сила кислотних центрів Число кислотних центрів Сила кислотних центрів поверхні твердого тіла
- 6. Кислотність поверхні каталізаторів для реакції гідратації пропілену Fe2(SO4)3 > Al2(SO4)3 > Cr2(SO4)3 > CuSO4 > ZnSO4
- 7. Попередня оцінка кислотності поверхні a = (ra/rc)/Z2, де а – кислотна функція, ra - радіус аніона,
- 8. Кислотність Бренстеда за Гамметом До поняття твердої кислоти Бренстеда (H+) та певної основи (В) додано поняття
- 9. Індикатори Гаммета - спеціальний набір основ В, які розташовуються у певній послідовності і здатні змінювати забарвлення
- 10. Індикатори Гаммета Гамметом було введено функцію H0: де Kа- константа рівноваги дисоціації кислоти. В момент зміни
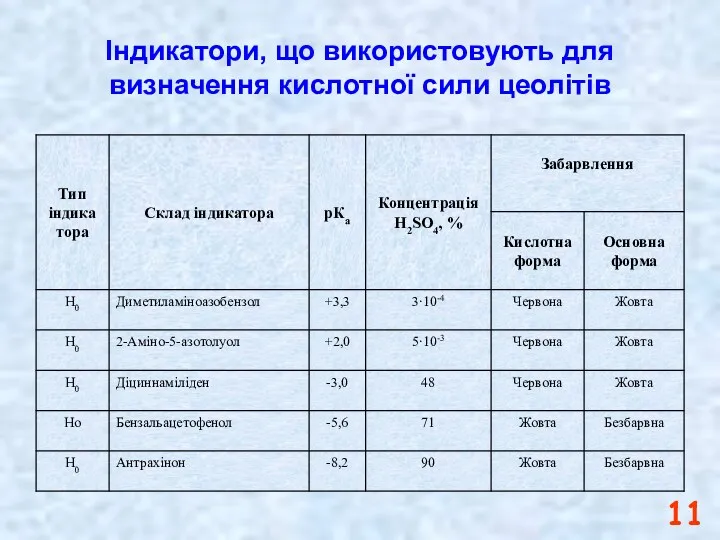
- 11. Індикатори, що використовують для визначення кислотної сили цеолітів
- 12. Кислотність Льюїса за Гамметом L – Льюїсовий кислотний центр, В – основа, L:B – форма основи,
- 13. За допомогою індикаторів Гаммета можна встановити: Перехід забарвлення індикатора Гаммета з певною величиною рКа означає, що
- 14. Кислотність за Гамметом різних твердих речовин
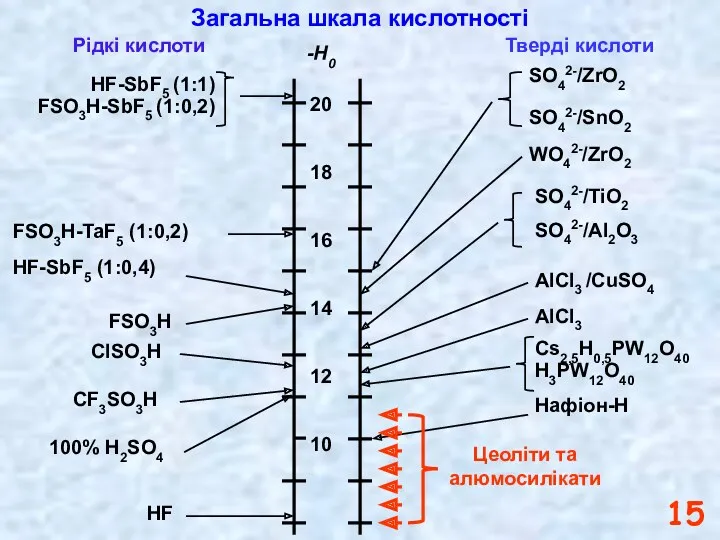
- 15. 20 18 16 14 12 10 -H0 WO42-/ZrO2 AlCl3 /CuSO4 AlCl3 Нафіон-Н HF-SbF5 (1:1) FSO3H-SbF5 (1:0,2)
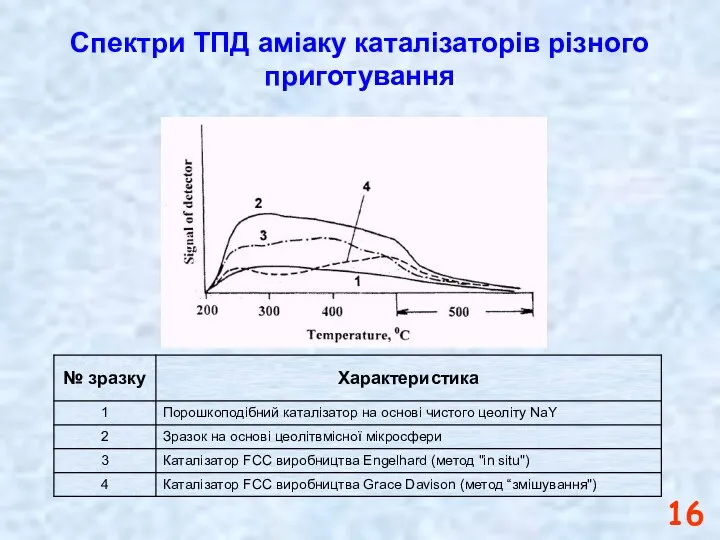
- 16. Спектри ТПД аміаку каталізаторів різного приготування
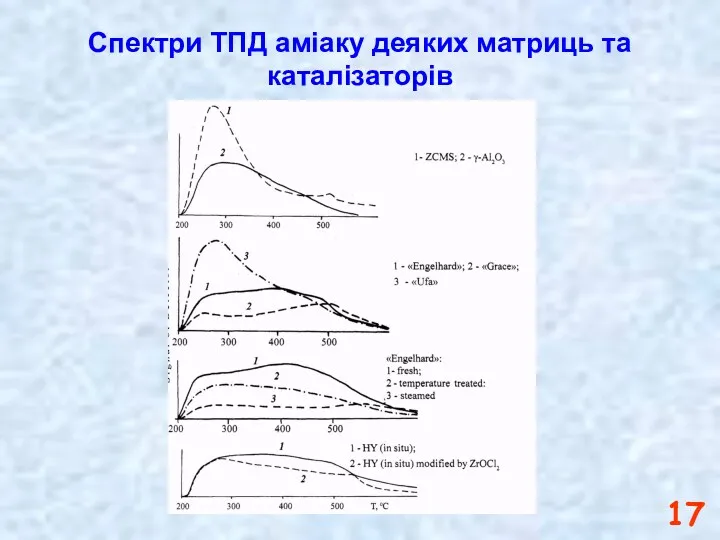
- 17. Спектри ТПД аміаку деяких матриць та каталізаторів
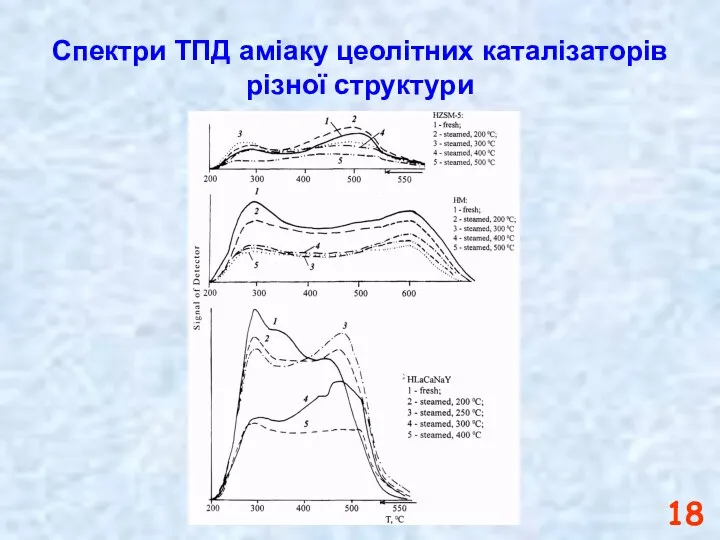
- 18. Спектри ТПД аміаку цеолітних каталізаторів різної структури
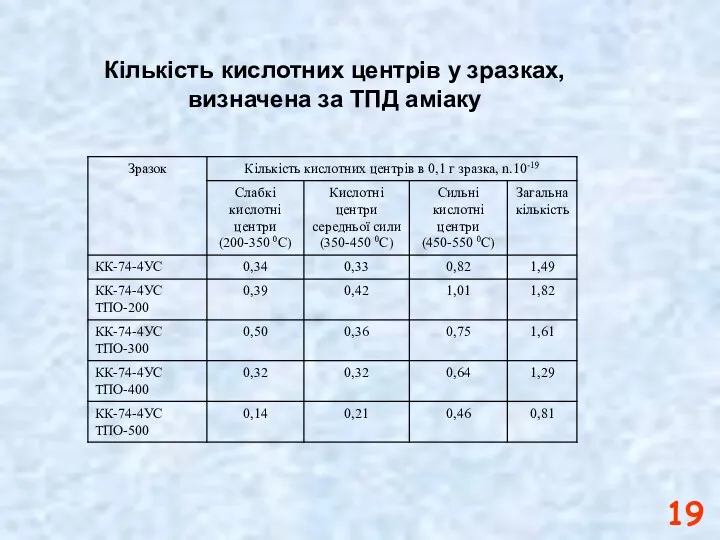
- 19. Кількість кислотних центрів у зразках, визначена за ТПД аміаку
- 20. Метод термопрограмованої десорбції Рівняння Анемонія-Цвєтановича ln (β/Tp2) = A – (E/RTp), де Е – енергія активації
- 21. Значення температурних максимумів Т1 та Т2 в залежності від швидкості підйому температури десорбції β для зразка
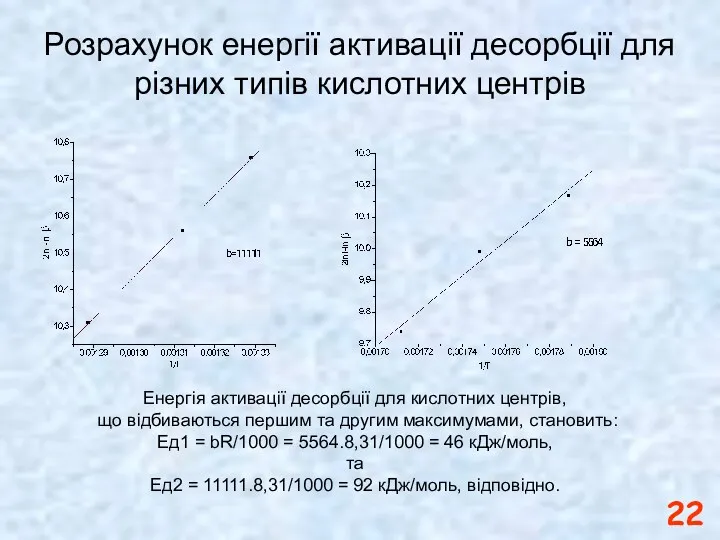
- 22. Розрахунок енергії активації десорбції для різних типів кислотних центрів Енергія активації десорбції для кислотних центрів, що
- 24. Скачать презентацию














 Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Побочная подгруппа 6 и 7 групп
Побочная подгруппа 6 и 7 групп Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9
Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Алюминий и его сплавы
Алюминий и его сплавы Азотистые гетероциклические соединения
Азотистые гетероциклические соединения От алхимии к химии
От алхимии к химии Витамины молока и молочных продуктов. Жирорастворимые витамины
Витамины молока и молочных продуктов. Жирорастворимые витамины Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий. Группы элементов
Алюминий. Группы элементов Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Сера и ее важнейшие соединения
Сера и ее важнейшие соединения Разделение неоднородных систем
Разделение неоднородных систем Carbohydrate metabolism
Carbohydrate metabolism Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Номенклатура органических соединений
Номенклатура органических соединений Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Урок + презентация Азот. 9 класс.
Урок + презентация Азот. 9 класс. Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Класифікація та властивості оксидів
Класифікація та властивості оксидів Взрывоопасные грузы
Взрывоопасные грузы Кремний. Основные минералы кремния
Кремний. Основные минералы кремния Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Перегонка с водяным паром
Перегонка с водяным паром Благородные газы
Благородные газы