Содержание
- 2. Теория резонанса развита в рамка метода ВС Распределение электронов в молекулах (сложных ионах или радикалах), является
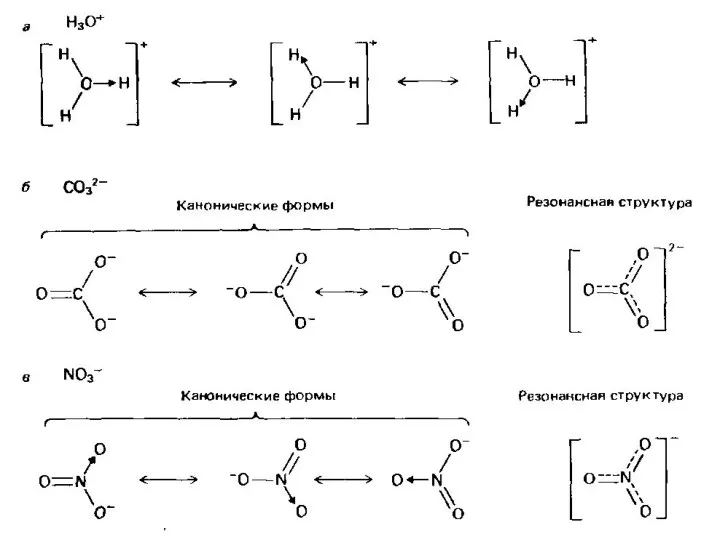
- 4. Теория резонанса В своем простейшем виде она гласит, что если для соединения мы можем нарисовать две
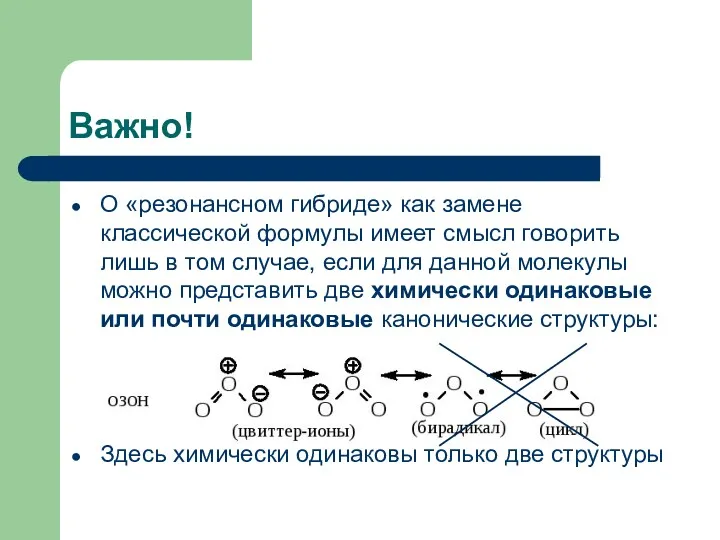
- 5. Важно! О «резонансном гибриде» как замене классической формулы имеет смысл говорить лишь в том случае, если
- 6. Базовые правила 1. Положение ядер во всех канонических формах должно быть одинаковым. Изомеры, в том числе
- 7. Для молекулы оксонитрида азота N2O можно записать шесть канонических форм: Реальный вклад в гибридно-резонансную структуру будут
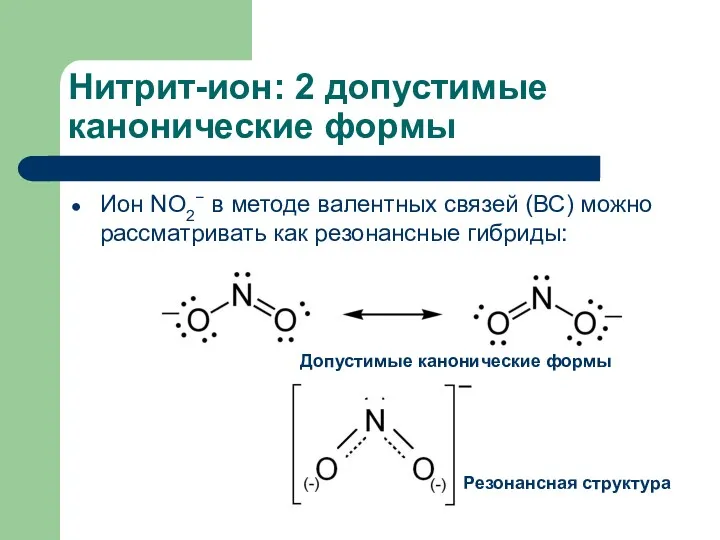
- 8. Нитрит-ион: 2 допустимые канонические формы Ион NO2− в методе валентных связей (ВС) можно рассматривать как резонансные
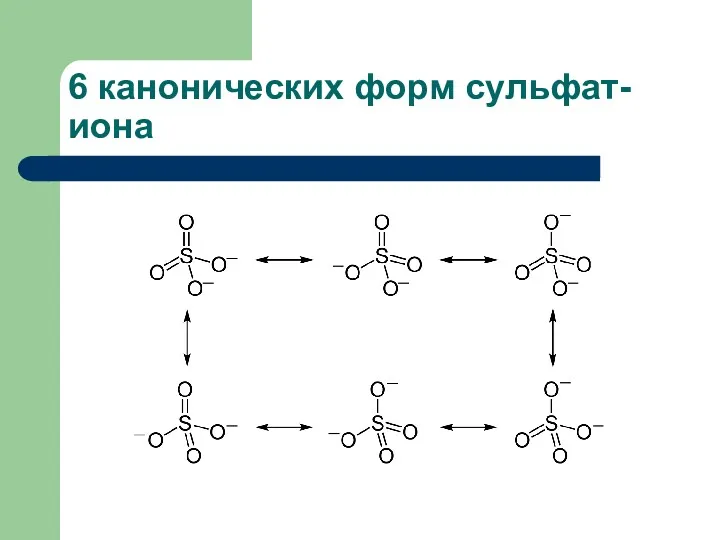
- 9. 6 канонических форм сульфат-иона
- 10. Значение электроотрицательности Почему не существует таких соединений, как H4S и H6S, где сера тоже проявляет валентность
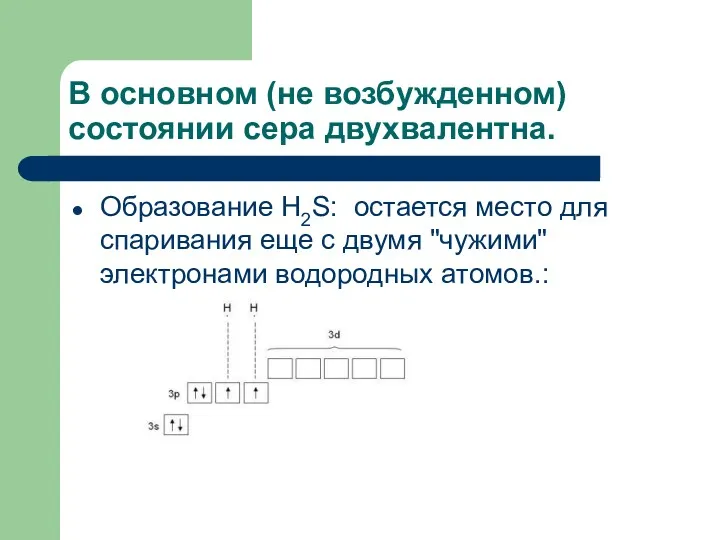
- 11. В основном (не возбужденном) состоянии сера двухвалентна. Образование H2S: остается место для спаривания еще с двумя
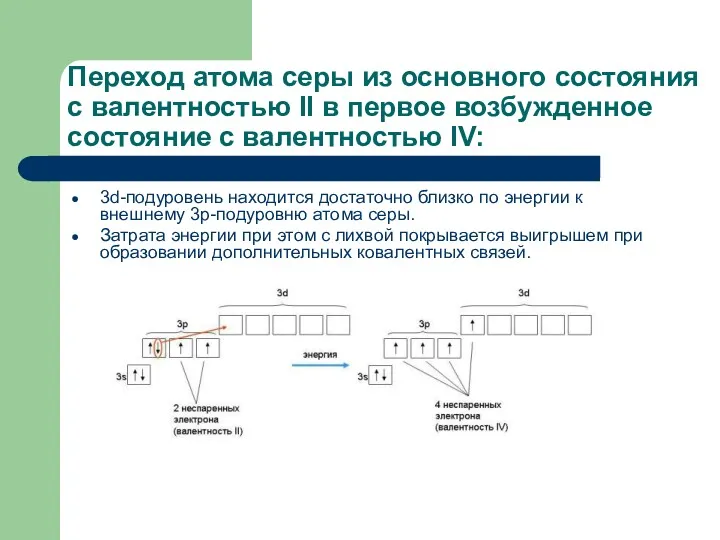
- 12. Переход атома серы из основного состояния с валентностью II в первое возбужденное состояние с валентностью IV:
- 13. Соблюдается ли правило октета? На первый взгляд, у атома серы оказывается избыток (10 электронов) и такая
- 14. Объяснение заключается в большой разнице электроотрицательностей серы (X = 2,58) и кислорода (X = 3,44) Можно
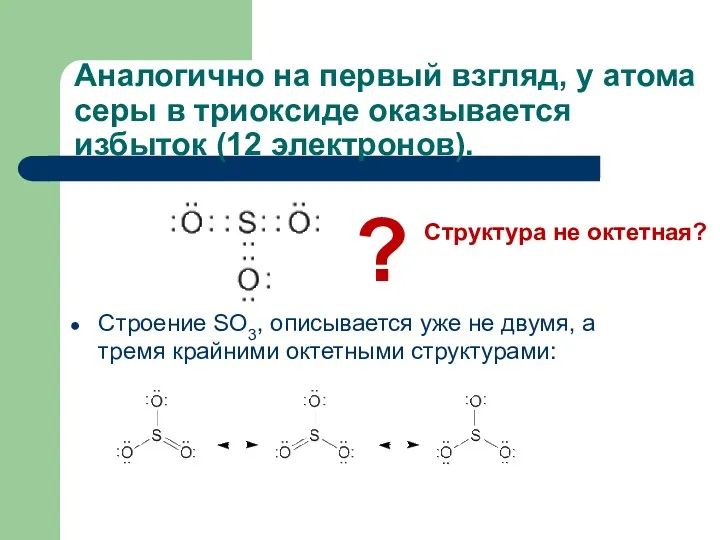
- 15. Аналогично на первый взгляд, у атома серы в триоксиде оказывается избыток (12 электронов). Строение SO3, описывается
- 16. Почему не существует H4S и H6S, где сера тоже проявляет валентность (IV) и (VI)? В этом
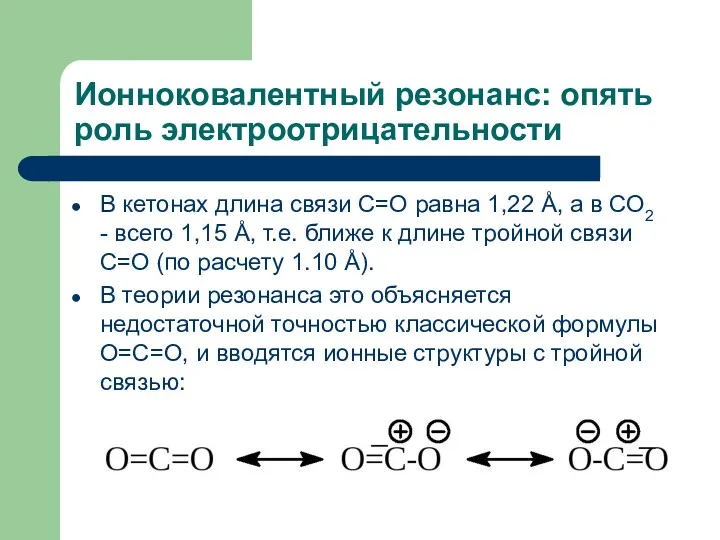
- 17. Ионноковалентный резонанс: опять роль электроотрицательности В кетонах длина связи С=О равна 1,22 Å, а в СО2
- 18. Трудности предсказания канонических форм с близкими энергиями Резонансные структуры не вытекают из квантовой механики, а в
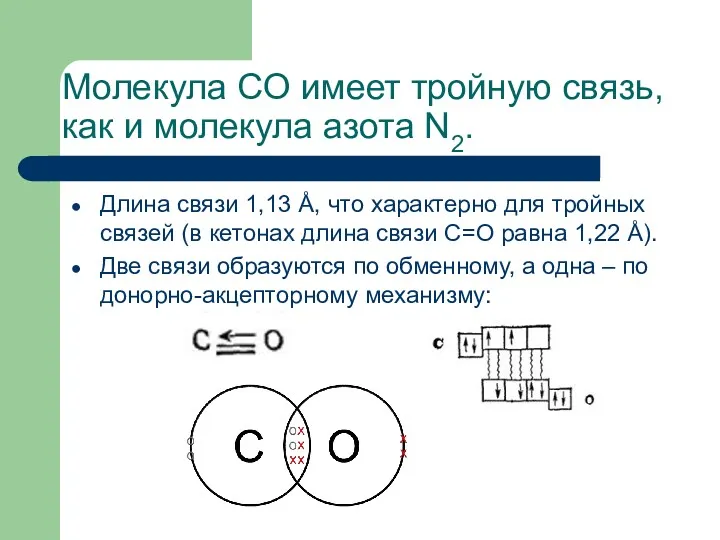
- 19. Молекула CO имеет тройную связь, как и молекула азота N2. Длина связи 1,13 Å, что характерно
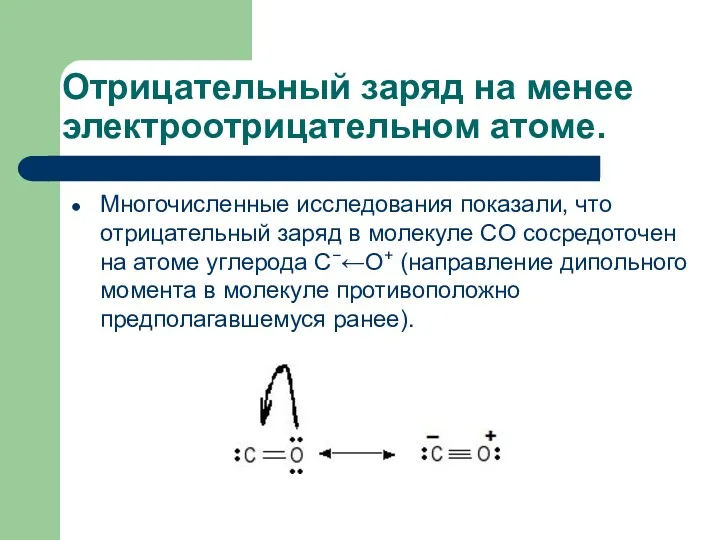
- 20. Отрицательный заряд на менее электроотрицательном атоме. Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен
- 22. Скачать презентацию









 Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Алюминий и его соединения
Алюминий и его соединения Дипломная работа. Тема: Получение гальванических покрытий на основе цинка
Дипломная работа. Тема: Получение гальванических покрытий на основе цинка Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Спирты. Виды спирта
Спирты. Виды спирта Основные классы неорганических веществ. Соединения химических элементов
Основные классы неорганических веществ. Соединения химических элементов Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Решение задач по теме: «Электролиз»
Решение задач по теме: «Электролиз» Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Альдегіди. Номенклатура альдегідів
Альдегіди. Номенклатура альдегідів Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Спирти
Спирти Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Виды химической связи
Виды химической связи Азот и его соединения
Азот и его соединения Химическая коррозия
Химическая коррозия Природні джерела вуглеводнів. Нафта
Природні джерела вуглеводнів. Нафта Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Законы химии
Законы химии Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Серная кислота
Серная кислота Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Химическое загрязнение атмосферы
Химическое загрязнение атмосферы Фазовое равновесие
Фазовое равновесие Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер
Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер