Содержание
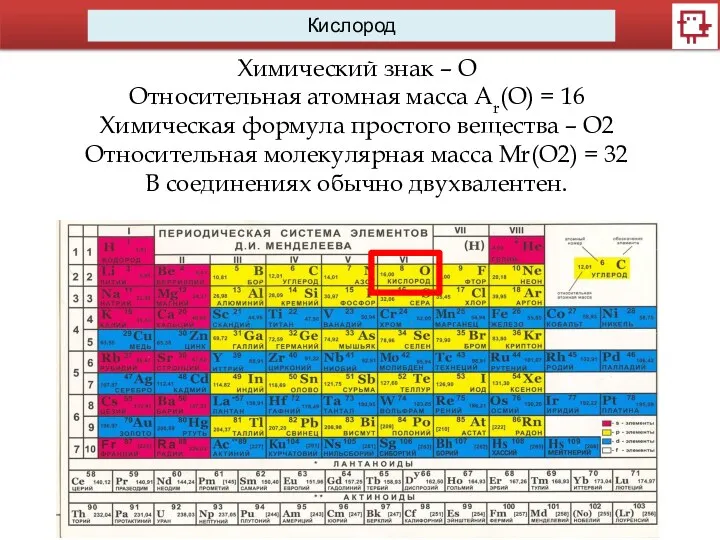
- 2. Кислород Химический знак – О Относительная атомная масса Ar(O) = 16 Химическая формула простого вещества –
- 3. Нахождение в природе Кислород - самый распространённый химический элемент в земной коре. Кислород составляет 0.209 объёмых
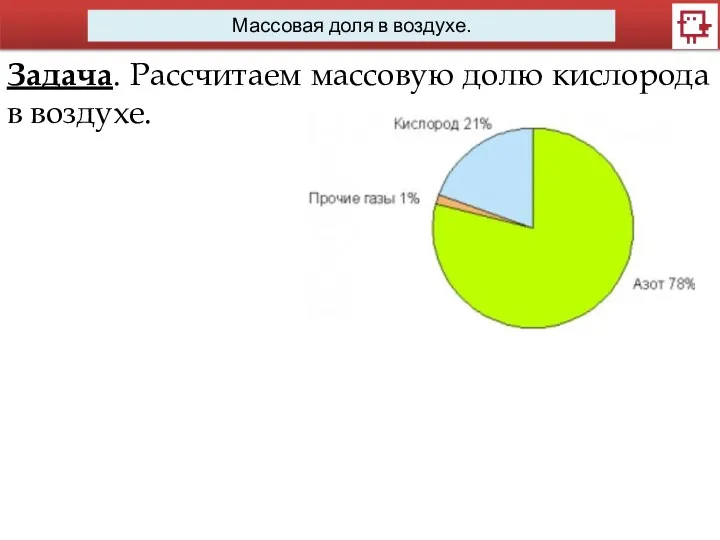
- 4. Массовая доля в воздухе. Задача. Рассчитаем массовую долю кислорода в воздухе.
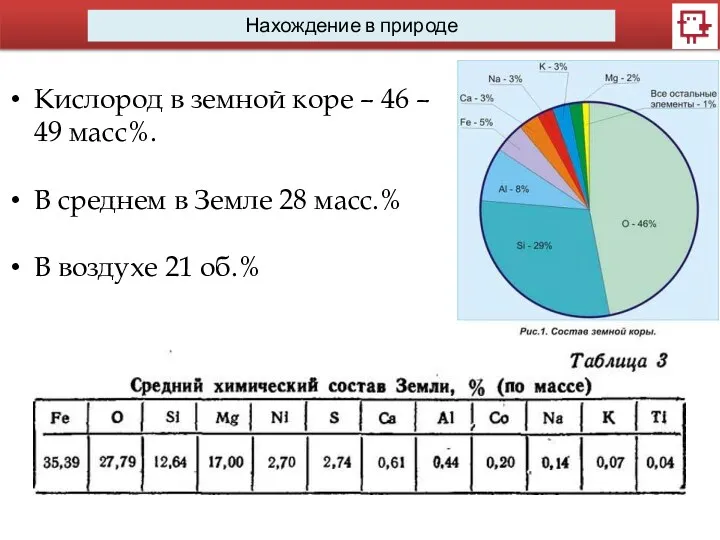
- 5. Нахождение в природе Кислород в земной коре – 46 – 49 масс%. В среднем в Земле
- 6. Получение кислорода Получение в лаборатории. Впервые кислород был получен Дж. Пристли в 1774 году. Он прокаливал
- 7. Получение кислорода Получение в лаборатории. Технический оксид ртути (II) содержит примеси, массовая доля которых составляет 10%.
- 8. Получение кислорода Получение в лаборатории. Когда Пристли получил газ, то заметил, что предметы в нем горят
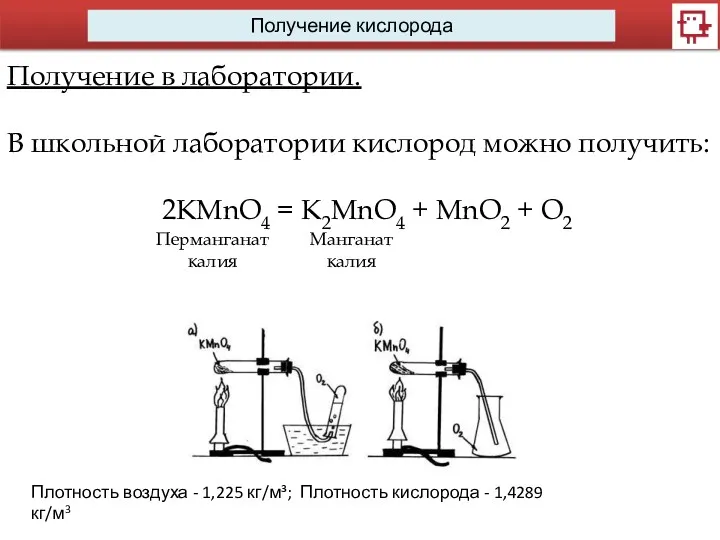
- 9. Получение кислорода Получение в лаборатории. В школьной лаборатории кислород можно получить: 2KMnO4 = K2MnO4 + MnO2
- 10. Получение кислорода Бывают вещества, которые ускоряют химические реакции. Например, добавления оксида марганца, увеличит скорость разложения пероксида:
- 11. Катализаторы и ингибиторы Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называются катализаторы.
- 12. Катализаторы и ингибиторы Ещё один способ получения кислорода в лаборатории, проходит в присутствии катализатора. Разложение бертоллетовой
- 13. Получение в промышленности В промышленности кислород получают из …
- 15. Скачать презентацию








 Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Камни и Козерог
Камни и Козерог Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution
Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution Классификация химических реакций
Классификация химических реакций Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Классы неорганических соединений
Классы неорганических соединений Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Альдегиды и кетоны
Альдегиды и кетоны Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Дисперсные системы
Дисперсные системы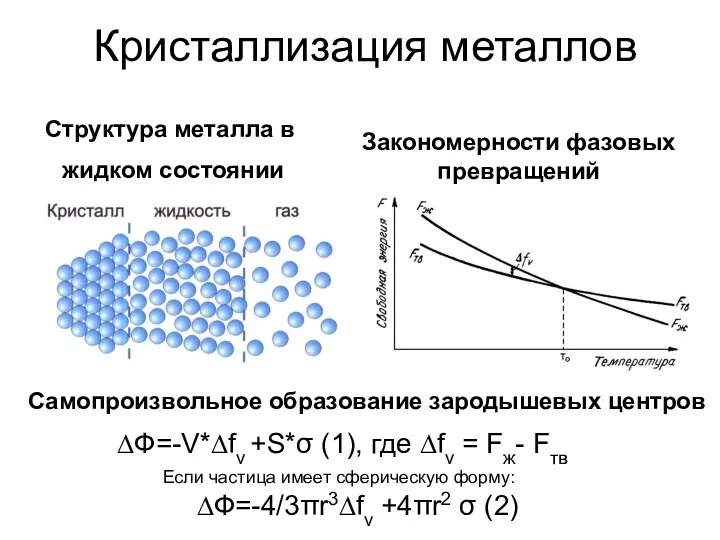 Закономерности фазовых превращений
Закономерности фазовых превращений Органическая химия
Органическая химия Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Основания
Основания Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Хімічні та фізичні явища
Хімічні та фізичні явища Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Методы прямого секвенирования белков (пептидов)
Методы прямого секвенирования белков (пептидов) Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Материаловедение. Химия функциональных материалов
Материаловедение. Химия функциональных материалов Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Электроповерхностные явления. Строение двойного электрического слоя
Электроповерхностные явления. Строение двойного электрического слоя Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства