Слайд 2

История.
В 1808 г. английский химик Гемфри Дэви с помощью электролиза увлажнённой
смеси магнезии и оксида ртути получил амальгаму неизвестного металла, которому дал название «магнезиум», сохранившееся до сих пор во многих странах. В России с 1831 года принято название «магний». В 1829 г. французский химик А. Бюсси получил магний, восстанавливая его расплавленный хлорид металлическим калием. В 1830 г. М. Фарадей получил магний электролизом расплавленного хлорида магния.
Слайд 3

Получение.
Взаимодействие растворимых солей магния с щелочами.
Взаимодействие металлического магния с парами воды.
Взаимодействие
раствора хлорида магния с обожжённым доломитом.
Слайд 4

Химические свойства.
Как и все слабые основания, гидроксид магния термически неустойчив. Разлагается
при нагревании до 350 °C.
Взаимодействует с кислотами с образованием соли и воды (реакция нейтрализации).
Взаимодействие с кислотными оксидами с образованием соли и воды.
Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов
Слайд 5
![Физические свойства. •Состояние твёрдое •Молярная масса - 58.35 г/моль •Плотность - 2,3446 (20 °C)[1]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/192281/slide-4.jpg)
Физические свойства.
•Состояние твёрдое
•Молярная масса - 58.35 г/моль
•Плотность - 2,3446 (20 °C)[1]
Слайд 6




![Физические свойства. •Состояние твёрдое •Молярная масса - 58.35 г/моль •Плотность - 2,3446 (20 °C)[1]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/192281/slide-4.jpg)

 Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування Катионы IV аналитической группы
Катионы IV аналитической группы Строение атома и периодический закон. (Тема 2)
Строение атома и периодический закон. (Тема 2) Қазақстанда химияны оқыту әдістемесінің даму тарихы
Қазақстанда химияны оқыту әдістемесінің даму тарихы Химическая промышленность
Химическая промышленность Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Кислород/водород. Повторение
Кислород/водород. Повторение Лаборатория красивых волос
Лаборатория красивых волос Аммиак (9 класс)
Аммиак (9 класс) ферментер
ферментер Гидролиз солей
Гидролиз солей Химические свойства и получение алканов
Химические свойства и получение алканов Механическая смесь и растворы
Механическая смесь и растворы Химическая связь и ее типы. Кристаллические решётки
Химическая связь и ее типы. Кристаллические решётки Массовая доля элемента в веществе
Массовая доля элемента в веществе Цинк и его применение
Цинк и его применение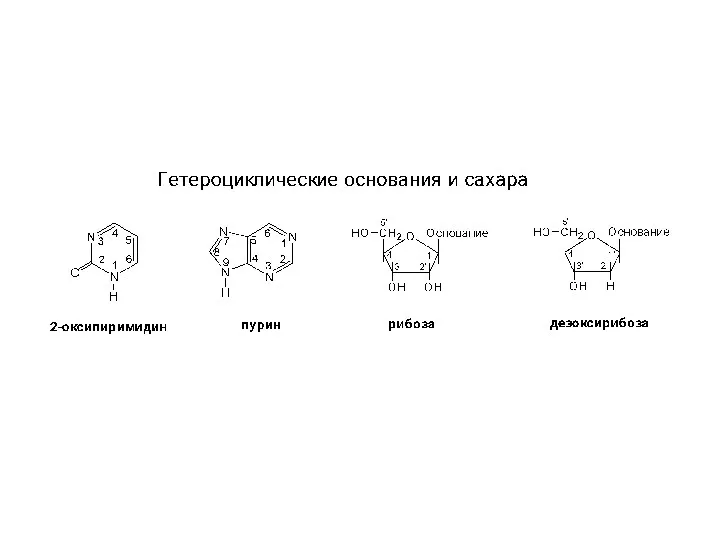 Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Химические уравнения
Химические уравнения p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Химическая связь в кластерах
Химическая связь в кластерах Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Ionic polymerization
Ionic polymerization