Содержание
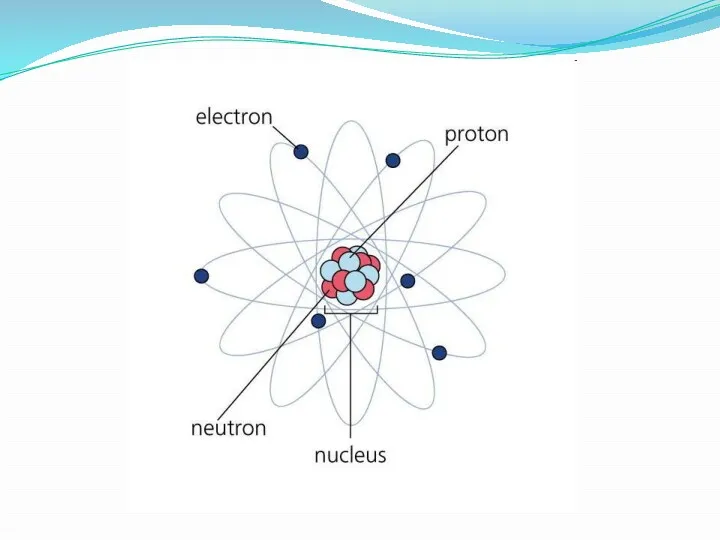
- 2. Вспомним, что такое атом? Атом (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического
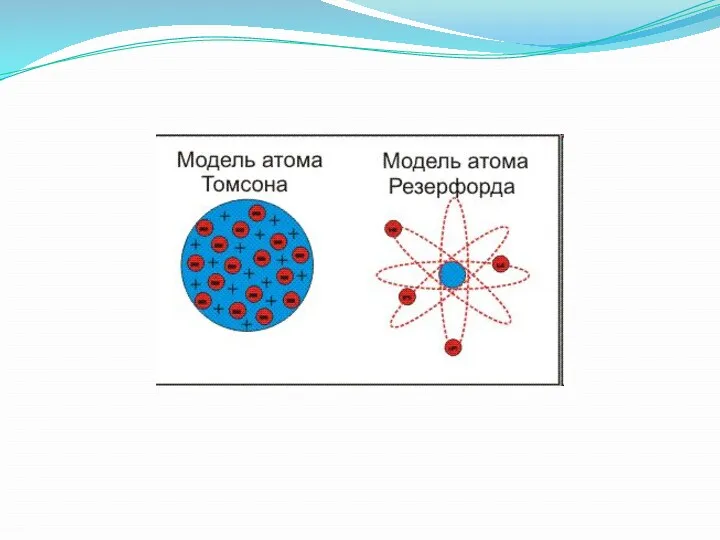
- 4. Модели атомов Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как
- 5. Планетарная модель атома Бора-Резерфорда. Описание атома вошло в противоречие с классической электродинамикой. Дело в том, что,
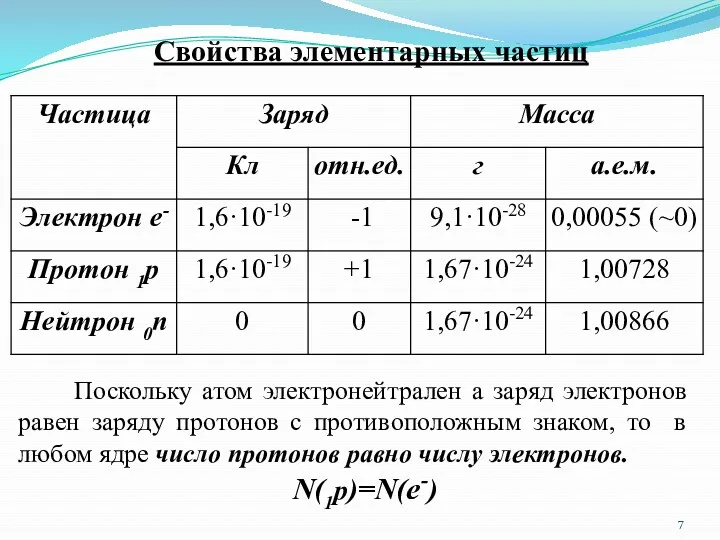
- 7. Свойства элементарных частиц Поскольку атом электронейтрален а заряд электронов равен заряду протонов с противоположным знаком, то
- 8. А – массовое число. Z – заряд ядра (порядковый номер элемента). N(1p) – число протонов. N(0n)
- 9. Изотопы – атомы одного и того же химического элемента, отличающиеся числом нейтронов, а, следовательно, и массой.
- 10. Постулаты Бора Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает
- 12. Квантовые числа Квантовые числа – распределение электронов в атоме. Это своеобразный паспорт каждого электрона в атоме.
- 13. 1. Главное квантовое число n – показывает общий запас энергии электрона, а значит его удаленность от
- 14. 2. побочное (орбитальное) квантовое число l – отражает разное энергетическое состояние электрона в пределах уровня и
- 15. 3. магнитное квантовое число m m – характеризует ориентацию орбиталей в пространстве; принимает значения –l…0…+l. Например,
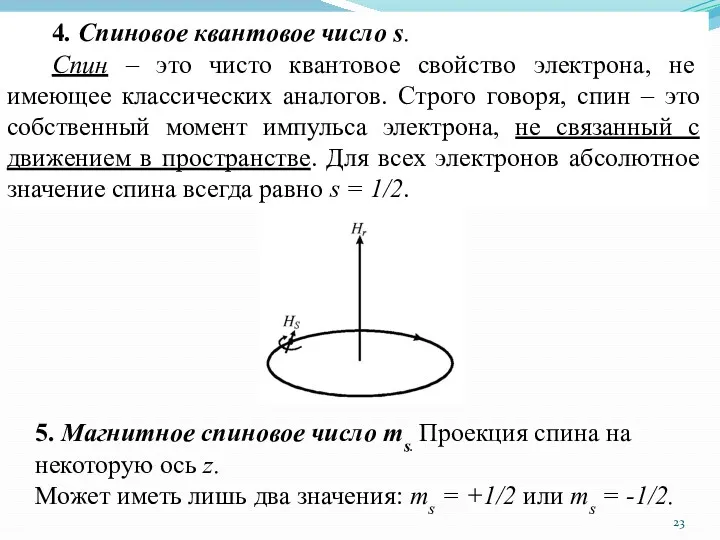
- 16. 4. спиновое квантовое число s – собственный момент импульса электрона, не связанный с движением в пространстве.
- 17. 5. магнитное спиновое число ms – проекция спина на ось Oz. Всегда равно
- 18. 1. Главное квантовое число п определяет общую энергию электрона на данной орбитали, а, значит, его удаленность
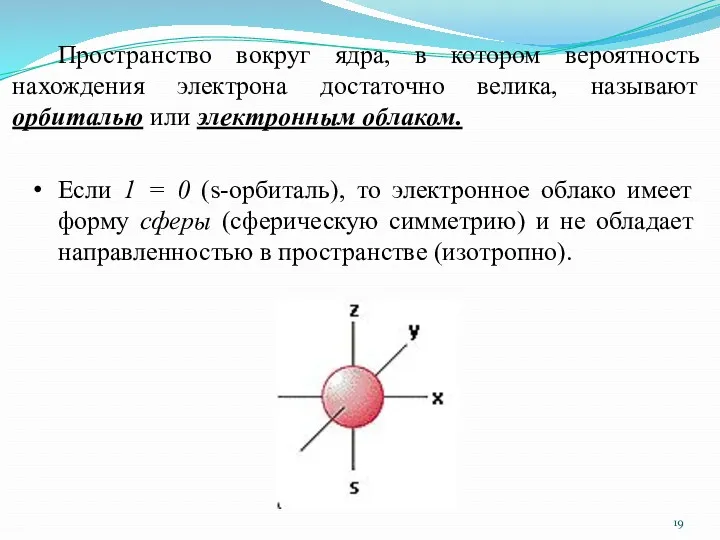
- 19. Eсли 1 = 0 (s-орбиталь), то электронное облако имеет форму сферы (сферическую симметрию) и не обладает
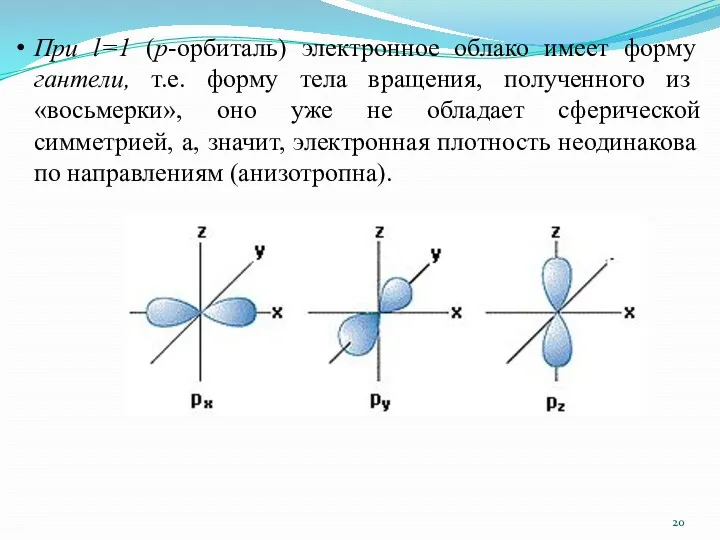
- 20. При l=1 (р-орбиталь) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из «восьмерки», оно
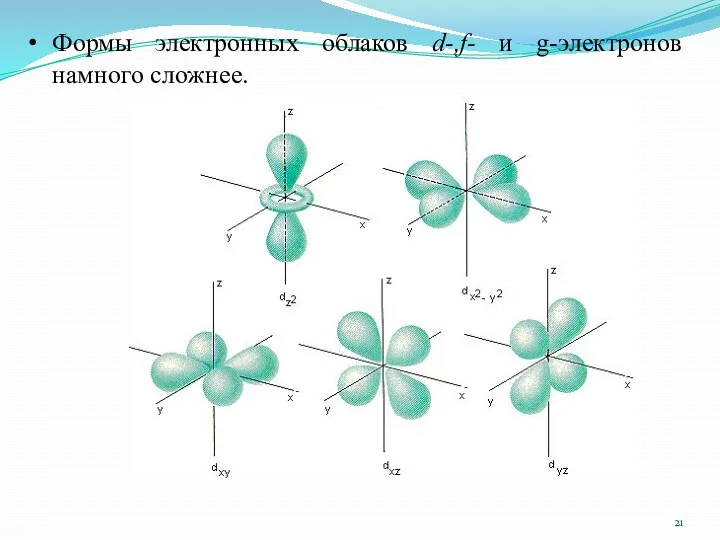
- 21. Формы электронных облаков d-,f- и g-электронов намного сложнее.
- 22. 3. Магнитное орбитальное квантовое число ml. Определяет ориентацию электронного облака в пространстве. Общее число возможных значений
- 23. 4. Спиновое квантовое число s. Cпин – это чисто квантовое свойство электрона, не имеющее классических аналогов.
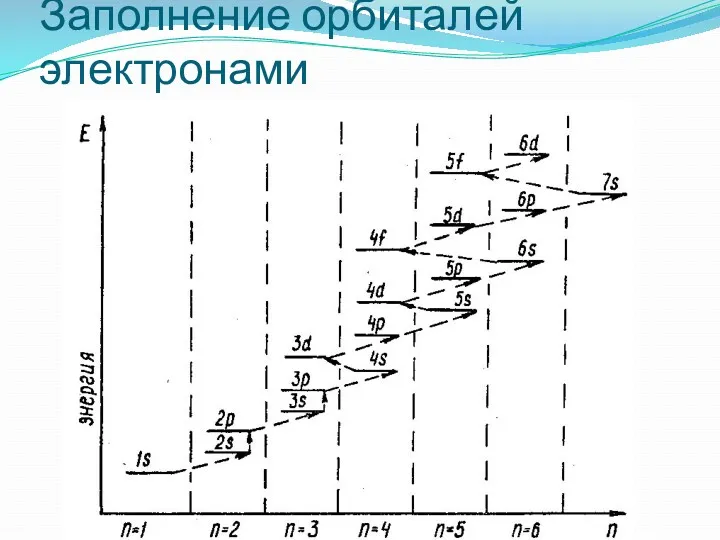
- 24. Электронные конфигурации атомов Распределение электронов по уровням и подуровням подчиняется определенным закономерностям. 2. Правило Клечковского. Энергия
- 25. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае
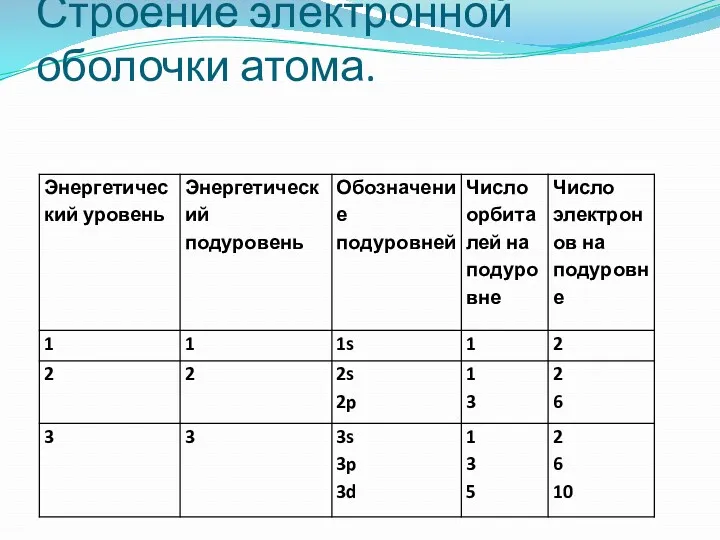
- 26. Строение электронной оболочки атома. Энергетический уровень Число энергетических уровней в атоме равно номеру периода, в котором
- 27. Строение электронной оболочки атома. Энергетический подуровень Число подуровней на каждом энергетическом уровне равно номеру уровня!!!
- 28. Строение электронной оболочки атома. Число орбиталей на подуровнях:
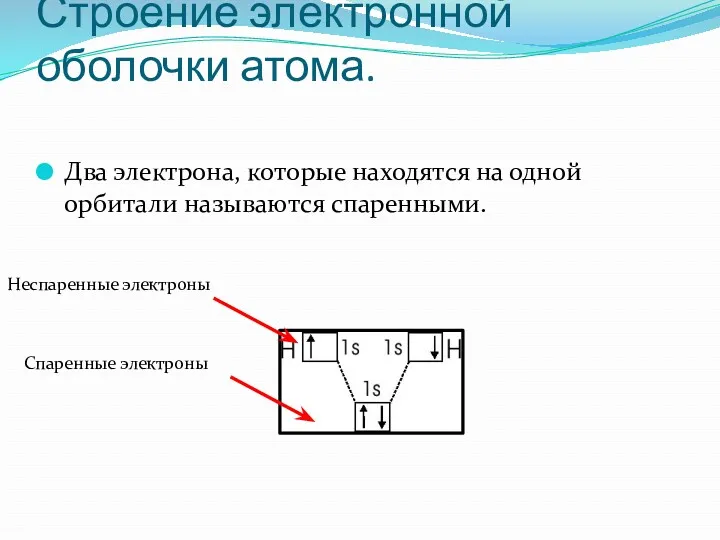
- 29. Строение электронной оболочки атома. Два электрона, которые находятся на одной орбитали называются спаренными. Спаренные электроны Неспаренные
- 30. Строение электронной оболочки атома.
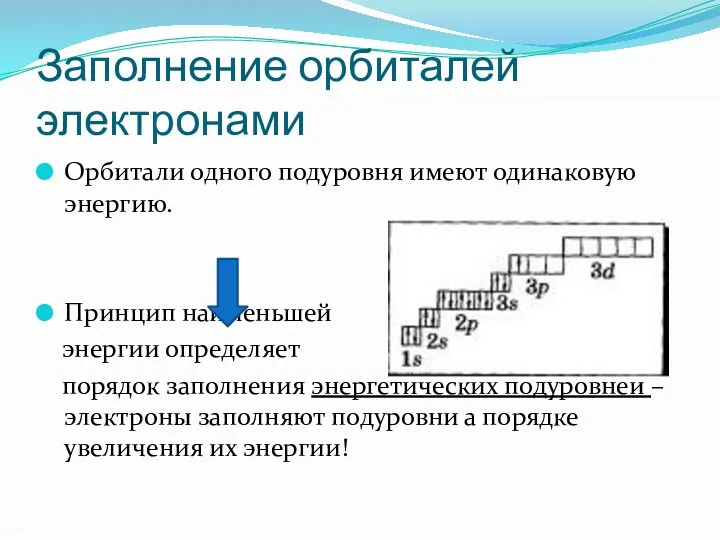
- 31. Заполнение орбиталей электронами Порядок заполнения электронами атомных орбиталей определяет принцип наименьшей энергии.
- 32. Заполнение орбиталей электронами Орбитали одного подуровня имеют одинаковую энергию. Принцип наименьшей энергии определяет порядок заполнения энергетических
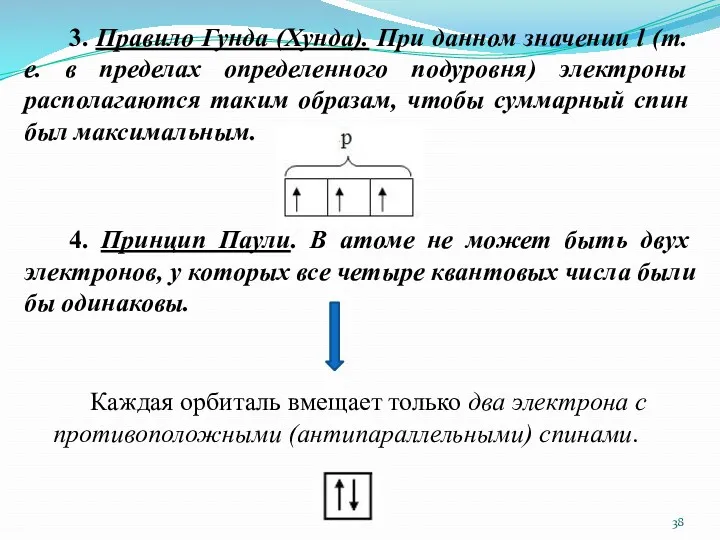
- 33. Заполнение орбиталей электронами Правило Гунда
- 34. Электронные конфигурации атомов. Чтобы правильно изображать электронные конфигурации атомов, нужно знать: Число электронов в атоме (равно
- 35. В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение
- 36. Заполнение орбиталей электронами
- 37. s-элементы – последним заполняется s-подуровень p-элементы – последним заполняется p-подуровень d-элементы – последним заполняется d-подуровень f-элементы
- 38. 3. Правило Гунда (Хунда). При данном значении l (т. е. в пределах определенного подуровня) электроны располагаются
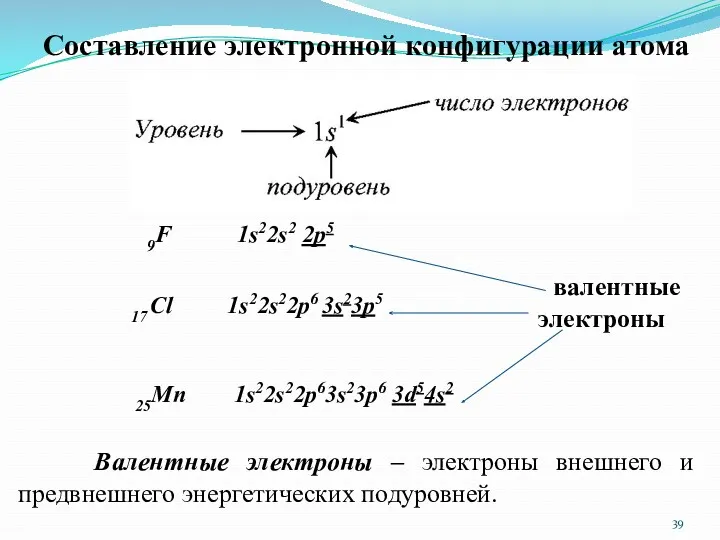
- 39. 25Mn 1s22s22p63s23p6 3d54s2 Составление электронной конфигурации атома 9F 1s22s2 2p5 17 Cl 1s22s22p6 3s23p5 валентные электроны
- 40. «Проскок» электрона Внешние оболочки с конфигурациями d4 и d9 нестабильны и стремятся перейти в устойчивые заполненные
- 41. Периодический закон Д.И. Менделеева 1869 г, Д.И. Менделеев Свойства химических элементов, а также формы и свойства
- 42. Периодическая система химических элементов (ПСХЭ)
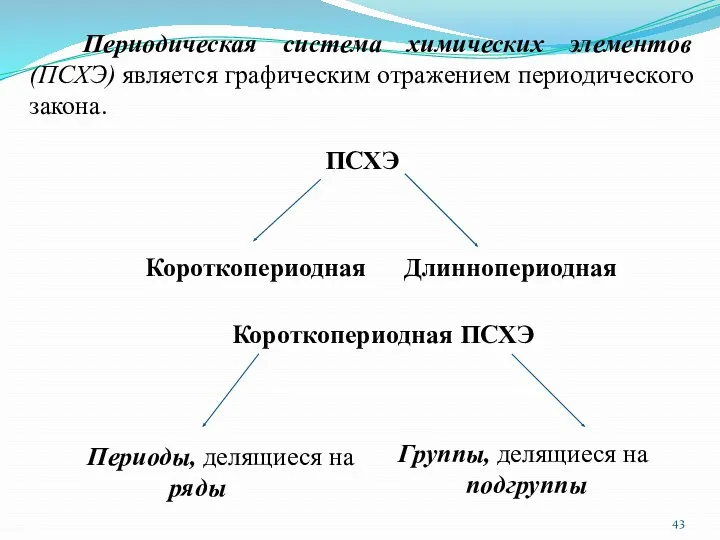
- 43. Периодическая система химических элементов (ПСХЭ) является графическим отражением периодического закона. ПСХЭ Короткопериодная Длиннопериодная Короткопериодная ПСХЭ Периоды,
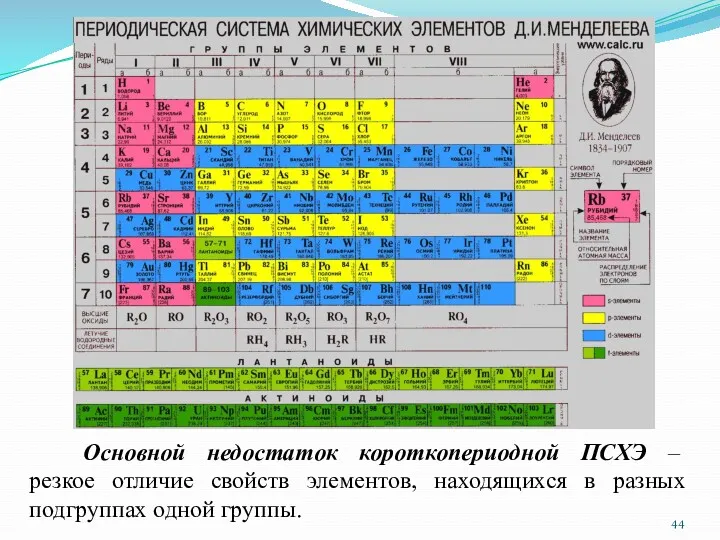
- 44. Основной недостаток короткопериодной ПСХЭ – резкое отличие свойств элементов, находящихся в разных подгруппах одной группы.
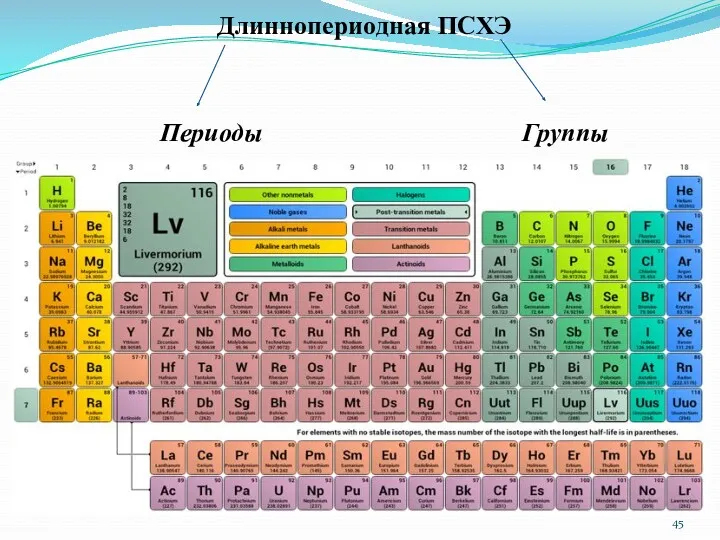
- 45. Длиннопериодная ПСХЭ Периоды Группы
- 46. Периоды делятся на малые и большие. Периоды Физический смысл номера периода: номер периода указывает на число
- 47. Группы Группа – вертикальный ряд элементов в ПСХЭ. Группа состоит из двух подгрупп – главной (обозначается
- 48. Свойства атомов Металличность – способность атомов отдавать электроны. Потенциал ионизации (I) – энергия, необходимая для отрыва
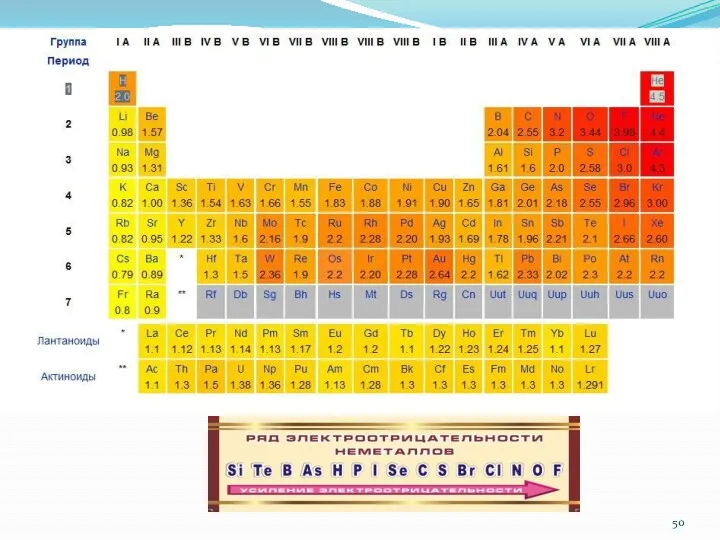
- 49. Электроотрицательность (ЭО) – способность атомов перетягивать на себя электронную плотность (валентные электроны и электронные пары). Упрощение
- 51. Валентность Понятие валентность можно определить как свойство атомов и как величину. Как свойство атома валентность –
- 52. Правила определения валентности элементов I. Элементы с постоянной валентностью. 1. Элементы I, II, III групп длиннопериодной
- 53. 1. Для короткопериодной системы: максимальная валентность элемента совпадает с номером его группы. wmax = № группы
- 54. Степень окисления Степень окисления – условный заряд атома в молекуле, вычисленный в предположении, что все связи
- 55. Правила определения степени окисления элементов 1. Сумма, степеней окисления атомов в любой частице равна ее электрическому
- 56. 7. В соединениях фтор всегда проявляет степень окисления минус 1. СТ.ОК(F) = -1 6. Степень окисления
- 57. Минимальную степень окисления проявляют элементы, записывающиеся справа в бинарных соединениях. 10. Минимальная степень окисления (максимальная отрицательная
- 58. Периодическое изменение свойств атомов и их соединений по периодам и группам По группе сверху вниз: Радиус
- 59. По периоду слева направо: Окислительные свойства увеличиваются. Радиус атома уменьшается. Прочность связи электронов с ядром увеличивается.
- 60. Периодическая система химических элементов
- 61. Периодическая система химических элементов
- 62. Средняя молярная масса смеси Для газов мольная доля равна объемной доли
- 64. Скачать презентацию











































 Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Кислород и озон
Кислород и озон Алкандар. Метан және оның құрылысы
Алкандар. Метан және оның құрылысы Соли аммония
Соли аммония Химические свойства алканов
Химические свойства алканов Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Углерод. Оксиды углерода
Углерод. Оксиды углерода Применение соляной кислоты и её солей
Применение соляной кислоты и её солей Антибиотики как ЛС
Антибиотики как ЛС Соли. CaSO4 - Сульфат кальция
Соли. CaSO4 - Сульфат кальция Class micro and macro elements
Class micro and macro elements Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Простые вещества – неметаллы
Простые вещества – неметаллы Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Ювелирное дело. Империя самоцветов
Ювелирное дело. Империя самоцветов Ферменты в биотехнологии
Ферменты в биотехнологии Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Мило та миловаріння
Мило та миловаріння Почему мыло пенится
Почему мыло пенится Основные классы неорганических соединений
Основные классы неорганических соединений Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Химия элементов. Общая характеристика элементов
Химия элементов. Общая характеристика элементов Вклад М.В. Ломоносова в развитие химии
Вклад М.В. Ломоносова в развитие химии Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні