Содержание
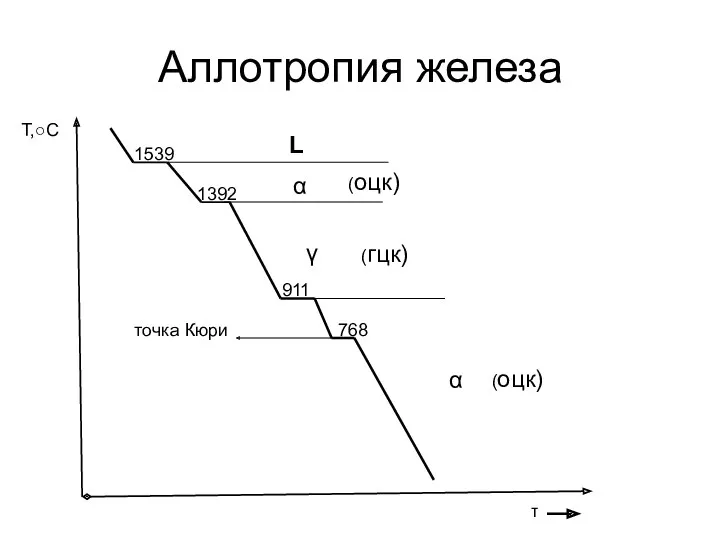
- 2. Аллотропия железа τ
- 3. Строение сплавов Сплав – вещество, получаемое сплавлением двух или более компонентов. Механическая смесь: компоненты, образующие сплав,
- 4. Строение сплавов Твердый раствор на основе одного из компонентов сплава: образуется в сплавах, сохраняющих однородность жидкого
- 5. Строение сплавов Химическое соединение: Соотношение чисел атомов элементов соответствует стехиометрической пропорции и может быть выражено простой
- 6. Правило фаз C = k – f + 1 C – число степеней свободы k –
- 7. Правило фаз (закон Гиббса) Правило фаз дает количественную зависимость между степенью свободы системы и количеством фаз
- 8. Диаграмма состояния Диаграмма состояния показывает изменение состояния в зависимости от температуры и концентрации (давление постоянно для
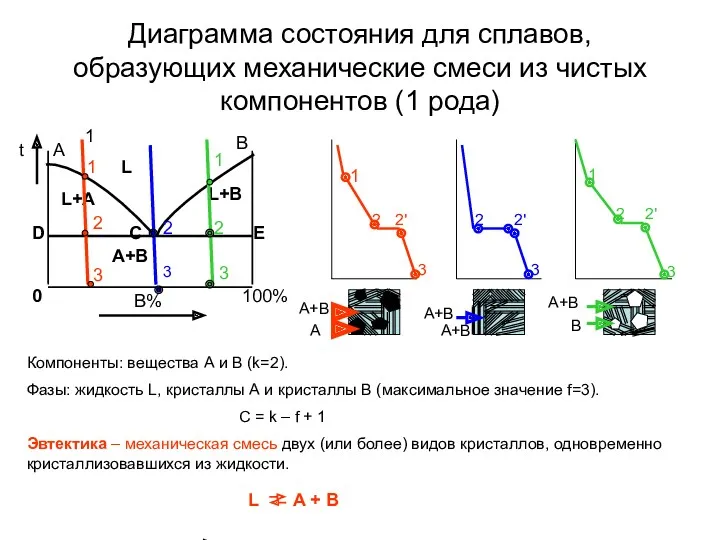
- 9. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (1 рода) 1 Компоненты: вещества А
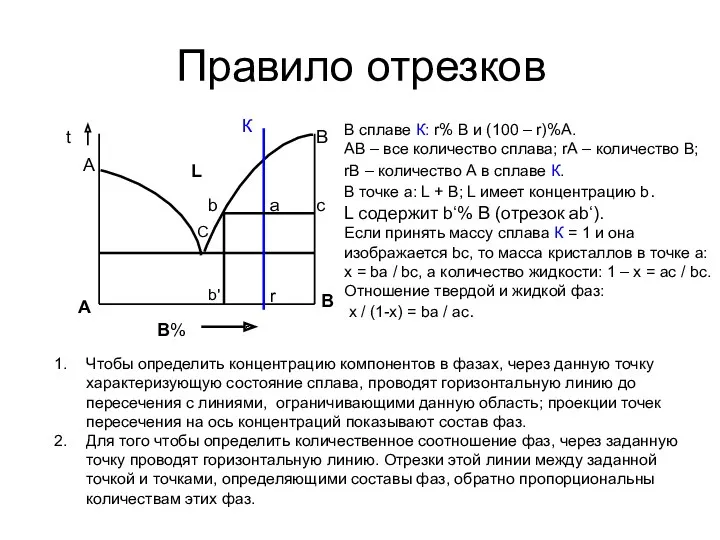
- 10. Правило отрезков В% А В А С В t К b a c r Чтобы определить
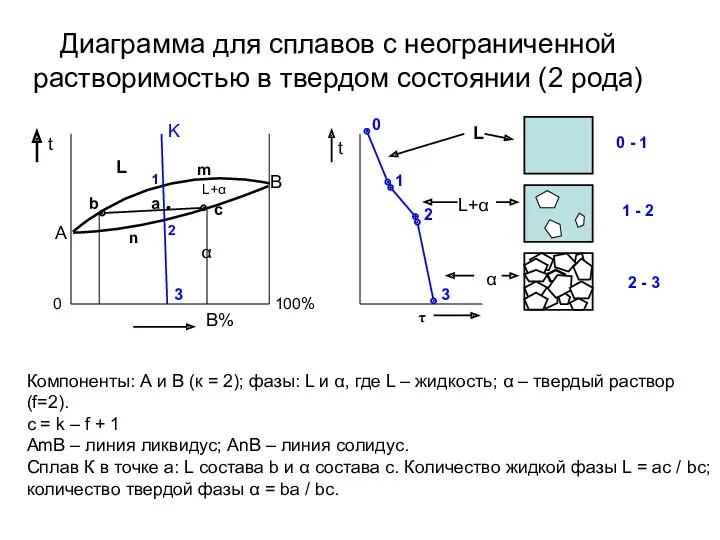
- 11. Диаграмма для сплавов с неограниченной растворимостью в твердом состоянии (2 рода) 100% Компоненты: А и В
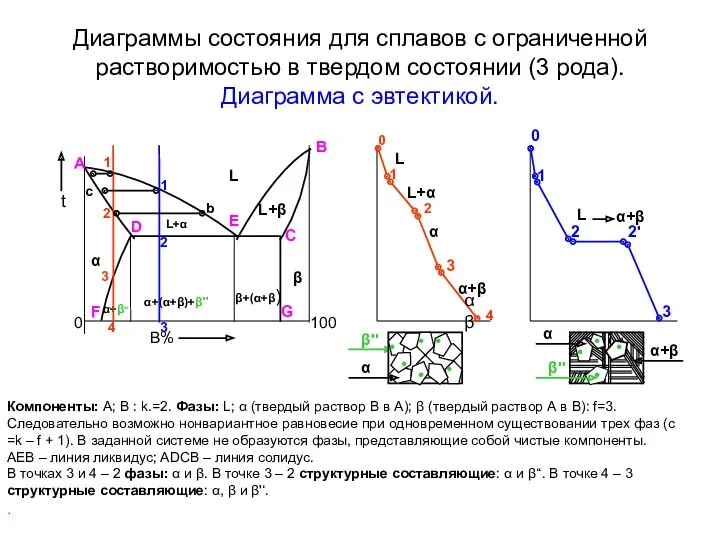
- 12. Диаграммы состояния для сплавов с ограниченной растворимостью в твердом состоянии (3 рода). Диаграмма с эвтектикой. B%
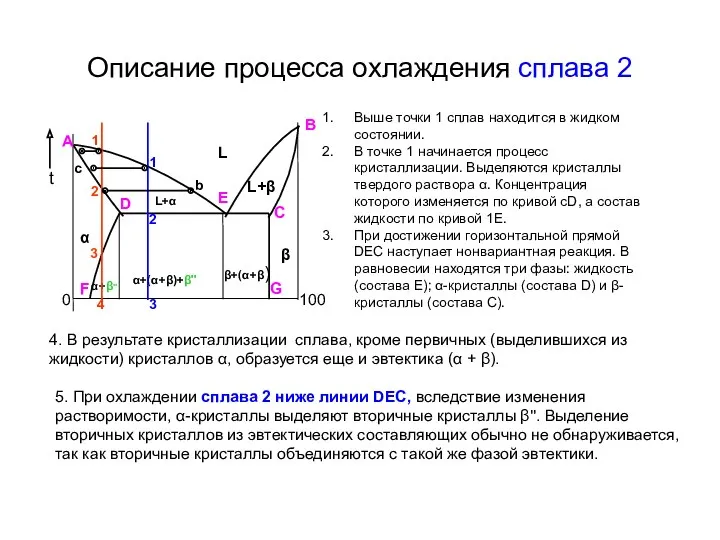
- 13. Описание процесса охлаждения сплава 2 Выше точки 1 сплав находится в жидком состоянии. В точке 1
- 14. Количественное определение фаз и структурных составляющих в сплавах Сплав 1 Количество фаз и структурных составляющих при
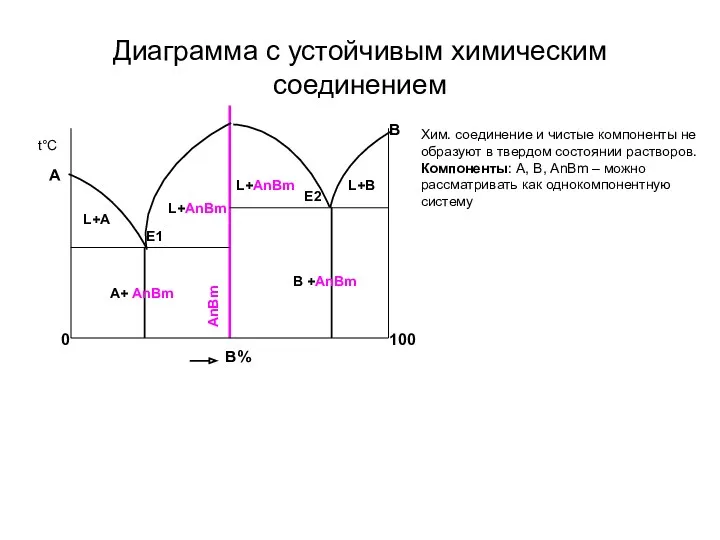
- 15. Диаграмма с устойчивым химическим соединением 100 Хим. соединение и чистые компоненты не образуют в твердом состоянии
- 16. Диаграмма железо – углерод. Железоуглеродистые сплавы – стали и чугуны. Стали содержат 2,14% углерода. Железо образует
- 17. Свойства и строение компонентов диаграммы железо - углерод Железо – Fe: Тпл =1539° С; в твердом
- 18. Обозначения, принятые для дальнейшего изложения. L – жидкость (жидкий раствор углерода в железе), существует выше линии
- 19. Нонвариантные реакции на диаграмме Т=1499°С (линия HJB): L(B)+Ф(H)→A(J) - перетектическая реакция, наблюдается только у сплавов с
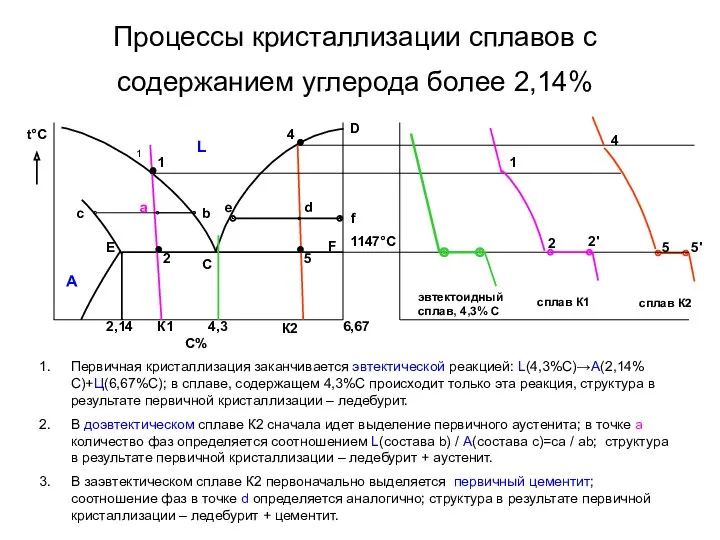
- 20. Процессы кристаллизации сплавов с содержанием углерода более 2,14% t°С 5' сплав К2 Первичная кристаллизация заканчивается эвтектической
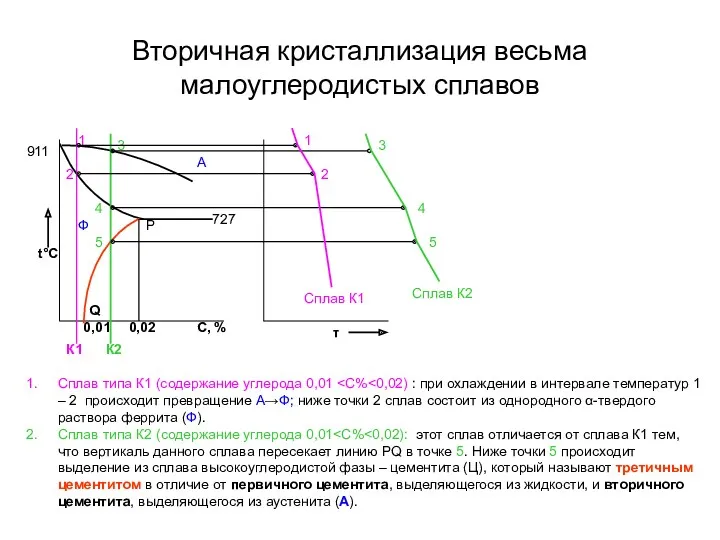
- 21. Вторичная кристаллизация весьма малоуглеродистых сплавов Сплав типа К1 (содержание углерода 0,01 Сплав типа К2 (содержание углерода
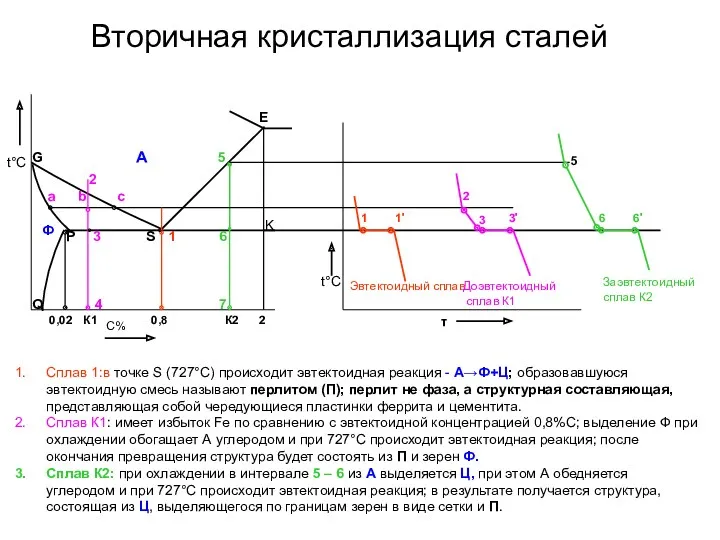
- 22. Вторичная кристаллизация сталей t°С Заэвтектоидный сплав К2 Сплав 1:в точке S (727°С) происходит эвтектоидная реакция -
- 24. Скачать презентацию











 Reactors for catalytic alkylation
Reactors for catalytic alkylation 20230419_osnovaniya
20230419_osnovaniya Процессы и аппараты химических производств
Процессы и аппараты химических производств Ртуть (Hydrargyrum, жидкое серебро)
Ртуть (Hydrargyrum, жидкое серебро) Драгоценные камни
Драгоценные камни Основные классы неорганических соединений
Основные классы неорганических соединений Кинетика и равновесие химических реакций
Кинетика и равновесие химических реакций Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод Почему мыло пенится
Почему мыло пенится Основания. Степени окисления элементов в соединениях
Основания. Степени окисления элементов в соединениях Кислородные соединения азота
Кислородные соединения азота Растворы. Приготовление растворов
Растворы. Приготовление растворов фосфор
фосфор Общие сведения о гетероциклах
Общие сведения о гетероциклах 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Темір және оның қосылыстары
Темір және оның қосылыстары Окисно-відновні реакції. Гальванічні елементи
Окисно-відновні реакції. Гальванічні елементи Электролиз. Сущность электролиза
Электролиз. Сущность электролиза Дисперсные системы
Дисперсные системы Разбираем задания
Разбираем задания Термодинамика. 2 закон термодинамики. Энтропия
Термодинамика. 2 закон термодинамики. Энтропия Высокомолекулярные соединения
Высокомолекулярные соединения Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Элементы кристаллохимии
Элементы кристаллохимии Химическая технология. Введение
Химическая технология. Введение Горечи. Лекция 3
Горечи. Лекция 3 Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Цинк и его соединения
Цинк и его соединения