Содержание
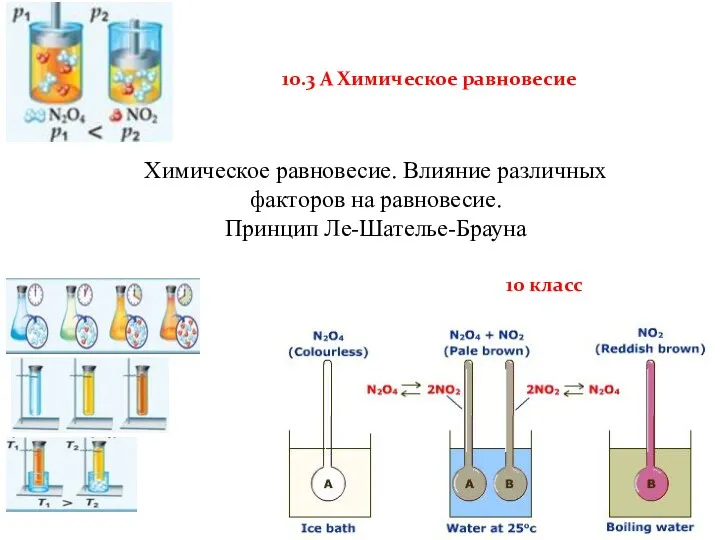
- 2. 10.3 А Химическое равновесие Химическое равновесие. Влияние различных факторов на равновесие. Принцип Ле-Шателье-Брауна 10 класс
- 3. ЦО: 10.3.3.1 объяснять динамический характер химического равновесия 10.3.3.2 прогнозировать влияние изменения температуры, концентрации и давления на
- 4. Критерии успеха -знает, что реакции могут быть обратимыми; -понимает, что некоторые условия могут изменять направление равновесия.
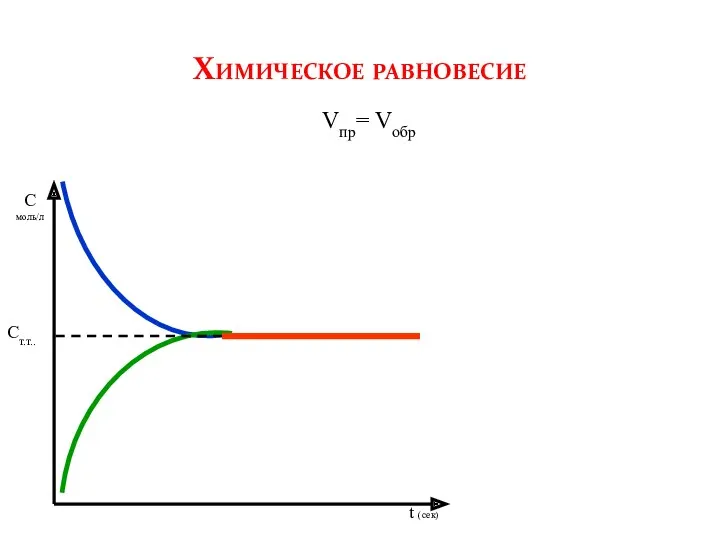
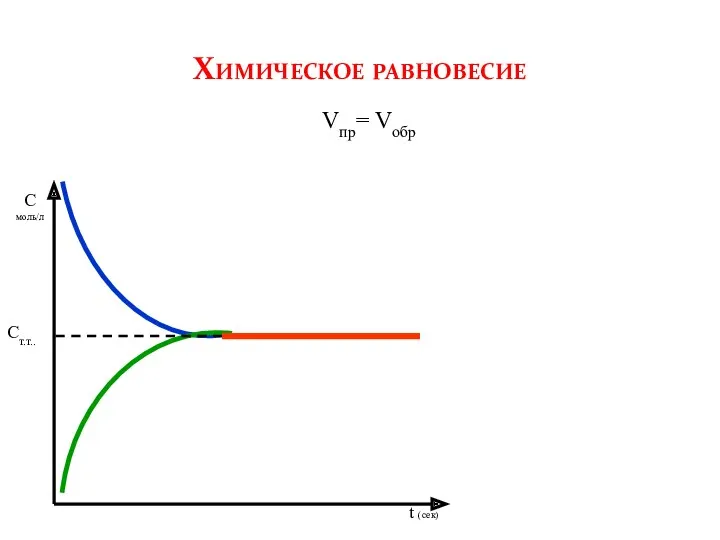
- 5. С моль/л t (сек) Химическое равновесие Vпр= Vобр Ст.т..
- 6. Необратимыми называются такие реакции, при протекании которых: 1) образующиеся продукты уходят из сферы реакции — выпадают
- 8. NaOH + HCl —>NaCl + H2O N2 + 3H2 —> 2NH3 AgNO3 + NaCl —>AgCl +
- 9. *Определите процессы по обратимости BaO + H2SO4 = HCl + Na2CO3 = SO2 + O2= C2H6
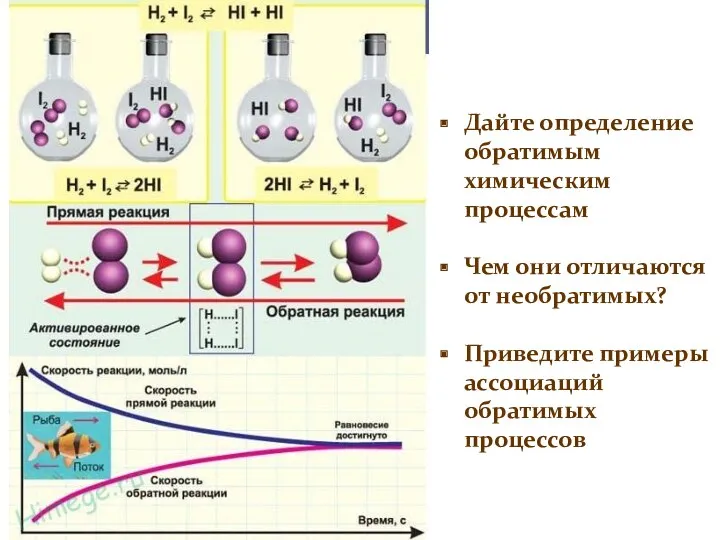
- 10. Дайте определение обратимым химическим процессам Чем они отличаются от необратимых? Приведите примеры ассоциаций обратимых процессов
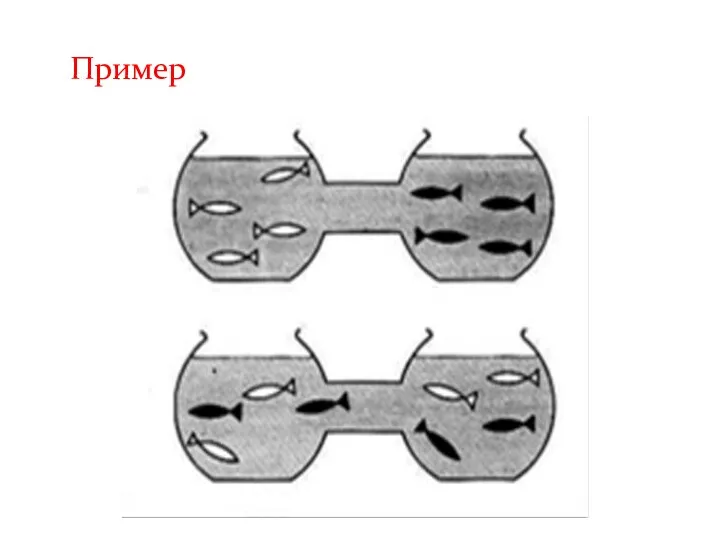
- 11. Пример
- 14. ЦО: понимать химическое равновесие как динамический процесс
- 16. концентрацию выражают [ ] Например, [N2]
- 17. Факторы влияющие на смещение химического равновесия
- 18. Состояние системы при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием
- 19. С моль/л t (сек) Химическое равновесие Vпр= Vобр Ст.т..
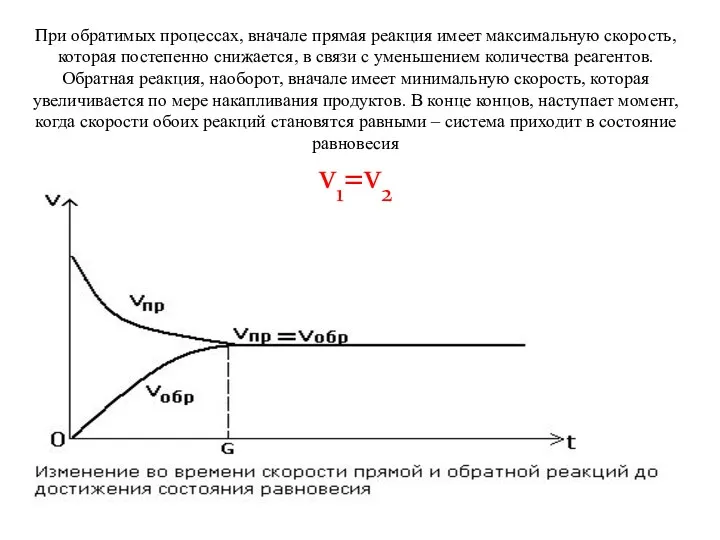
- 20. При обратимых процессах, вначале прямая реакция имеет максимальную скорость, которая постепенно снижается, в связи с уменьшением
- 21. При наступлении состояния равновесия, концентрации компонентов остаются неизменными, но химическая реакция при этом не прекращается. Т.о.
- 22. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём
- 23. Еще в 1884 году французский химик Анри Луи Ле Шателье сформулировал общий принцип для смещения любого
- 24. N2 + 3H2 ↔ 2NH3 aA + bB = cC + dD a, b, c, d
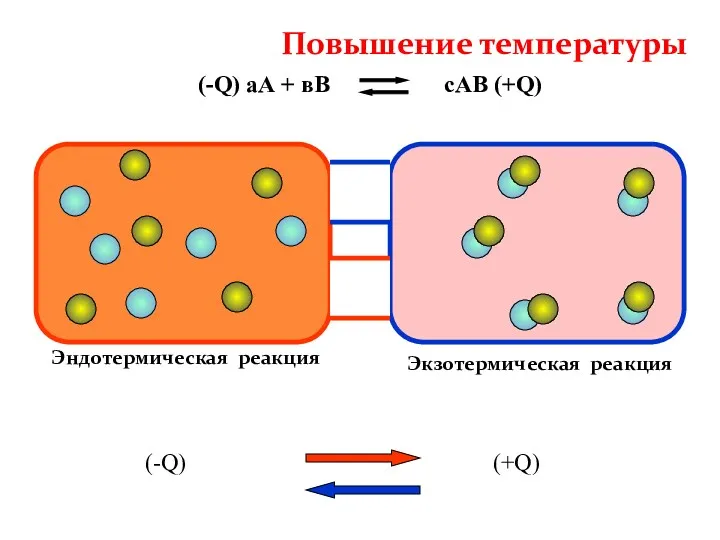
- 25. (-Q) аА + вВ сАВ (+Q) Экзотермическая реакция Эндотермическая реакция (-Q) (+Q) Повышение температуры
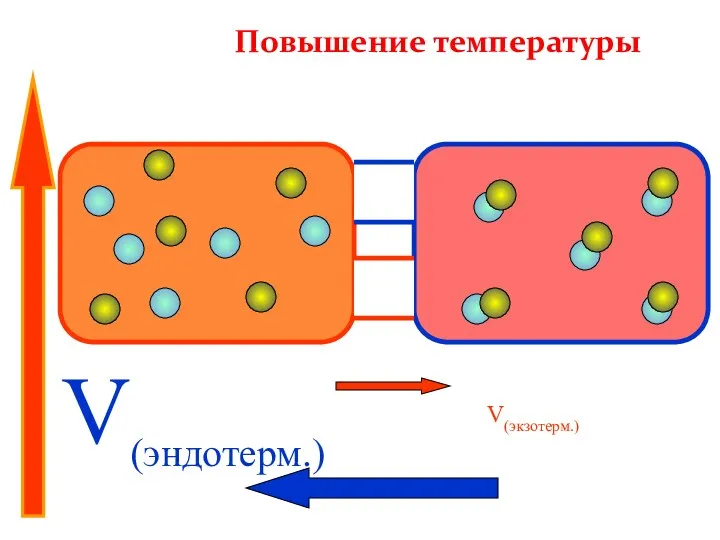
- 26. V(эндотерм.) V(экзотерм.) Повышение температуры
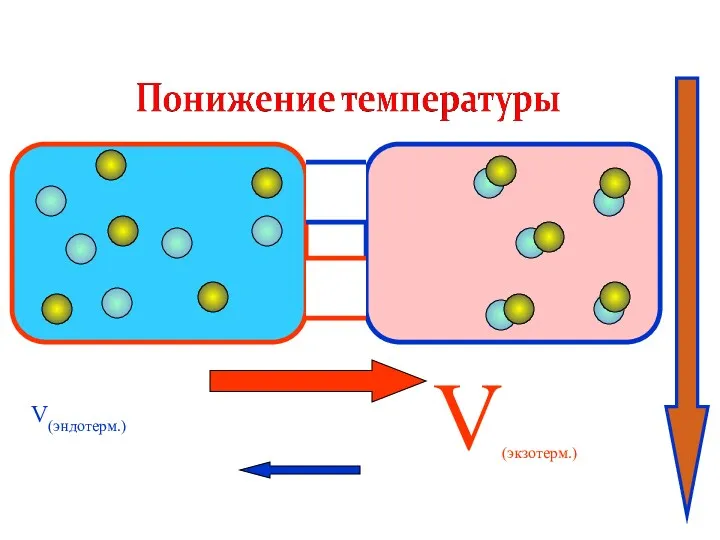
- 27. V(экзотерм.) V(эндотерм.)
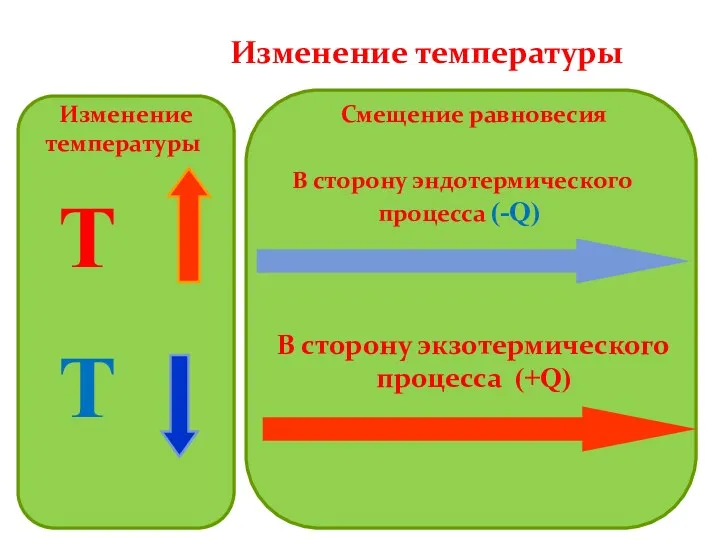
- 28. Изменение температуры Смещение равновесия Т Т В сторону эндотермического процесса (-Q) В сторону экзотермического процесса (+Q)
- 29. Соответственно, с помощью температурного воздействия мы можем оказывать влияние на смещение химического равновесия в системе: в
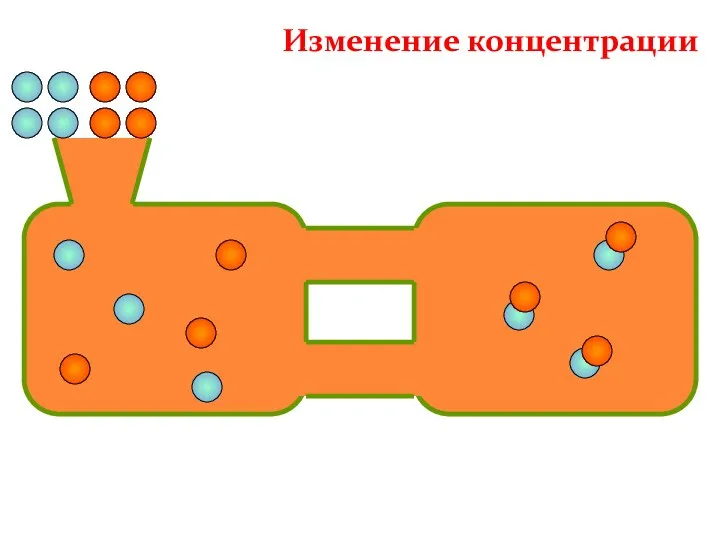
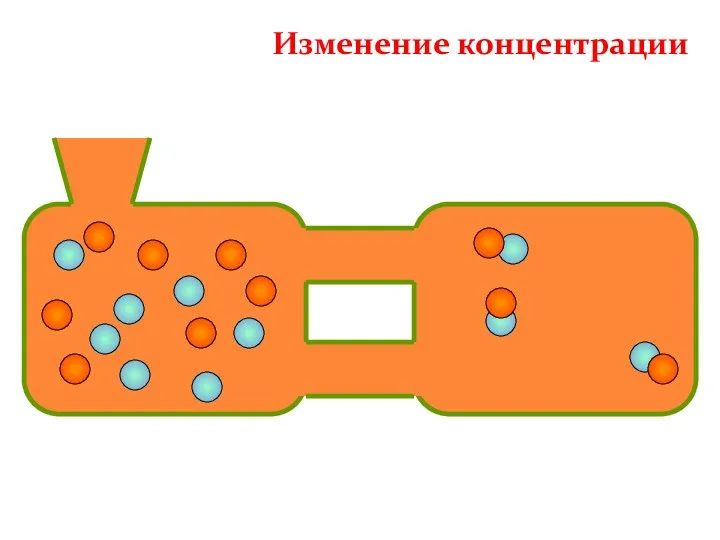
- 30. Изменение концентрации
- 31. Изменение концентрации
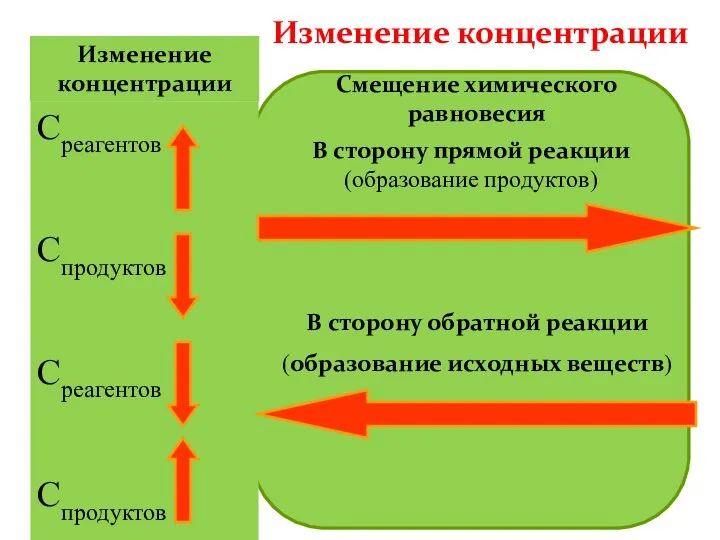
- 32. Изменение концентрации Смещение химического равновесия Среагентов Спродуктов Среагентов Спродуктов В сторону прямой реакции (образование продуктов) В
- 33. Концентрация Увеличение концентрации реагентов смещает химическое равновесие в сторону продуктов реакции как в газовой, так и
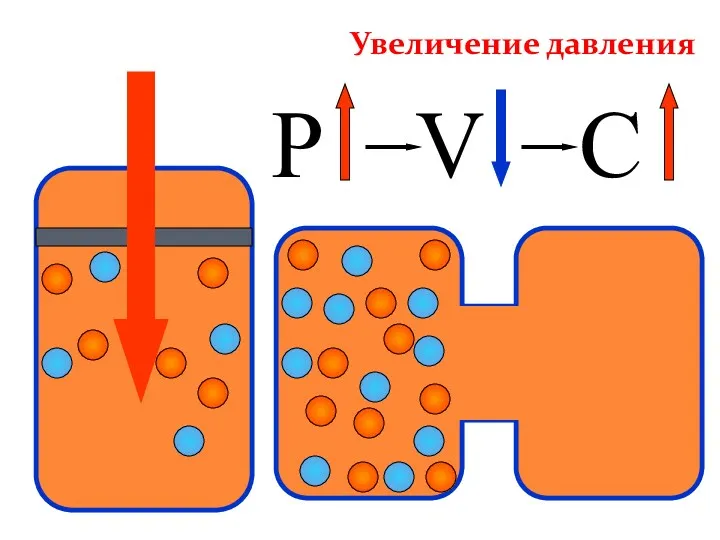
- 34. P V C Увеличение давления
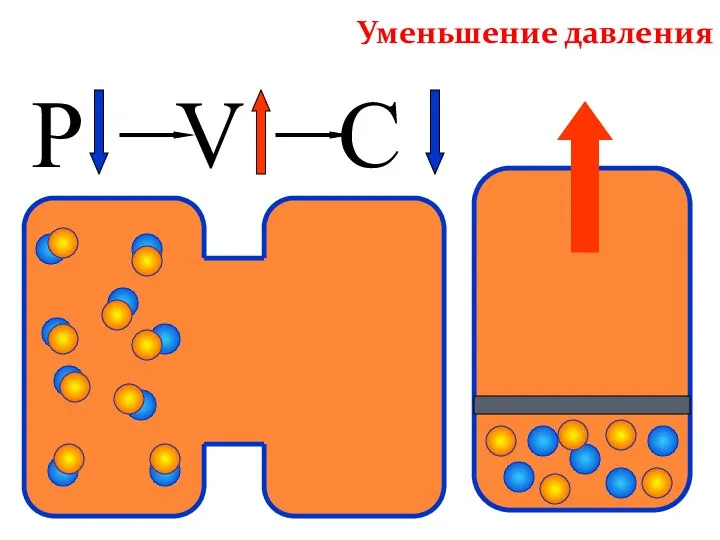
- 35. P V C Уменьшение давления
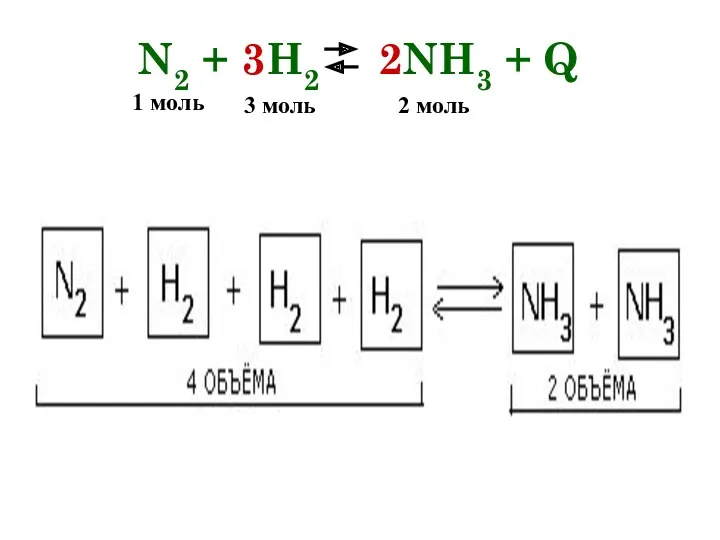
- 36. N2 + 3H2 2NH3 + Q
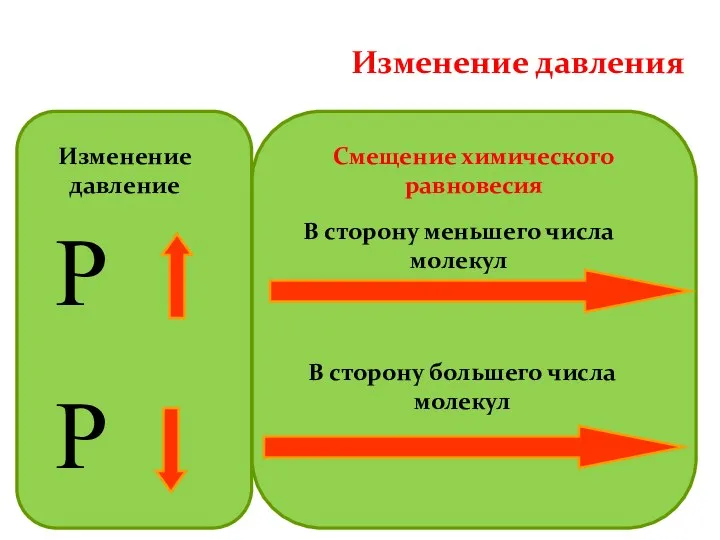
- 37. Смещение химического равновесия Р Р В сторону меньшего числа молекул В сторону большего числа молекул Изменение
- 38. Давление При увеличении давления равновесие смещается в сторону меньшего объема (в данном примере 4 моль →
- 39. - понимает, что некоторые условия могут изменять направление равновесия -правильно определяет смещение химического равновесия при влиянии
- 40. Pyramid Рефлексия
- 42. Скачать презентацию








![концентрацию выражают [ ] Например, [N2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/604741/slide-15.jpg)










 Алкадиены
Алкадиены Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Неорганические полимеры
Неорганические полимеры Камни и Телец
Камни и Телец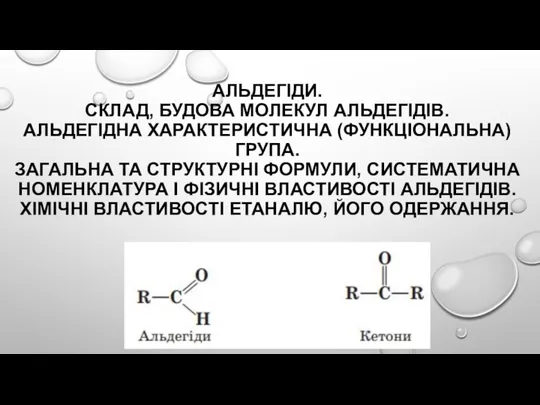 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Металдар коррозиясы және онымен күресу шаралары
Металдар коррозиясы және онымен күресу шаралары Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Скорость химической реакции
Скорость химической реакции Азотные удобрения
Азотные удобрения Кислоты. Состав кислот
Кислоты. Состав кислот Значення хімічних процесів у природі
Значення хімічних процесів у природі Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Железо и его соединения
Железо и его соединения Гигиена труда при работе с пестицидами и минеральными удобрениями
Гигиена труда при работе с пестицидами и минеральными удобрениями Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Історія хімії
Історія хімії Магний. Нахождение в природе
Магний. Нахождение в природе Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости
Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота
Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота Минерал чароит. Месторождения
Минерал чароит. Месторождения Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Элементы химической термодинамики
Элементы химической термодинамики Свойства растворов и гетерогенных систем
Свойства растворов и гетерогенных систем Алюминий AL- химический элемент
Алюминий AL- химический элемент