Содержание
- 2. Химическая термодинамика — раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики. Термодинамика - раздел физики,
- 3. Совокупность тел, выделенная из пространства, называется системой. Если между системой и окружающей внешней средой отсутствует массо-
- 4. Состояние любой системы характеризуется определенными термодинамическими параметрами: температура (Т), давление (Р), объем (V), химический состав. Изменение
- 5. Для термодинамического описания системы обычно пользуются функциями состояния, которые могут быть однозначно определены через параметры Р,
- 6. Химические реакции сопровождаются выделением или поглощением энергии как правило в форме теплоты. Реакции, в которых теплота
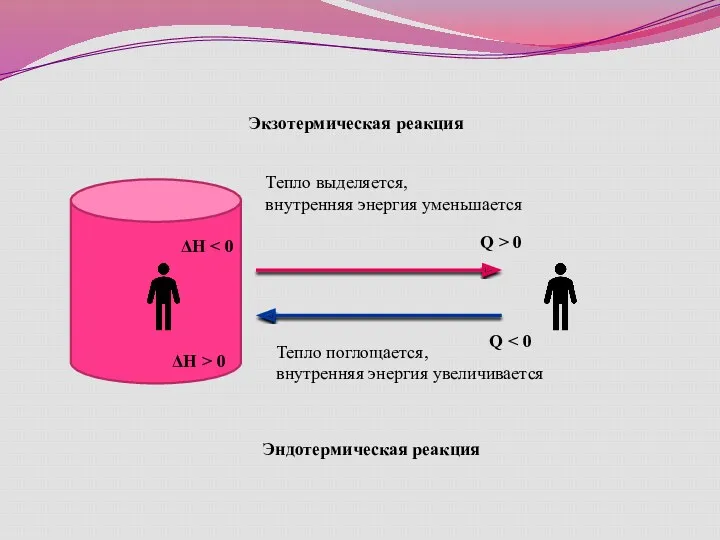
- 7. Тепло выделяется, внутренняя энергия уменьшается ΔH Q > 0 Тепло поглощается, внутренняя энергия увеличивается ΔH >
- 8. Уравнение химической реакции, включающее величину теплового эффекта (энтальпии), называется термохимическим уравнением: 2Н2(г) + О2(г) = 2Н2О(ж)
- 9. Закон Гесса: тепловой эффект химической реакции зависит только от состояния исходных и конечных продуктов и не
- 10. Следствие из закона Гесса: теплота реакции равна разности между суммами стандартных теплот образования конечных продуктов и
- 11. MgO(тв) + CO2(г) = MgCO3(тв) ΔH0реакции = ΔH0(MgCO3) – [ΔH0(MgO) + ΔH0(CO2)] = = +115,6 –
- 12. Энтропия (S) (от др.-греч. ἐντροπία «поворот», «превращение») — широко используемый в естественных и точных науках термин.
- 13. Для протекающих в природе процессов известны две движущие силы – стремление перейти в состояние с наименьшим
- 14. Отрицательное значение изменения энергии Гиббса (ΔG Температуру, при которой ΔG = 0, называют температурой начала реакции.
- 15. Пример. Теплота образования сульфида меди (II) равна 48,534 кДж. Сколько теплоты выделяется при образовании 144 г
- 16. Пример. Вычислить ΔH реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные: 4NH3(г) + 3O2(г) =
- 17. Пример. Используя справочные термодинамические данные вычислить ΔH реакции: 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж); ΔH
- 19. Скачать презентацию















 Изотопы, их свойства и применение
Изотопы, их свойства и применение Электронные представления в химии
Электронные представления в химии природ индик-2
природ индик-2 Сера. Нахождение в природе. Химические свойства серы
Сера. Нахождение в природе. Химические свойства серы Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6
Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6 Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Поделочные камни
Поделочные камни Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Повторение. Ионные уравнения реакции
Повторение. Ионные уравнения реакции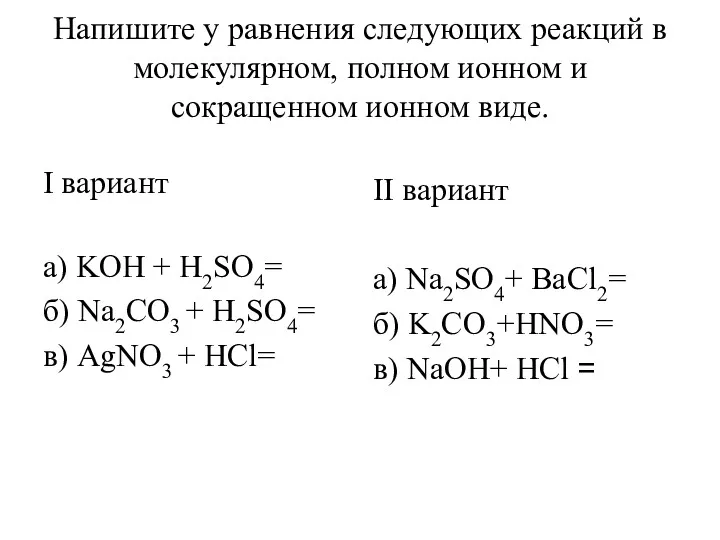 Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде
Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде Алкадиены
Алкадиены Железо. Нахождение в природе. Свойства железа
Железо. Нахождение в природе. Свойства железа Электролитическая диссоциация. Степень и константа диссоциации
Электролитическая диссоциация. Степень и константа диссоциации Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ) Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів
Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные вещества Виды химической связи
Виды химической связи Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Оценка химической обстановки при авариях на химически опасных объектах. Расчет
Оценка химической обстановки при авариях на химически опасных объектах. Расчет Хімічні явища у природі
Хімічні явища у природі Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії Алюминий. Строение
Алюминий. Строение Карбоновые кислоты
Карбоновые кислоты Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Равновесия в растворах электролитов
Равновесия в растворах электролитов Степень загрязнения почвы по химическому составу снежного покрова на разном удалении от источника загрязнения
Степень загрязнения почвы по химическому составу снежного покрова на разном удалении от источника загрязнения