Содержание
- 2. Валентность - это число химических связей, которое данный атом образует с другими атомами. Электроны, принимающие участие
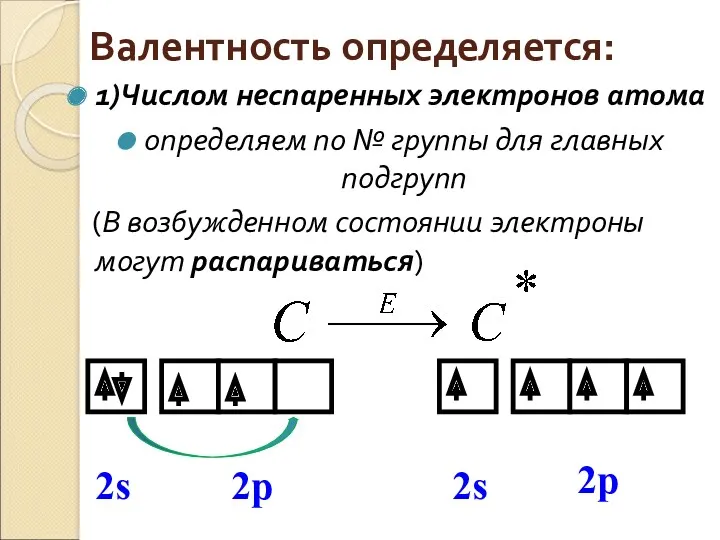
- 3. Валентность определяется: 1)Числом неспаренных электронов атома определяем по № группы для главных подгрупп (В возбужденном состоянии
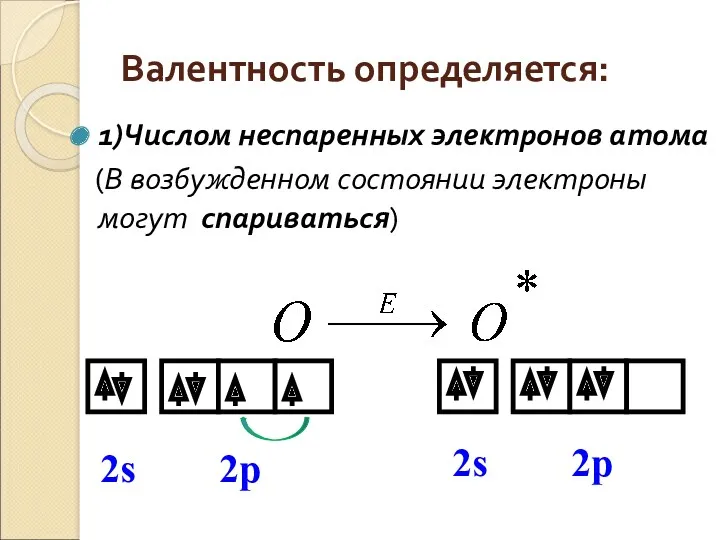
- 4. Валентность определяется: 1)Числом неспаренных электронов атома (В возбужденном состоянии электроны могут спариваться)
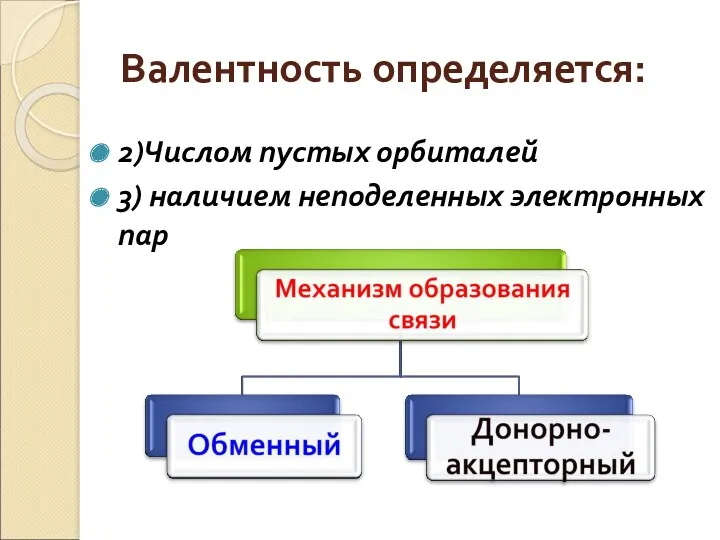
- 5. Валентность определяется: 2)Числом пустых орбиталей 3) наличием неподеленных электронных пар
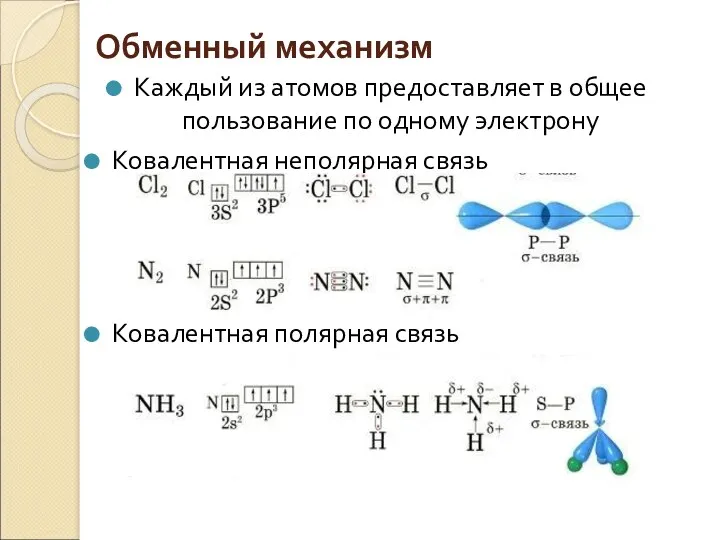
- 6. Обменный механизм Каждый из атомов предоставляет в общее пользование по одному электрону Ковалентная неполярная связь Ковалентная
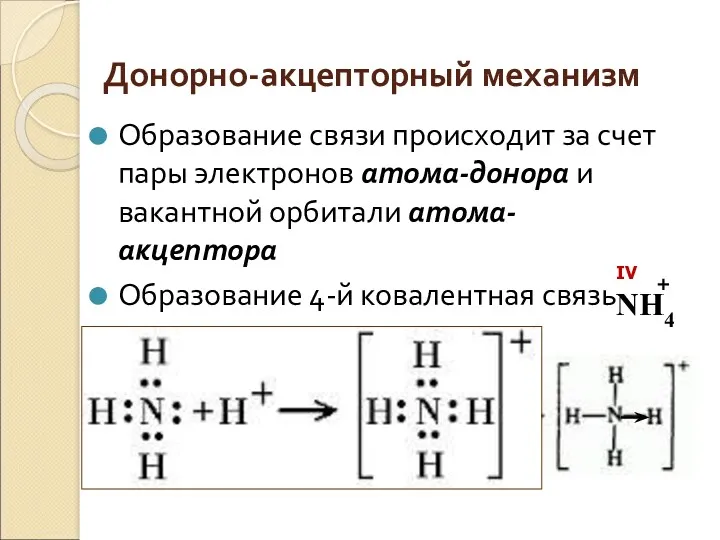
- 7. Донорно-акцепторный механизм Образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора Образование 4-й
- 8. Валентности фосфора Нормальное (спокойное) состоянии: Валентность III 3 неспаренных электрона Возбуждённое состояние: Валентность V 5 неспаренных
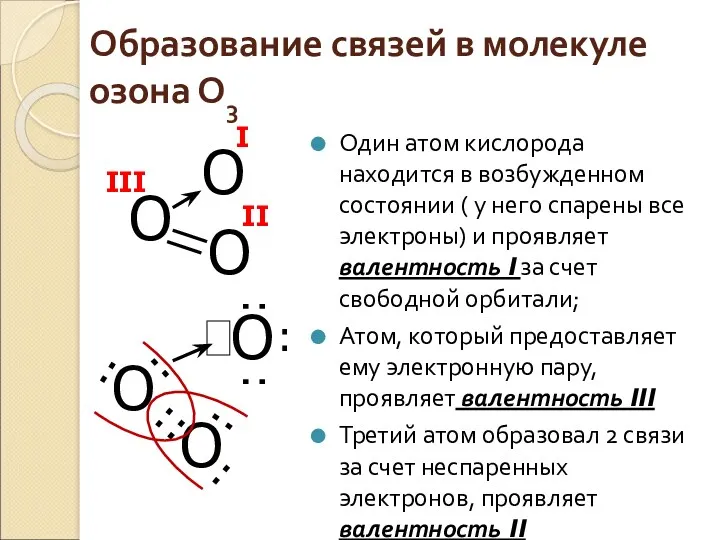
- 9. Образование связей в молекуле озона О3 Один атом кислорода находится в возбужденном состоянии ( у него
- 10. Степень окисления - это условный заряд, который бы приобрел атом, если бы все связи в веществе
- 11. Степень окисления 1)Численно С.О. совпадает с валентностью, если в веществе нет: а) Неполярных связей б)Донорно-акцепторных связей
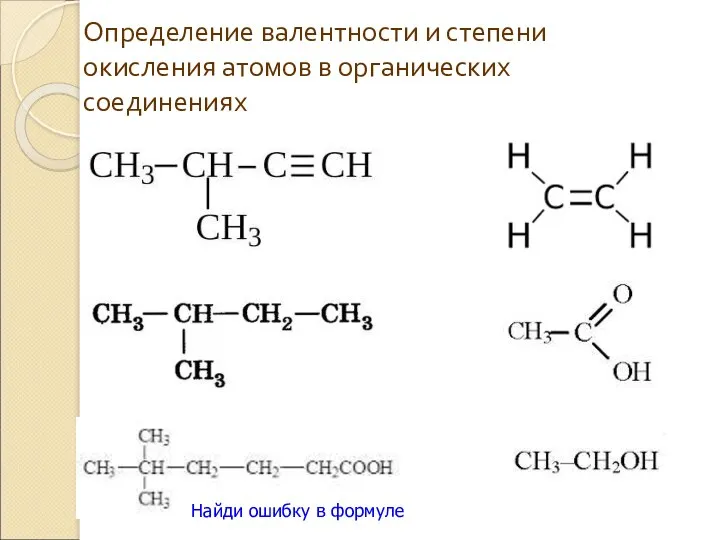
- 12. Определение валентности и степени окисления атомов в органических соединениях Найди ошибку в формуле
- 14. Скачать презентацию




 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов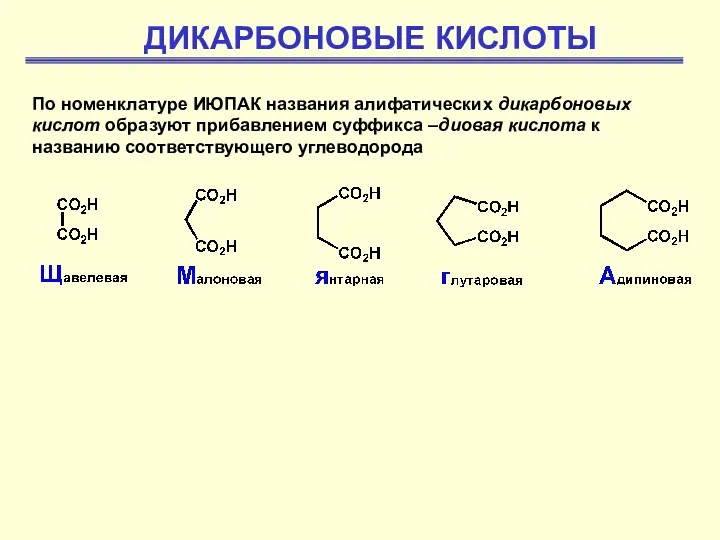 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка