Содержание
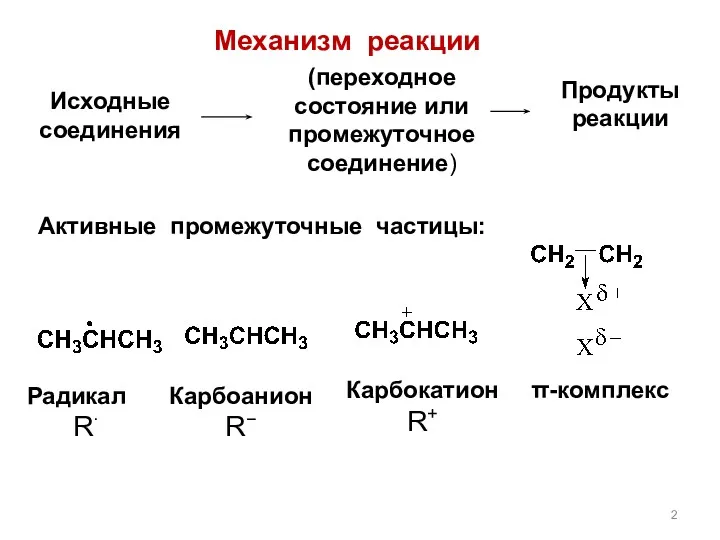
- 2. (переходное состояние или промежуточное соединение) Механизм реакции Исходные соединения Продукты реакции Активные промежуточные частицы: Радикал R∙
- 3. электронный пространственный (статические и динамические) (молекула в нереагирующем состоянии) распределение электронной плотности в молекуле (электроотрицательность атомов,
- 4. Включают оценку энергии промежуточных частиц или переходного состояния. Чем больше возможностей для делокализации (рассредоточения) электронной плотности
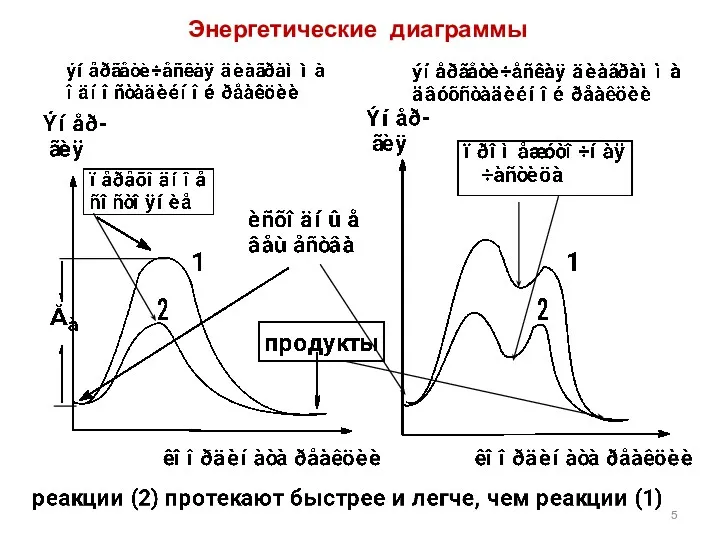
- 5. Энергетические диаграммы
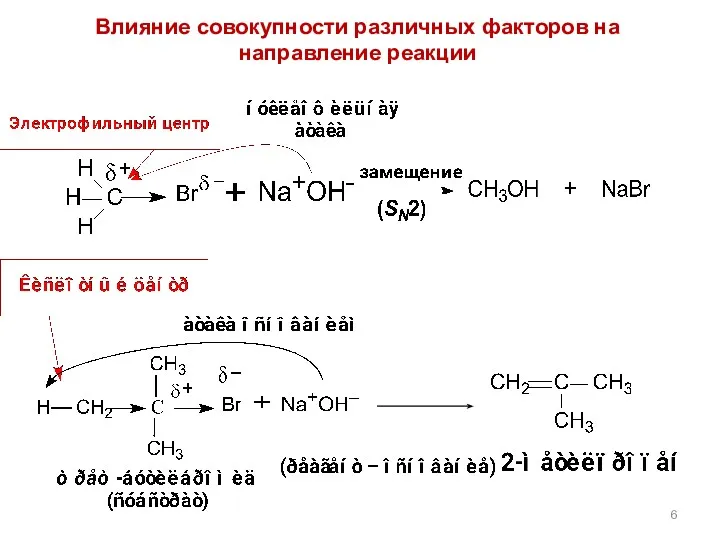
- 6. Влияние совокупности различных факторов на направление реакции
- 7. 2. Термический − расщепление ковалентной связи за счет тепловой энергии (термолиз). 3. Химический − образование радикалов
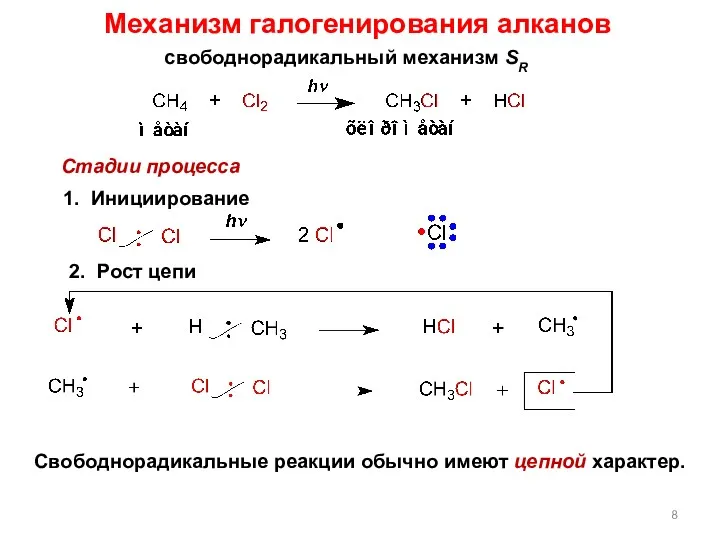
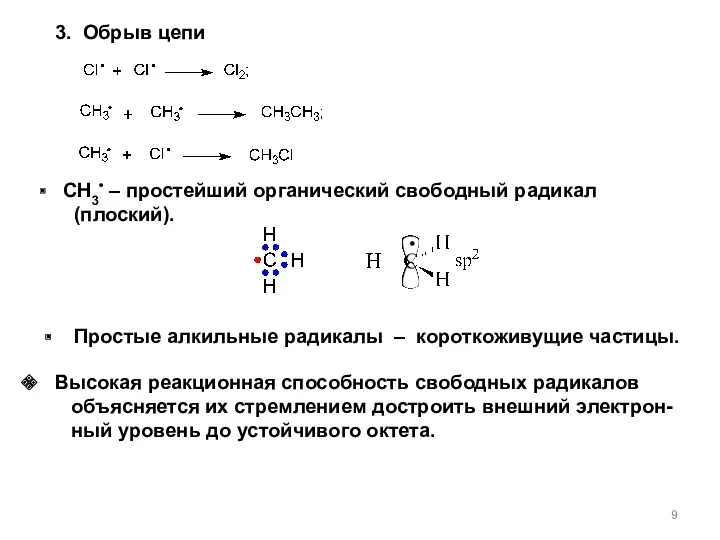
- 8. свободнорадикальный механизм SR Стадии процесса 1. Инициирование 2. Рост цепи Свободнорадикальные реакции обычно имеют цепной характер.
- 9. Высокая реакционная способность свободных радикалов объясняется их стремлением достроить внешний электрон- ный уровень до устойчивого октета.
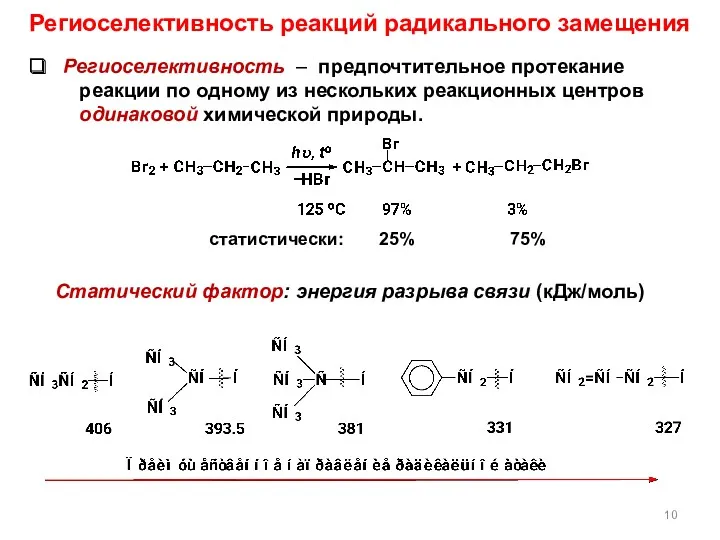
- 10. Статический фактор: энергия разрыва связи (кДж/моль) статистически: 25% 75% Региоселективность реакций радикального замещения Региоселективность – предпочтительное
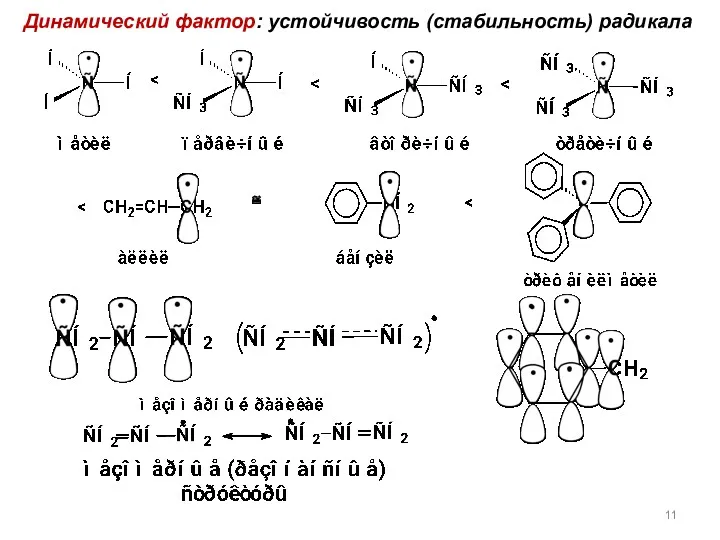
- 11. Динамический фактор: устойчивость (стабильность) радикала
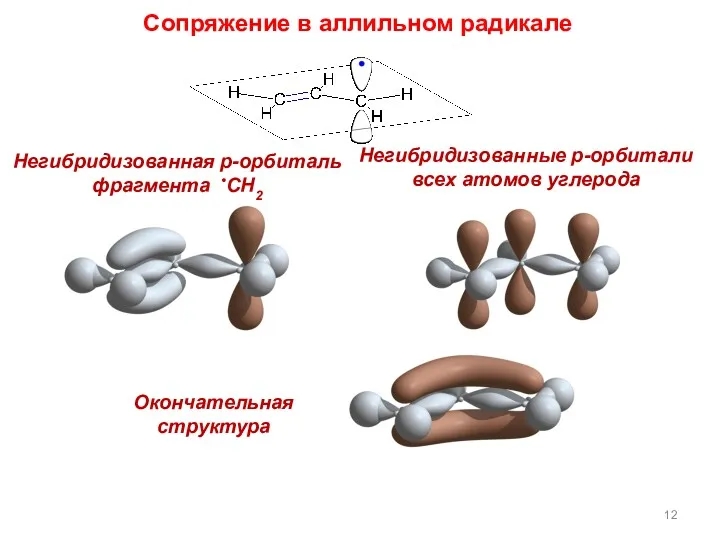
- 12. Окончательная структура Негибридизованная p-орбиталь фрагмента •CH2 Негибридизованные p-орбитали всех атомов углерода Сопряжение в аллильном радикале
- 13. Более высокая селективность менее активного реагента (радикала брома) по сравнению с более активным реагентом (радикалом хлора)
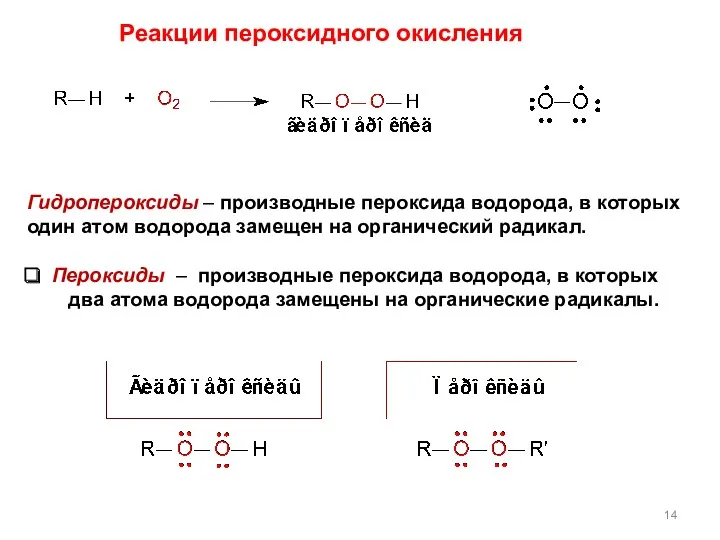
- 14. Гидропероксиды – производные пероксида водорода, в которых один атом водорода замещен на органический радикал. Пероксиды –
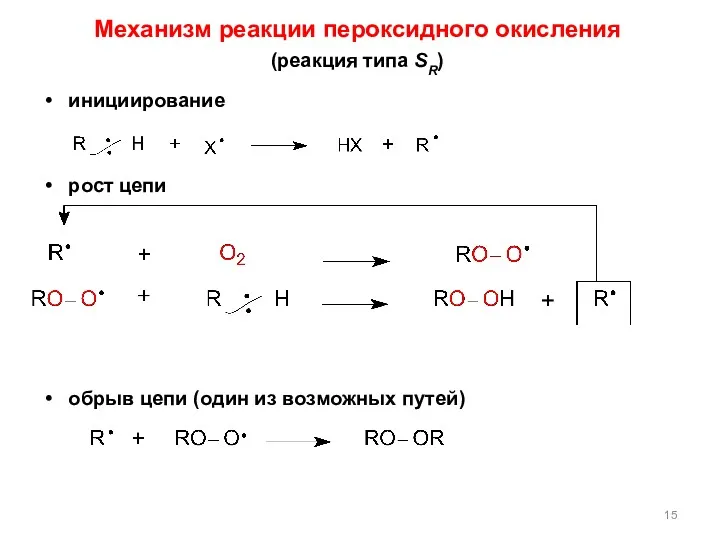
- 15. инициирование рост цепи обрыв цепи (один из возможных путей) Механизм реакции пероксидного окисления (реакция типа SR)
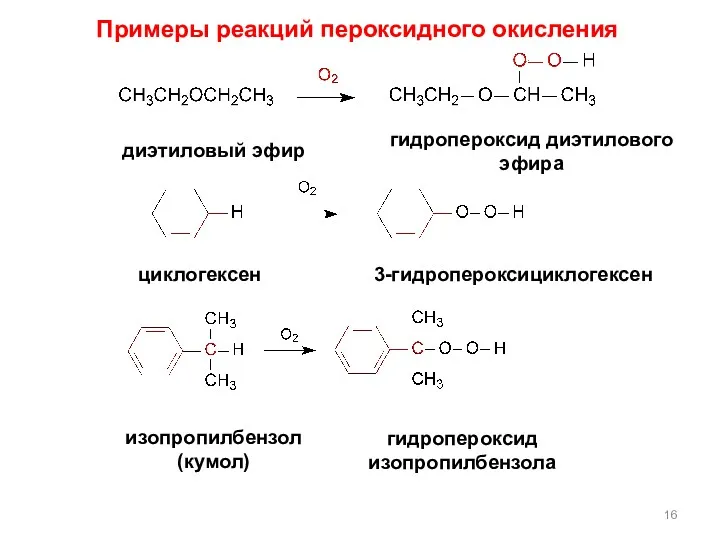
- 16. Примеры реакций пероксидного окисления гидропероксид диэтилового эфира диэтиловый эфир циклогексен 3-гидропероксициклогексен изопропилбензол (кумол) гидропероксид изопропилбензола
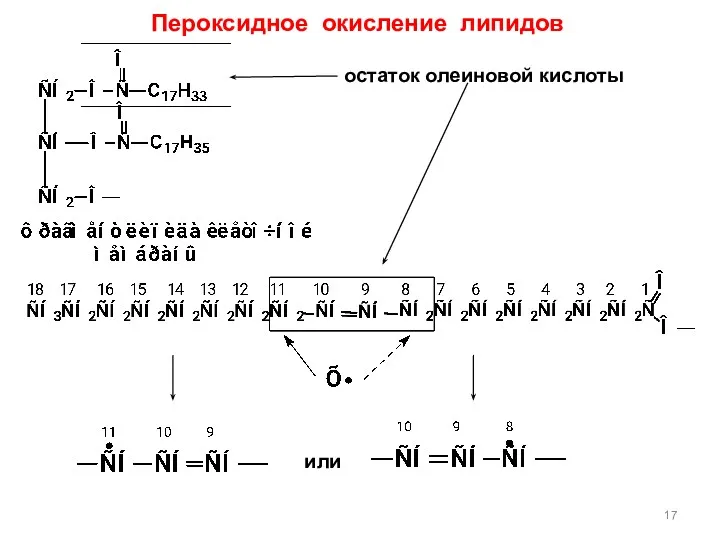
- 17. Пероксидное окисление липидов остаток олеиновой кислоты или
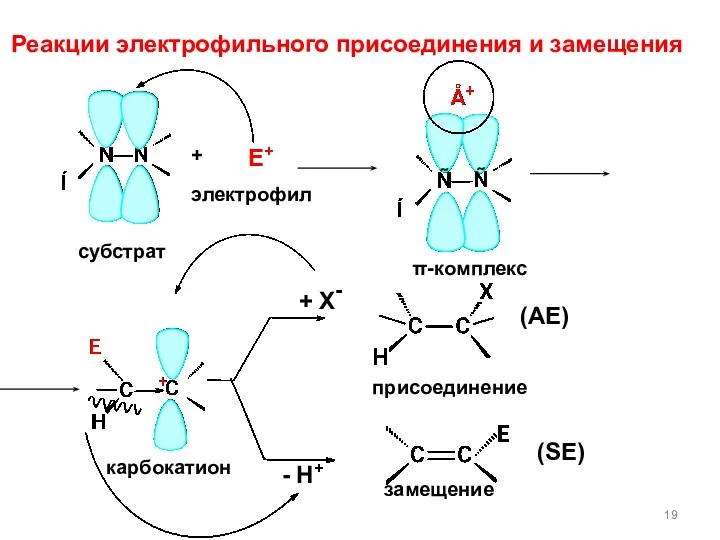
- 19. Реакции электрофильного присоединения и замещения карбокатион + Е+ электрофил π-комплекс субстрат + Х- - Н+ (АЕ)
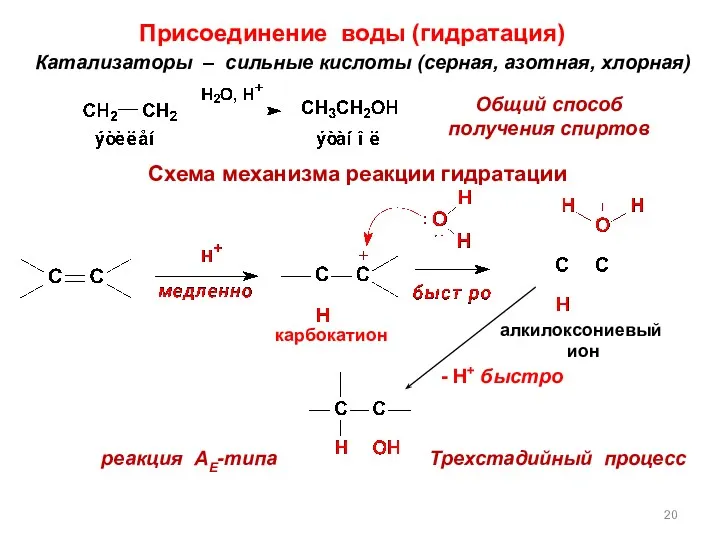
- 20. Катализаторы – сильные кислоты (серная, азотная, хлорная) Общий способ получения спиртов Схема механизма реакции гидратации Трехстадийный
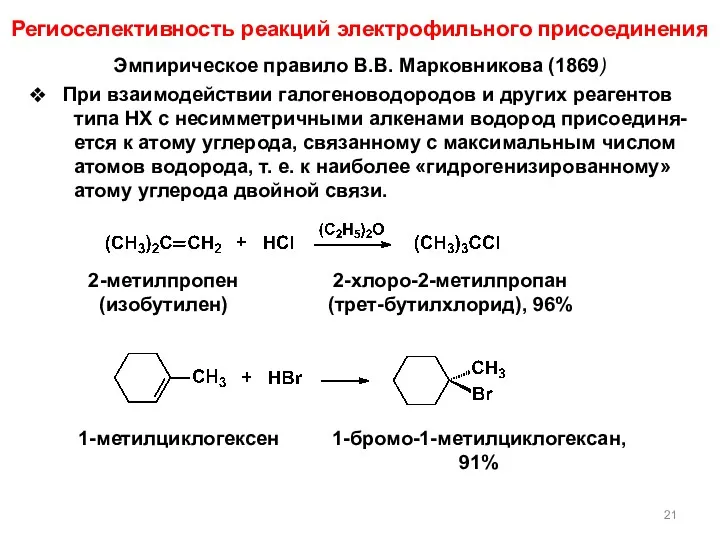
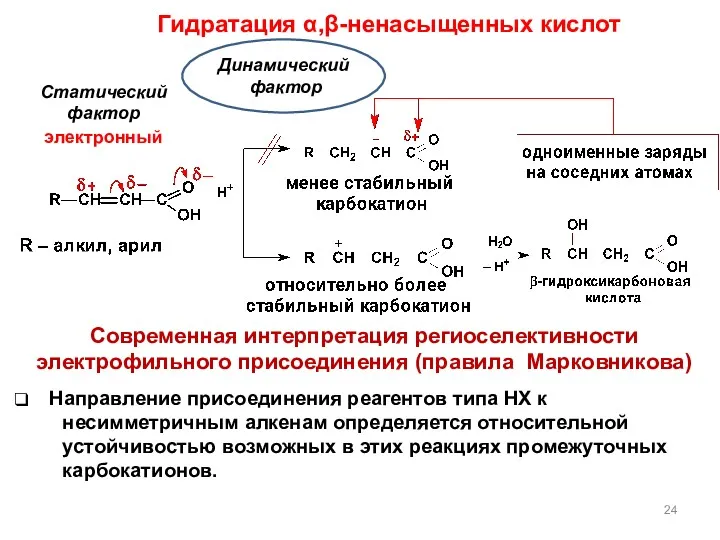
- 21. Эмпирическое правило В.В. Марковникова (1869) При взаимодействии галогеноводородов и других реагентов типа НХ с несимметричными алкенами
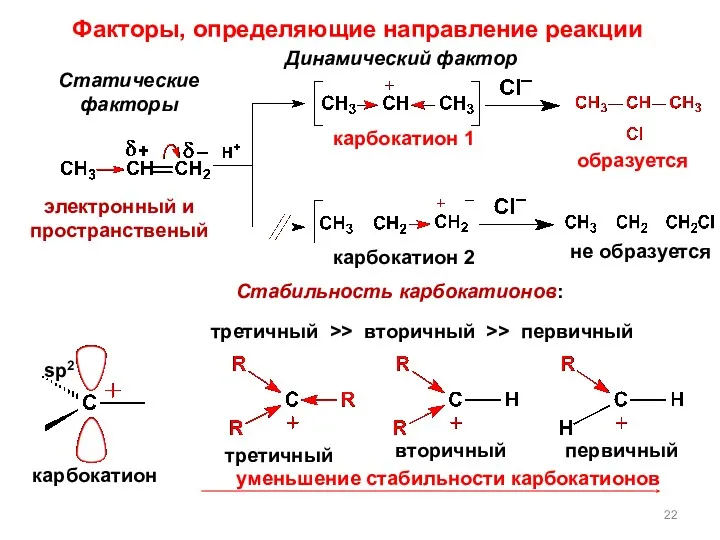
- 22. электронный и пространственый Статические факторы Динамический фактор Стабильность карбокатионов: уменьшение стабильности карбокатионов Факторы, определяющие направление реакции
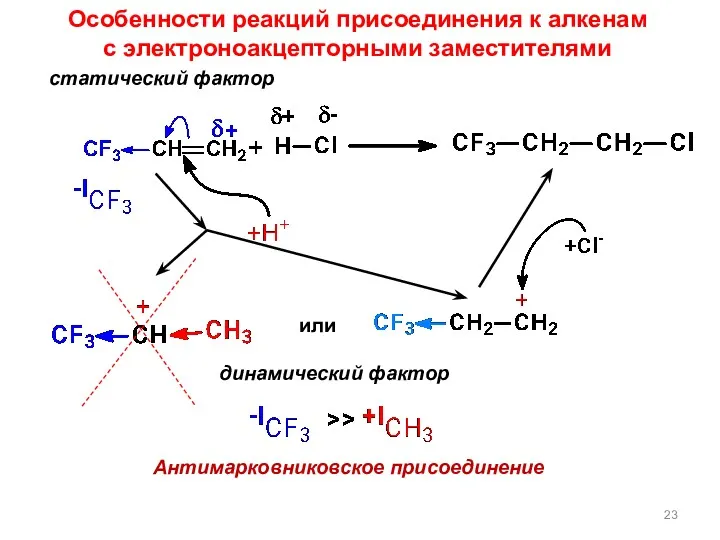
- 23. Особенности реакций присоединения к алкенам с электроноакцепторными заместителями статический фактор динамический фактор или Антимарковниковское присоединение
- 24. Статический фактор электронный Направление присоединения реагентов типа НХ к несимметричным алкенам определяется относительной устойчивостью возможных в
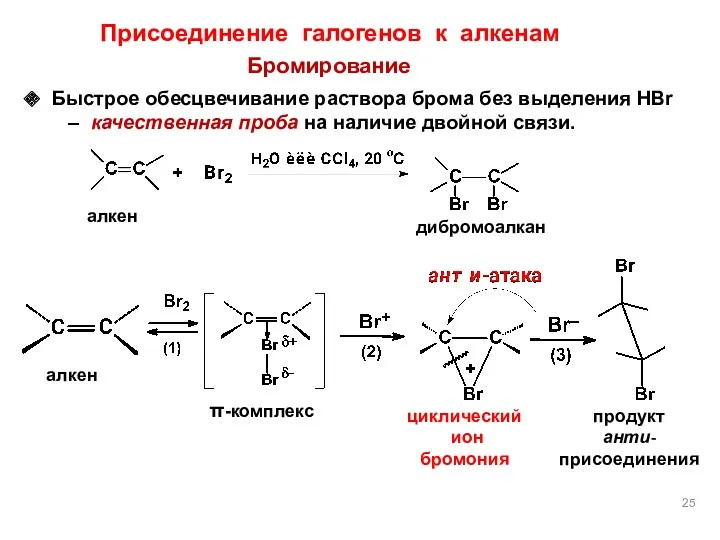
- 25. Быстрое обесцвечивание раствора брома без выделения HBr – качественная проба на наличие двойной связи. Бромирование алкен
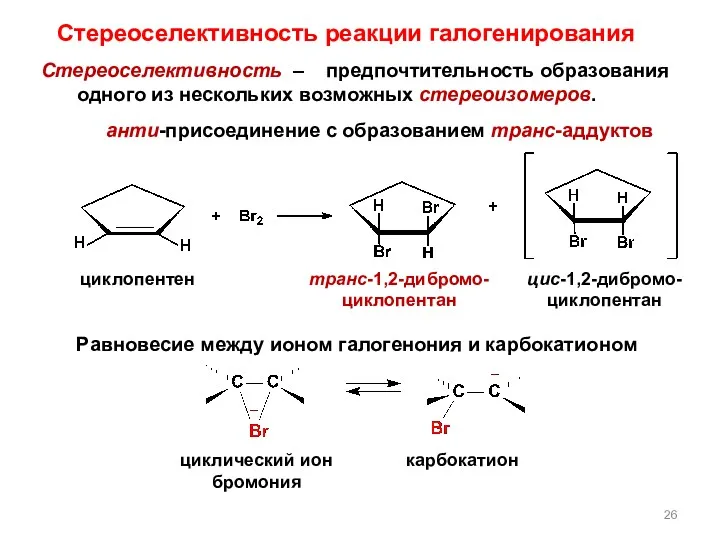
- 26. Равновесие между ионом галогенония и карбокатионом анти-присоединение с образованием транс-аддуктов циклический ион бромония карбокатион транс-1,2-дибромо-циклопентан циклопентен
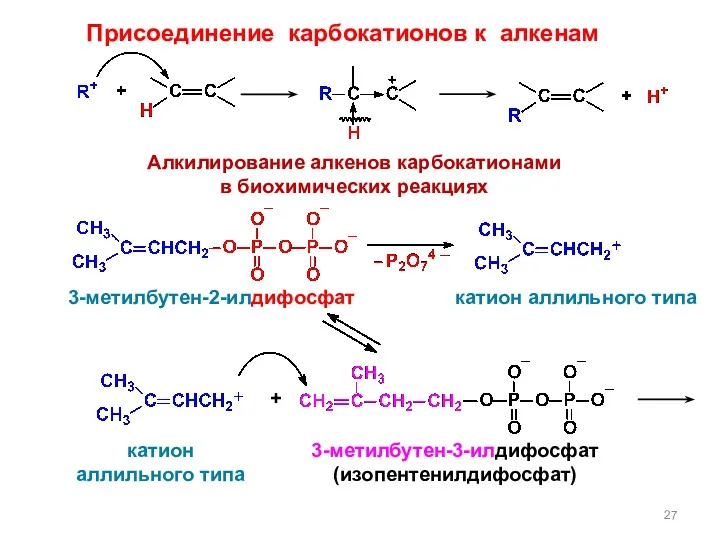
- 27. Алкилирование алкенов карбокатионами в биохимических реакциях катион аллильного типа катион аллильного типа 3-метилбутен-2-илдифосфат 3-метилбутен-3-илдифосфат (изопентенилдифосфат) +
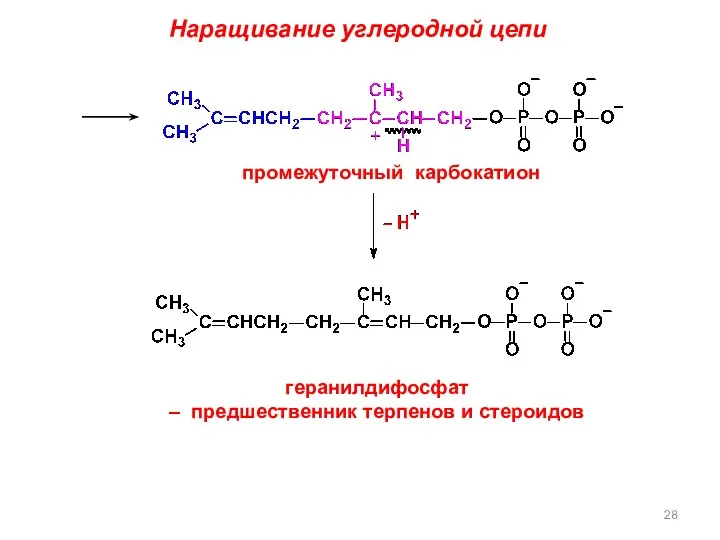
- 28. Наращивание углеродной цепи промежуточный карбокатион геранилдифосфат – предшественник терпенов и стероидов
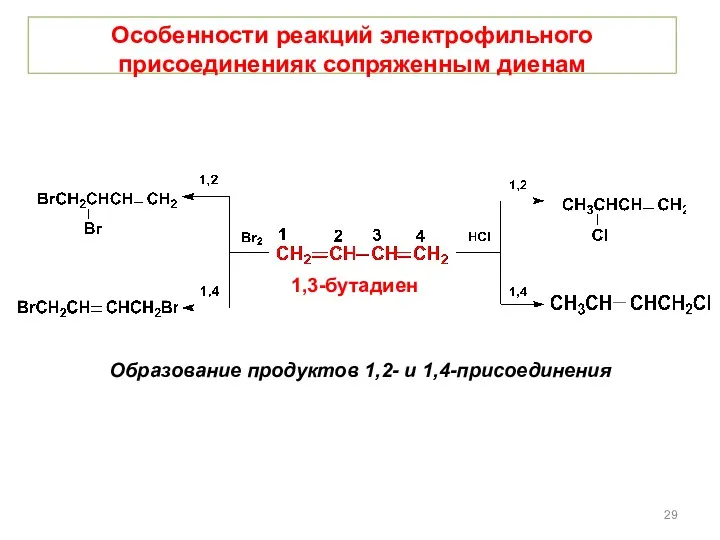
- 29. Особенности реакций электрофильного присоединенияк сопряженным диенам Образование продуктов 1,2- и 1,4-присоединения 1,3-бутадиен
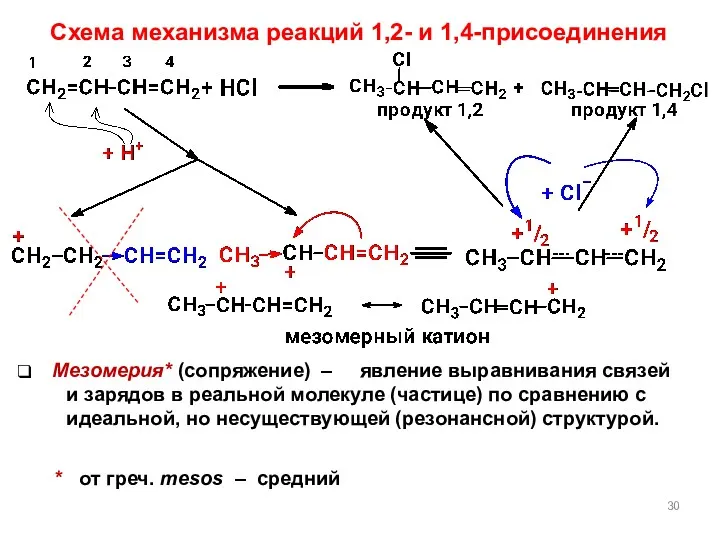
- 30. Схема механизма реакций 1,2- и 1,4-присоединения Мезомерия* (сопряжение) – * от греч. mesos – средний явление
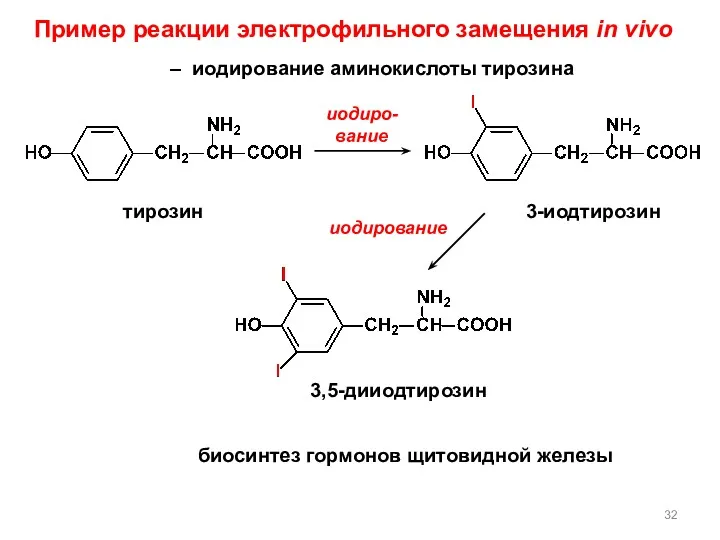
- 32. Пример реакции электрофильного замещения in vivo – иодирование аминокислоты тирозина тирозин 3-иодтирозин 3,5-дииодтирозин иодиро- вание иодирование
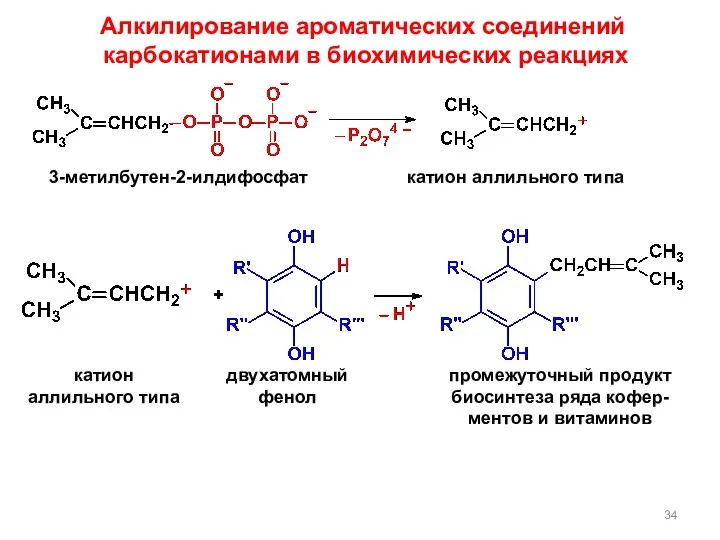
- 34. Алкилирование ароматических соединений карбокатионами в биохимических реакциях 3-метилбутен-2-илдифосфат катион аллильного типа катион аллильного типа двухатомный фенол
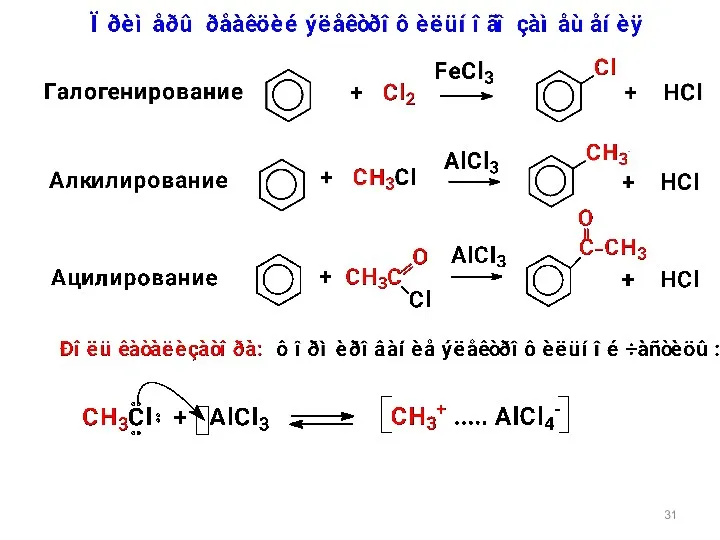
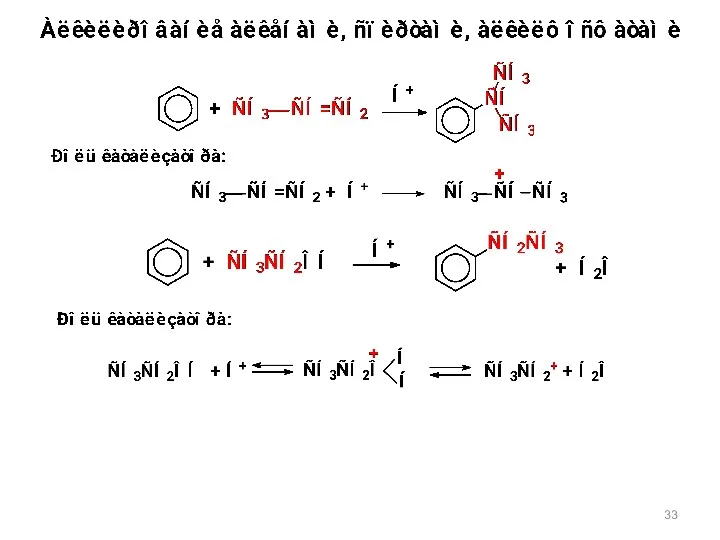
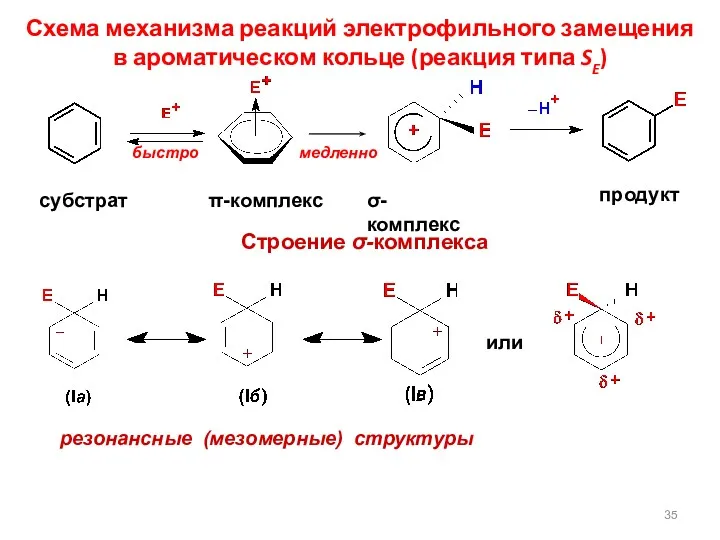
- 35. Схема механизма реакций электрофильного замещения в ароматическом кольце (реакция типа SE) Строение σ-комплекса резонансные (мезомерные) структуры
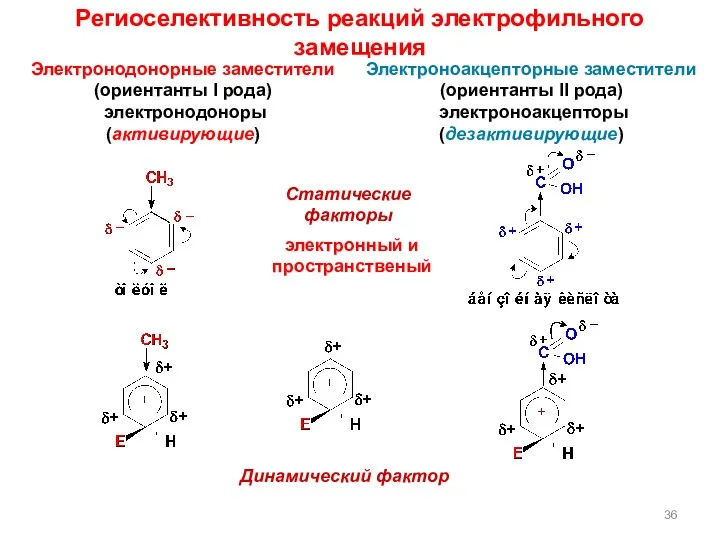
- 36. Региоселективность реакций электрофильного замещения Электроноакцепторные заместители (ориентанты II рода) электроноакцепторы (дезактивирующие) Статические факторы электронный и пространственый
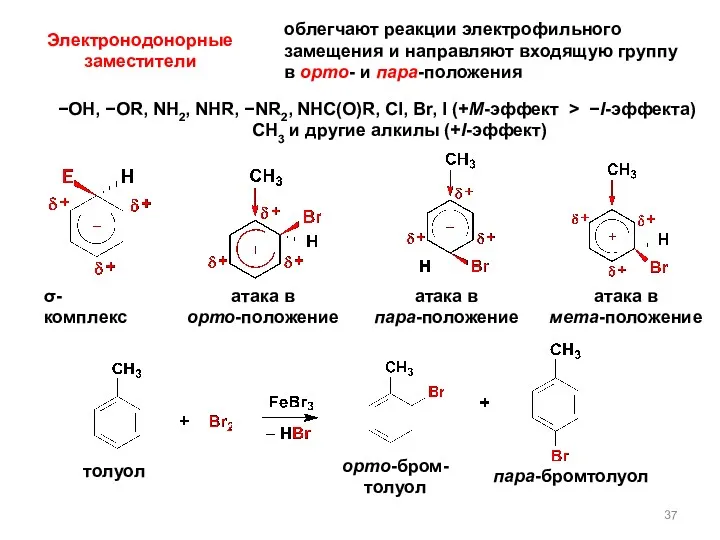
- 37. Электронодонорные заместители облегчают реакции электрофильного замещения и направляют входящую группу в орто- и пара-положения −OH, −OR,
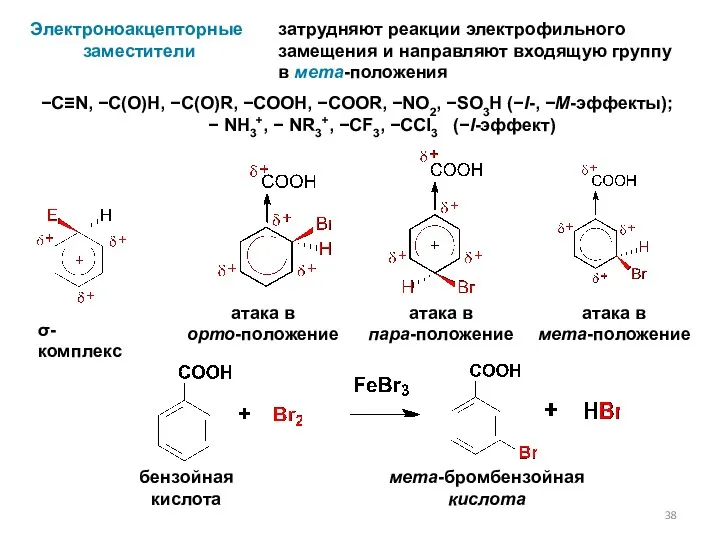
- 38. Электроноакцепторные заместители затрудняют реакции электрофильного замещения и направляют входящую группу в мета-положения −C≡N, −C(O)H, −C(O)R, −COOH,
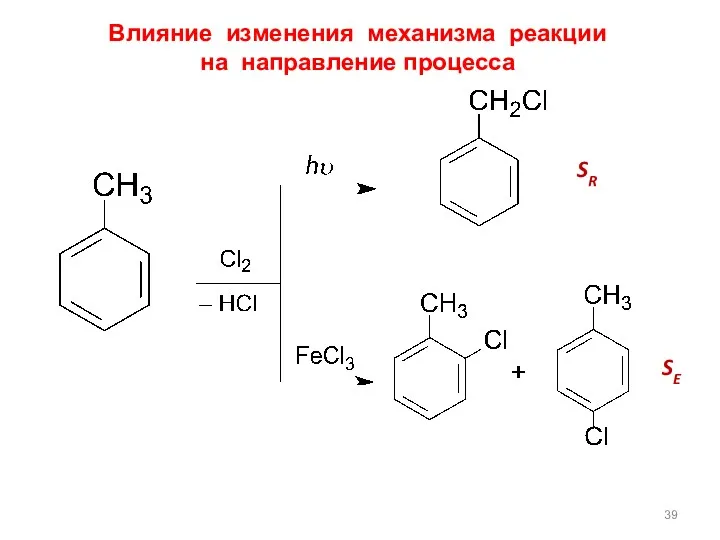
- 39. Влияние изменения механизма реакции на направление процесса SR SE
- 41. Скачать презентацию





 Люминесцентный анализ
Люминесцентный анализ Термодинамика химических процессов
Термодинамика химических процессов Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія
Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія Полимеры (10 класс)
Полимеры (10 класс) Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Серная кислота и её свойства
Серная кислота и её свойства Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Химическая промышленность
Химическая промышленность Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості Азотовмісні сполуки
Азотовмісні сполуки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Хімічні властивості кислот
Хімічні властивості кислот Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Методика преподавания химии
Методика преподавания химии Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Закон сохранения массы веществ. Урок вместе с умной колонкой
Закон сохранения массы веществ. Урок вместе с умной колонкой Получение и применение алканов
Получение и применение алканов Розв'язування задач за рівнянням хімічних реакцій
Розв'язування задач за рівнянням хімічних реакцій Кислород/водород. Повторение
Кислород/водород. Повторение История открытия химических веществ
История открытия химических веществ Некоторые структурные особенности макромолекул
Некоторые структурные особенности макромолекул 20231009_zhyostkost_vody
20231009_zhyostkost_vody Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Железо и его соединения
Железо и его соединения Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері