Содержание
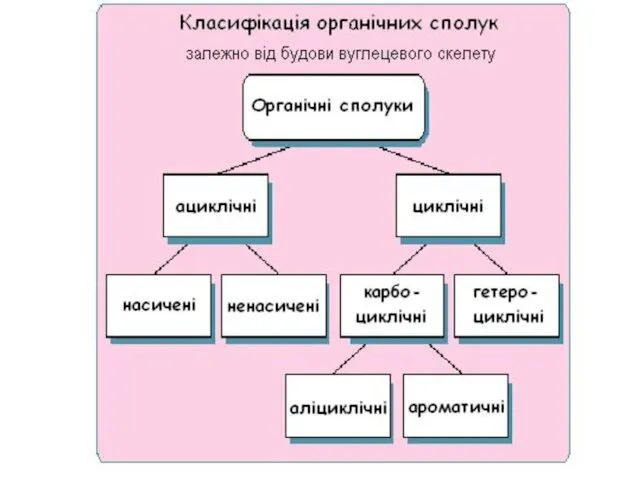
- 2. План 1. Класифікація органічних сполук. 2. Номенклатура органічних сполук. 3. Ковалентний зв*язок. Спряжені системи. Ароматичність. 4.
- 3. Положення теорії Бутлерова 1. Атоми, що входять до складу молекули органічних сполук, зв’язані між собою в
- 5. метан
- 7. АЛКАНИ (насичені вуглеводні, парафіни)
- 8. Алкани СН4 Метан СН3 Метил С2Н6 Етан С2Н5 Етил С3Н8 Пропан С3Н7 Пропіл С4Н10 Бутан С4Н9
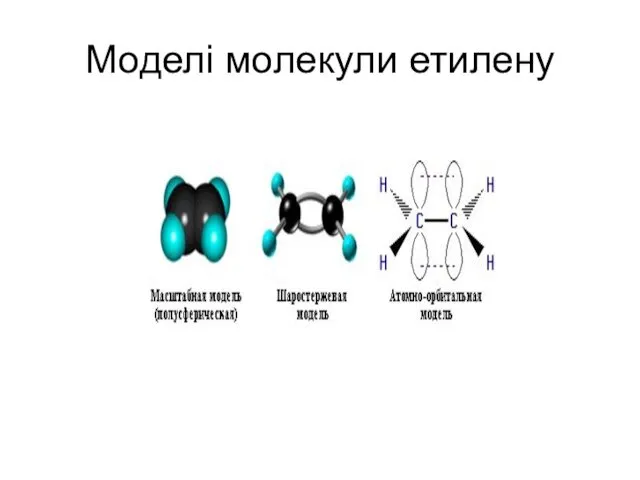
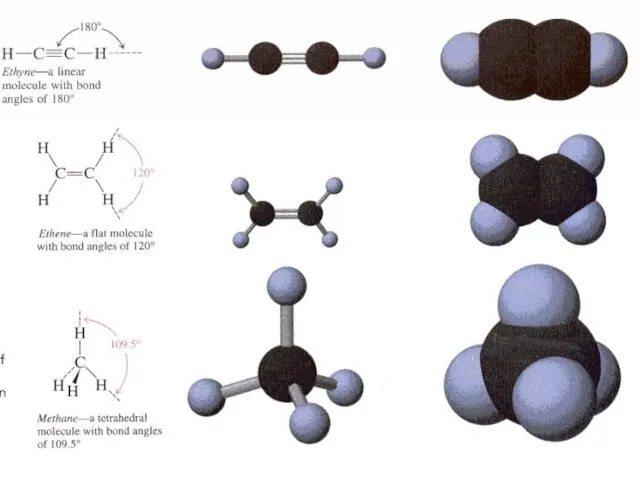
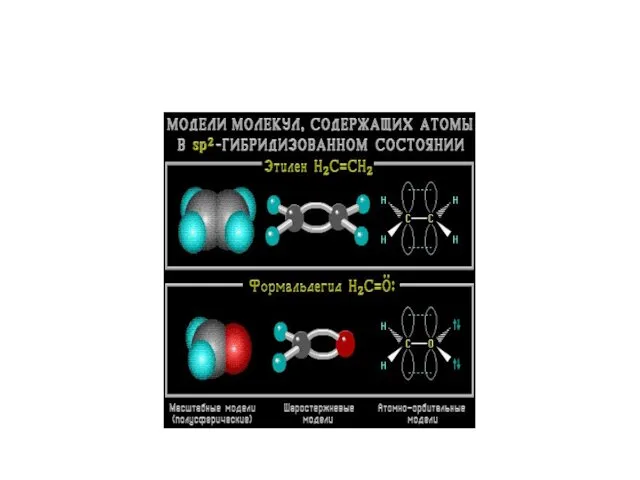
- 9. Моделі молекули етилену
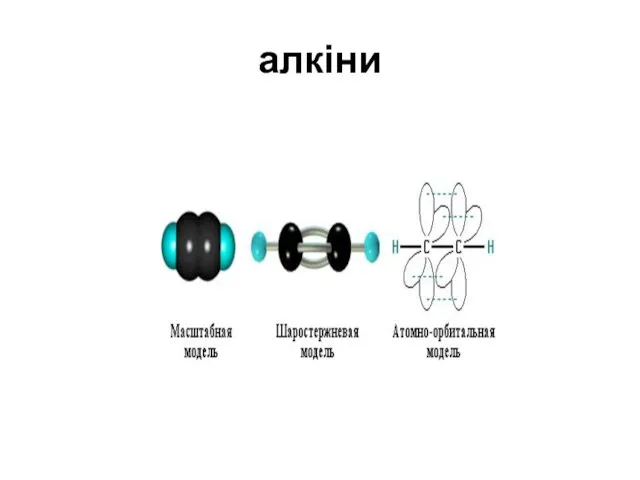
- 10. алкіни
- 11. карбоциклічні: аліфатичні циклічні (аліциклічні)
- 12. карбоциклічні: ароматичні
- 13. Всі органічні сполуки можна розглядати як вуглеводні вказаної будови або похідні вуглеводнів, одержані шляхом введення в
- 14. класи За природою функціональних груп похідні вуглеводнів діляться на класи: галогенопохідні R-X, спирти і феноли R-OH,
- 16. Порядок старшинства функціональних груп, що вказуються і в префіксі і в закінченні Функціональна група -СОООН -SO3H
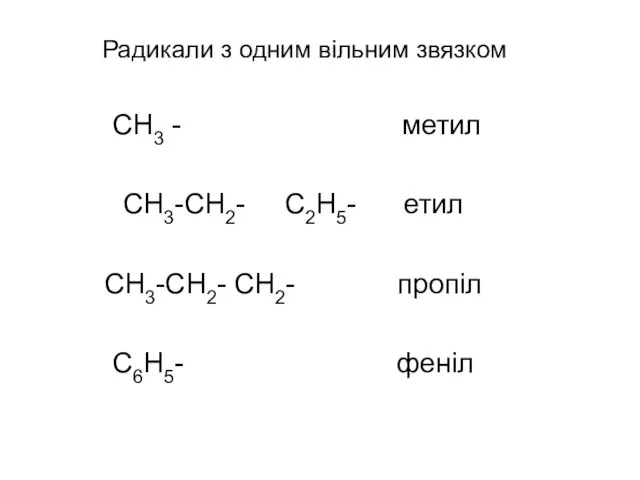
- 19. Радикали з одним вільним звязком СН3 - метил СН3-СН2- С2Н5- етил СН3-СН2- СН2- пропіл С6Н5- феніл
- 20. Міжнародна номенклатура (IUPAC). Правила сучасної номенклатури були розроблені у 1957 році на ХІХ конгресі Міжнародного союзу
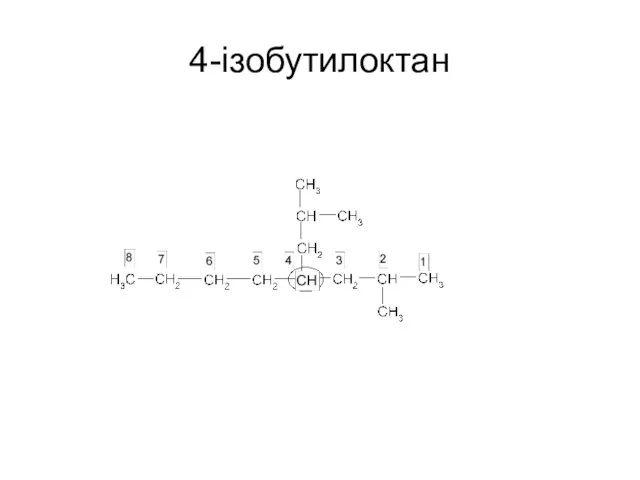
- 21. 4-iзобутилоктан
- 22. Замісникова номенклатура Правила номенклатури. 1. При утворенні назв за замісниковою номенклатурою органічні сполуки розглядають як похідні
- 23. Замісникова номенклатура 3. Визначають родоначальну структуру молекули. Це є структурний фрагмент молекули, що лежить в основі
- 24. назви
- 25. аланін (тривіальна назва) 2-амінопропанова кислота (замісникова ІЮПАК) α-амінопропіонова кислота (радикально-функціональна)
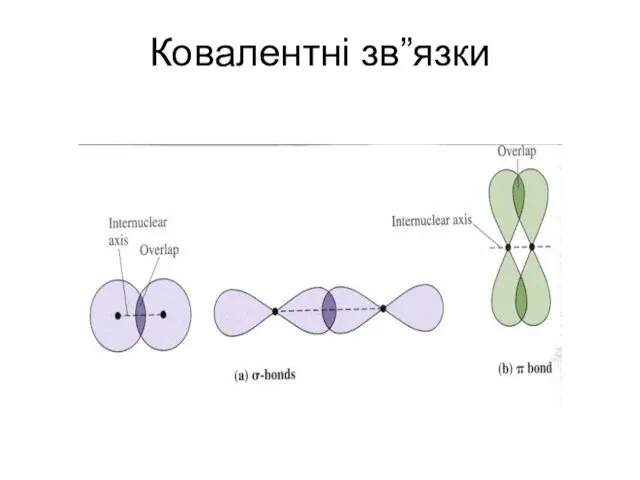
- 26. Ковалентні зв”язки
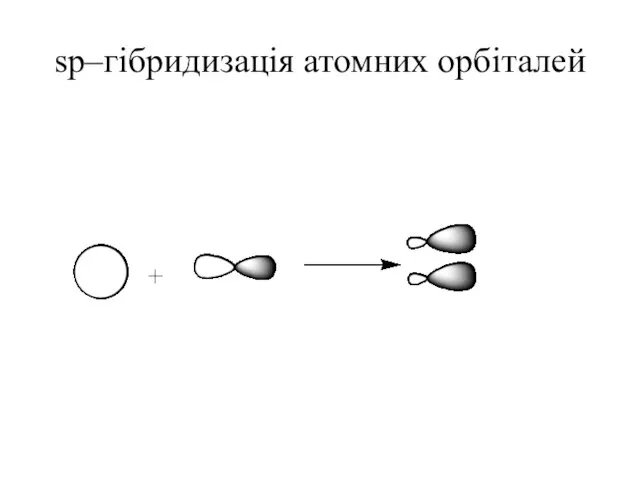
- 28. sp–гібридизація атомних орбіталей
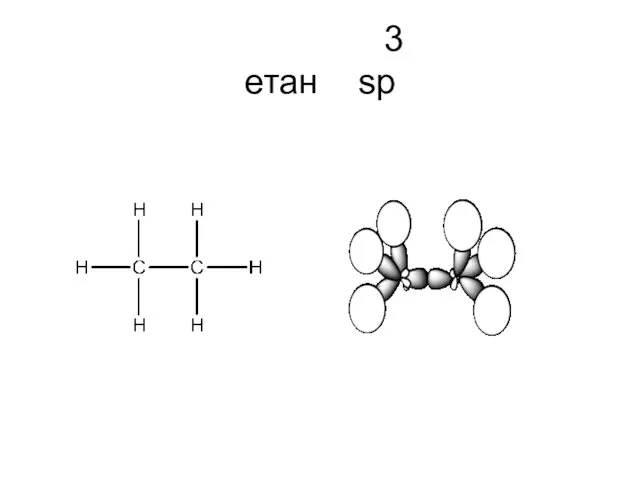
- 29. 3 етан sp
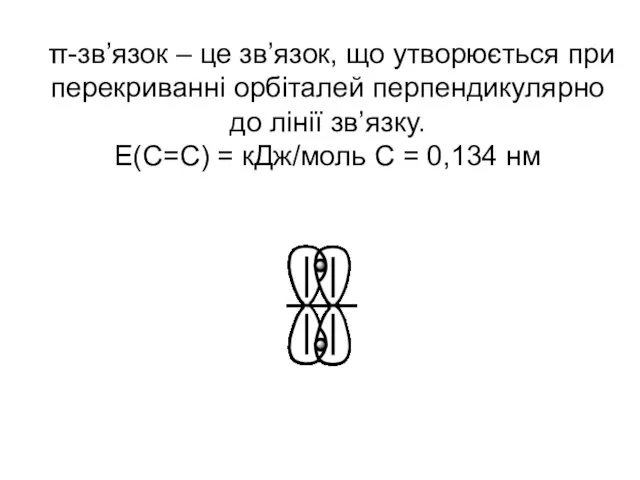
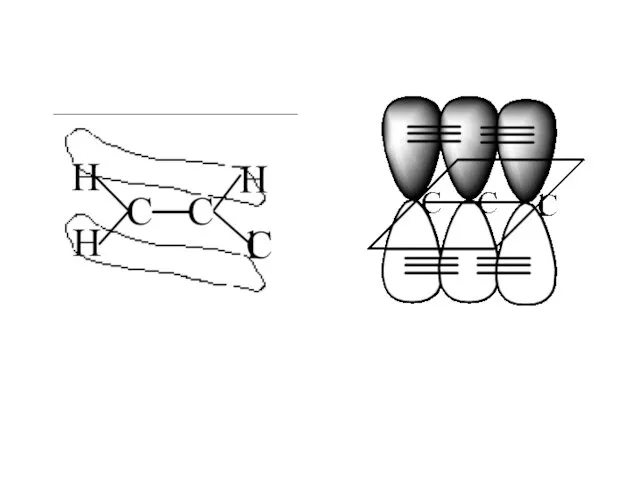
- 30. π-зв’язок – це зв’язок, що утворюється при перекриванні орбіталей перпендикулярно до лінії зв’язку. Е(С=С) = кДж/моль
- 32. Електронні ефекти Характерні риси індукційного ефекту. 1. Індукційний ефект впливає на всі атоми насиченого ланцюга в
- 36. Передача взаємного впливу атомів, перерозподіл густини в молекулі, що супроводжується не через систему σ-зв’язків, а через
- 38. Критерії ароматичності аренів: Атоми Карбону в sp2-гібридизованому стані утворюють циклічну систему. Атоми Карбону розташовуються в одній
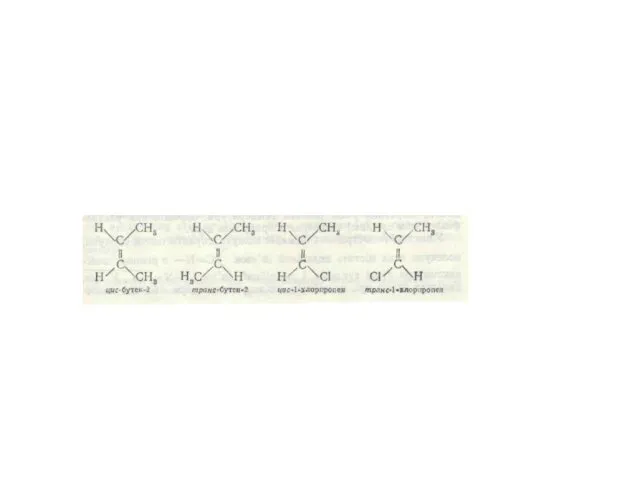
- 39. Ізомерія органічних сполук
- 40. бутан
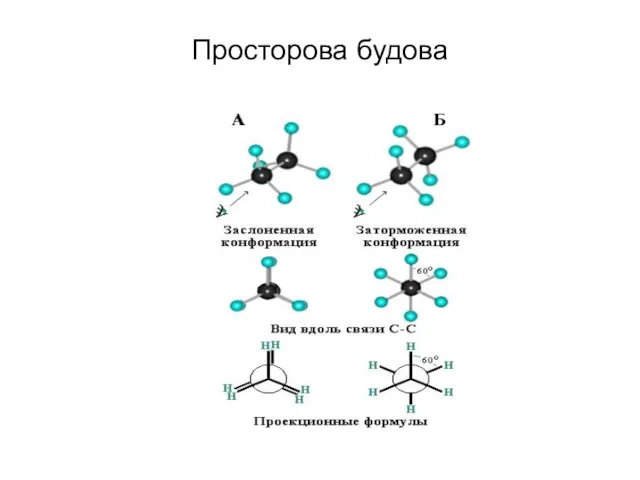
- 41. Просторова будова
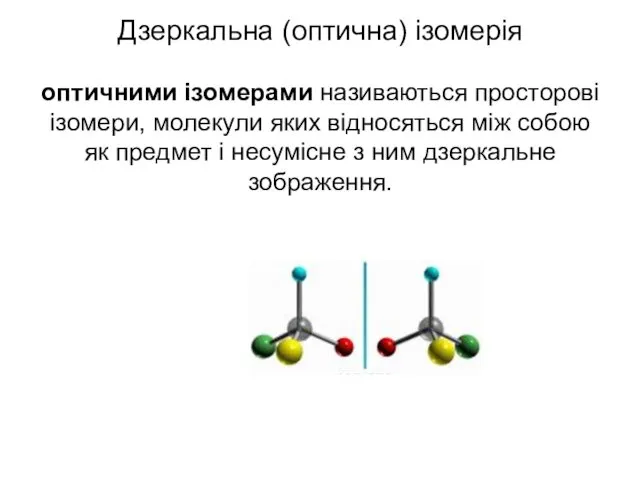
- 43. Дзеркальна (оптична) ізомерія оптичними ізомерами називаються просторові ізомери, молекули яких відносяться між собою як предмет і
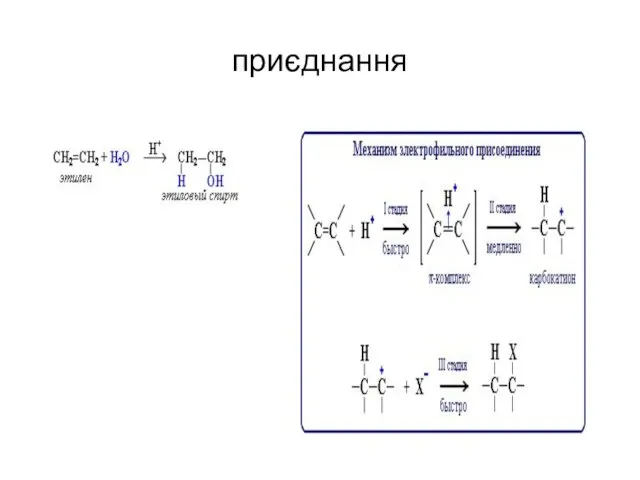
- 46. приєднання
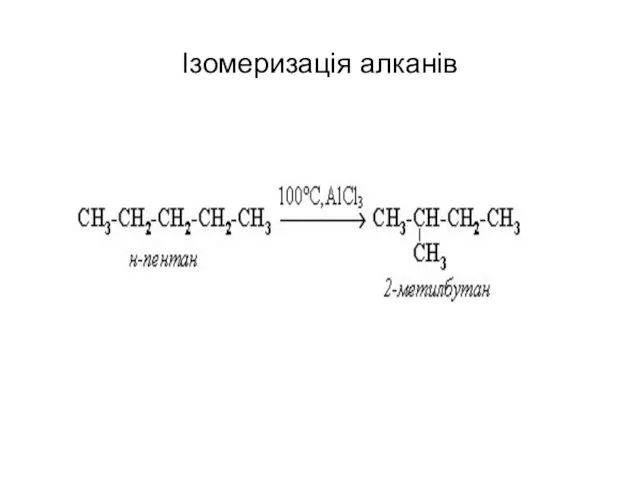
- 47. Ізомеризація алканів
- 49. спирти за числом гідроксильних груп спирти поділяються на одноатомні (одна група -ОН), багатоатомні (дві й більше
- 50. спирти Залежно від того, з яким атомом вуглецю (первинним, вторинним чи третинним)зв'язана гідроксигрупа, розрізняють спирти первинні
- 51. Номенклатура спиртів
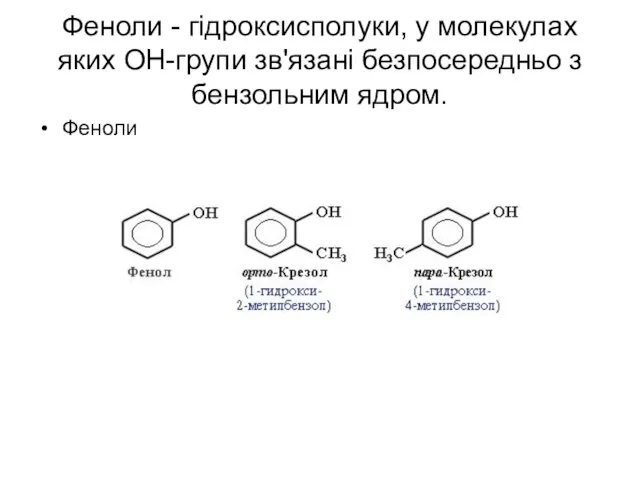
- 52. Феноли - гідроксисполуки, у молекулах яких ОН-групи зв'язані безпосередньо з бензольним ядром. Феноли
- 53. альдегіди Мурашиний (формальдегід) Метаналь – 40 % розчин – формалін Оцтовий (ацетальдегід Пропіоновий
- 55. Приєднання води – утворення гідратів альдегідів
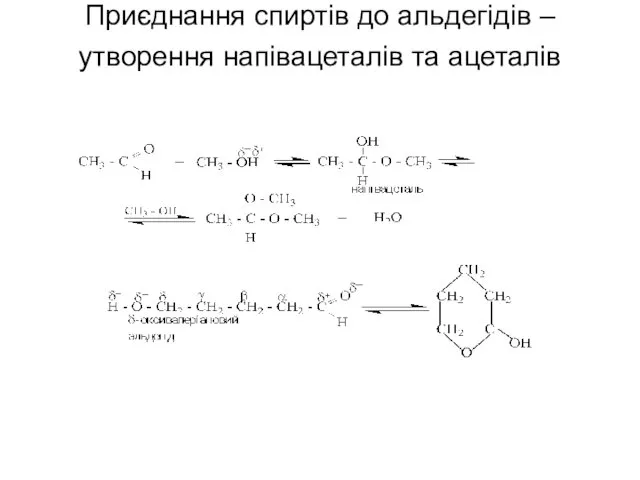
- 56. Приєднання спиртів до альдегідів – утворення напівацеталів та ацеталів
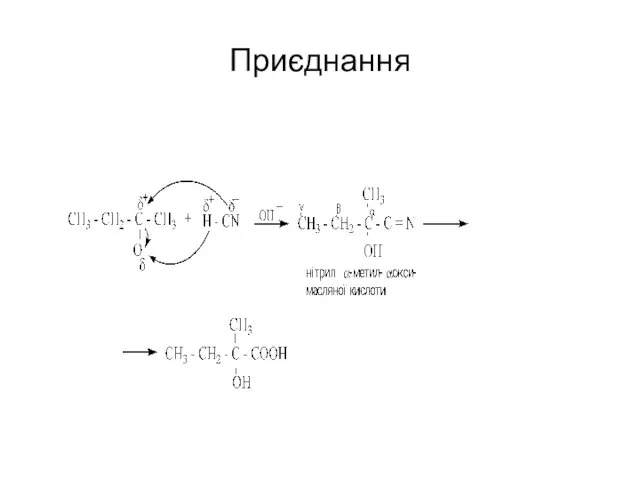
- 57. Приєднання
- 58. Альдольна конденсація
- 59. Реакція Канніцаро – дисмутації – самоокиснення-самовідновлення – диспропорціонування для мурашиного альдегіду
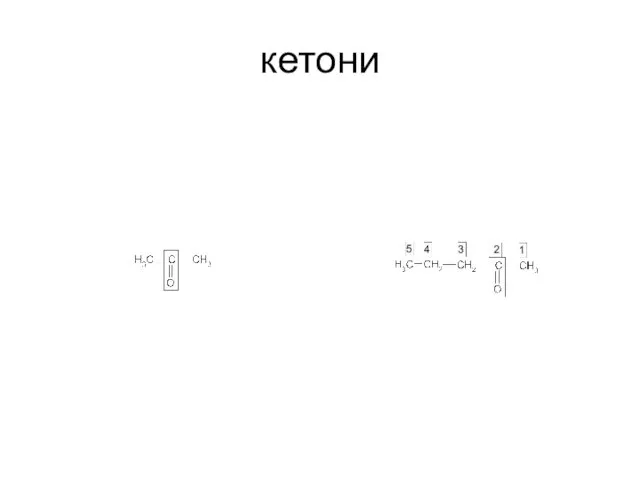
- 60. кетони
- 61. Галогенування. Йодоформна проба
- 63. Скачать презентацию







































 Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення
Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии
Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии Физические свойства минералов
Физические свойства минералов Химия элементов VIA группы
Химия элементов VIA группы Физические и химические явления
Физические и химические явления Методы контроля и анализа веществ
Методы контроля и анализа веществ Кремний, его физические и химические свойства
Кремний, его физические и химические свойства Синтез и химические модификации индиго
Синтез и химические модификации индиго Инертные газы
Инертные газы Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Признаки химических реакций
Признаки химических реакций Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Повторение. Ионные уравнения реакции
Повторение. Ионные уравнения реакции Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія
Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Техника безопасности на уроках химии
Техника безопасности на уроках химии Кислоты. Состав кислот
Кислоты. Состав кислот Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Химическая промышленность
Химическая промышленность Морские льды. Их классификация и закономерности движения
Морские льды. Их классификация и закономерности движения Начала органической химии
Начала органической химии Электроотрицательность химических элементов
Электроотрицательность химических элементов Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Алюминий
Алюминий Органическая химия
Органическая химия