Содержание
- 2. План урока 1.Общая формула и номенклатура. 2.Строение молекул. 3. Изомерия, гомология. 4. Физические свойства 5. Химические
- 3. Общая формула Арены – углеводороды, в молекулах которых содержится одно или несколько бензольных колец. Общая формула
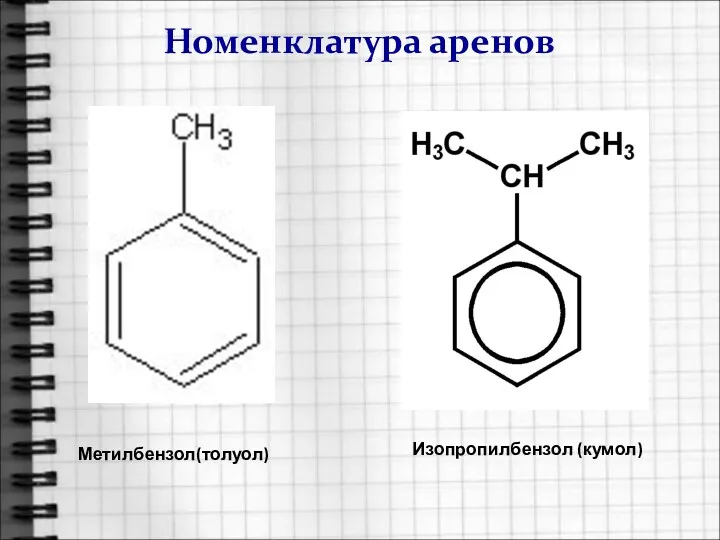
- 4. Номенклатура аренов Метилбензол(толуол) Изопропилбензол (кумол)
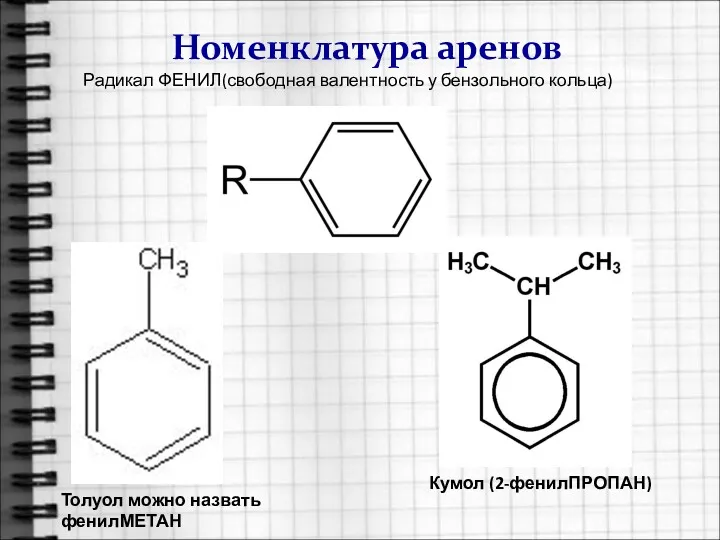
- 5. Номенклатура аренов Радикал ФЕНИЛ(свободная валентность у бензольного кольца) Толуол можно назвать фенилМЕТАН Кумол (2-фенилПРОПАН)
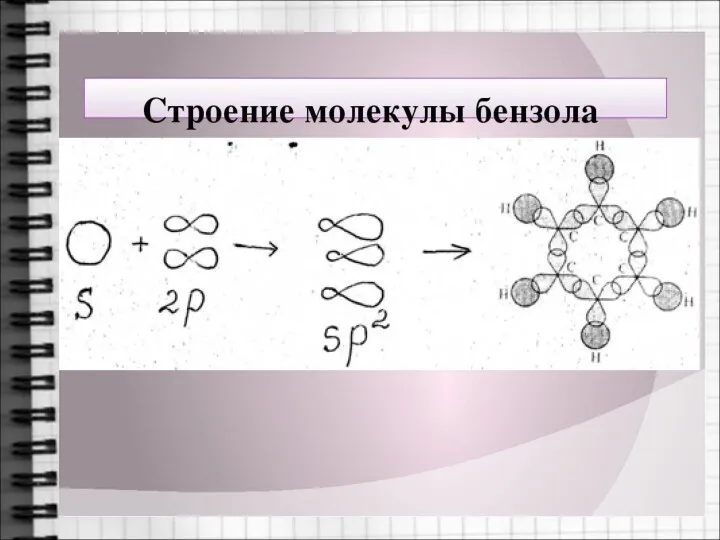
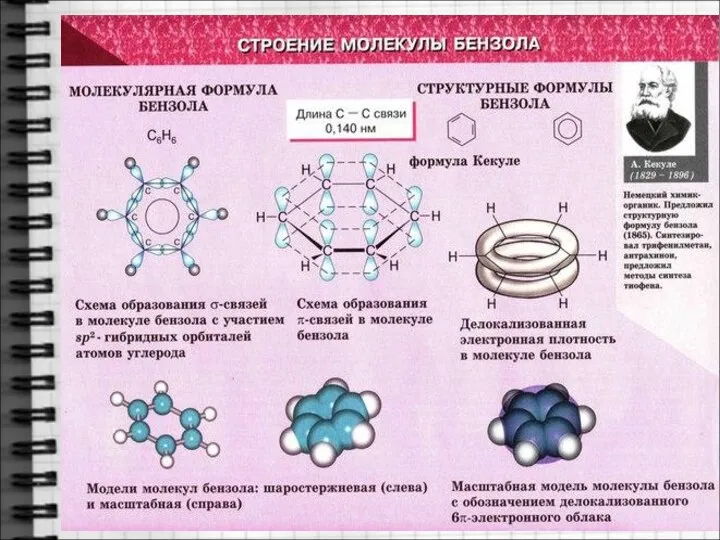
- 6. Строение молекулы бензола
- 7. Строение молекулы бензола
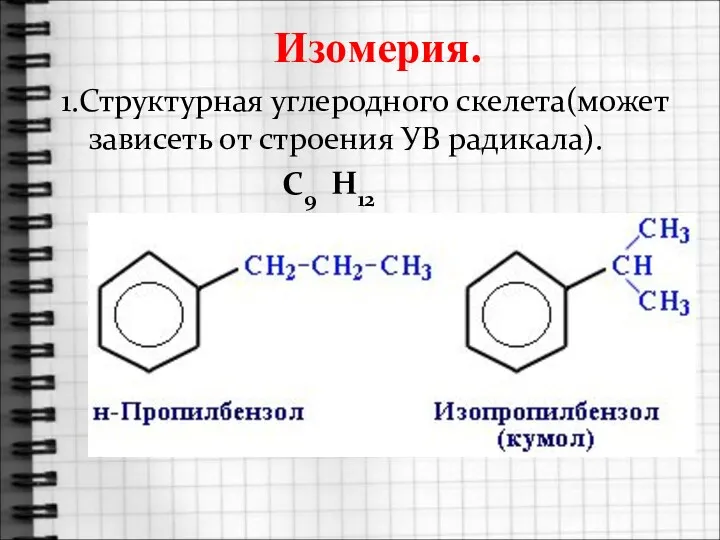
- 8. Изомерия. 1.Структурная углеродного скелета(может зависеть от строения УВ радикала). С9 Н12
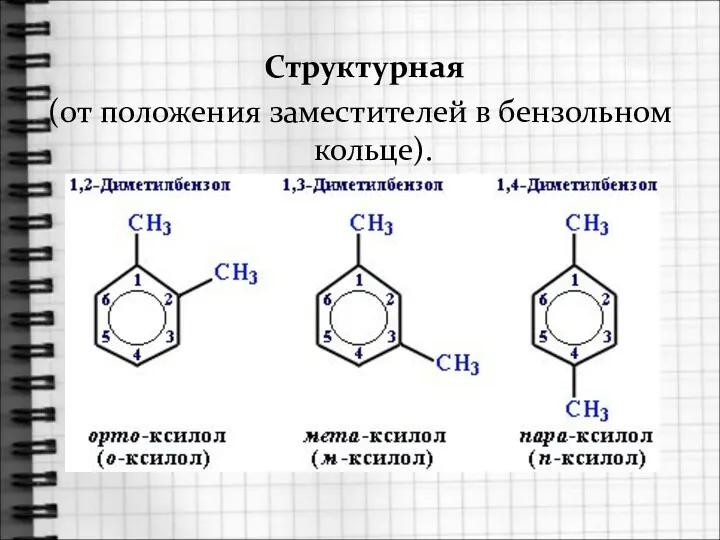
- 9. цц Структурная (от положения заместителей в бензольном кольце).
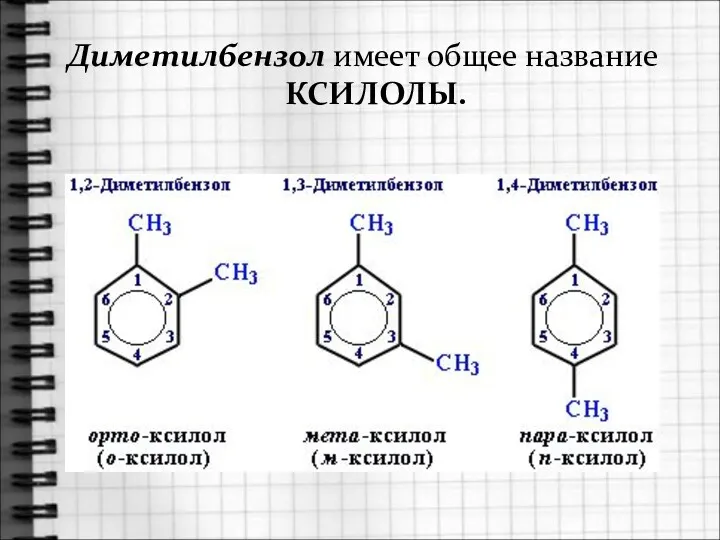
- 10. Диметилбензол имеет общее название КСИЛОЛЫ.
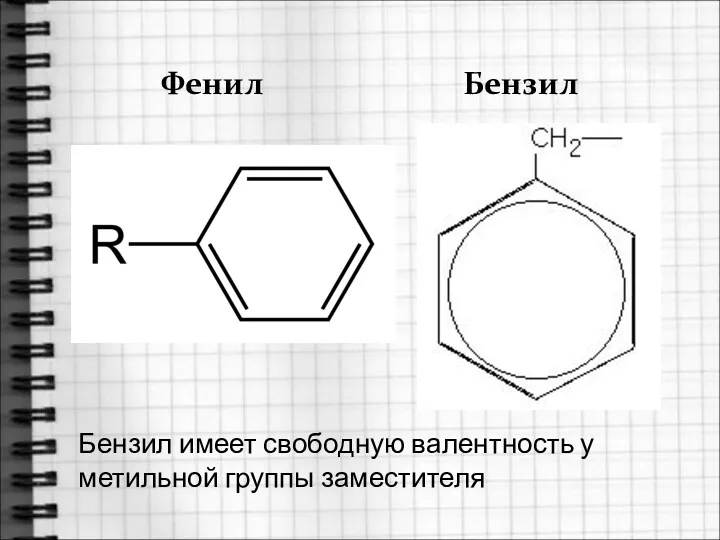
- 11. Фенил Бензил Бензил имеет свободную валентность у метильной группы заместителя
- 12. ФИЗИЧЕСКИЕ СВОЙСТВА
- 13. Физические свойства Бензол – легкокипящая (tплав = 5,5°С; tкип = 80°С), бесцветная жидкость с характерным запахом,
- 14. Физические свойства Ближайшие гомологи бензола также являются жидкостями, не растворимыми в воде. С увеличением молярной массы
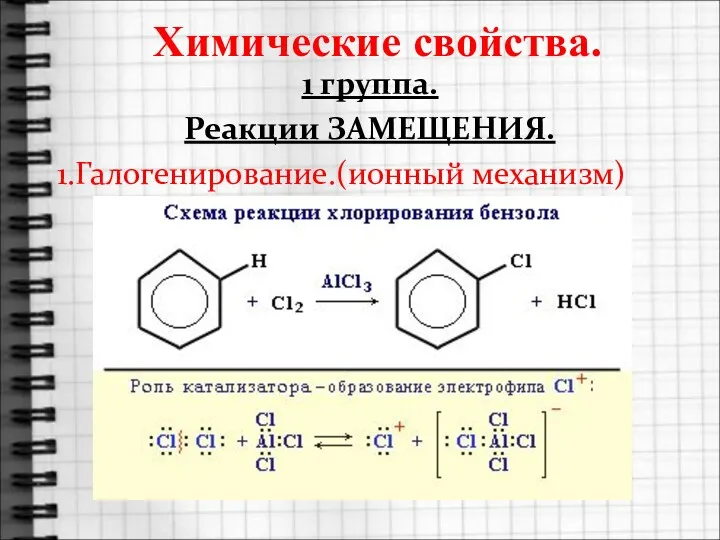
- 15. Химические свойства. 1 группа. Реакции ЗАМЕЩЕНИЯ. 1.Галогенирование.(ионный механизм)
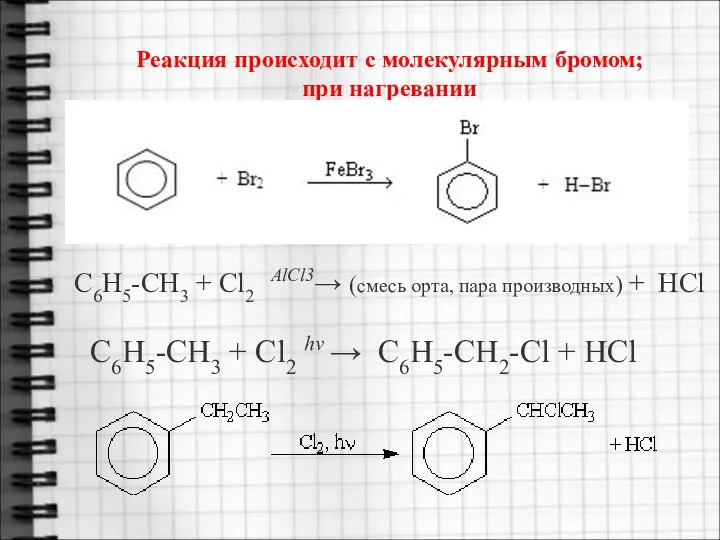
- 16. Реакция происходит с молекулярным бромом; при нагревании C6H5-CH3 + Cl2 hν → C6H5-CH2-Cl + HCl C6H5-CH3
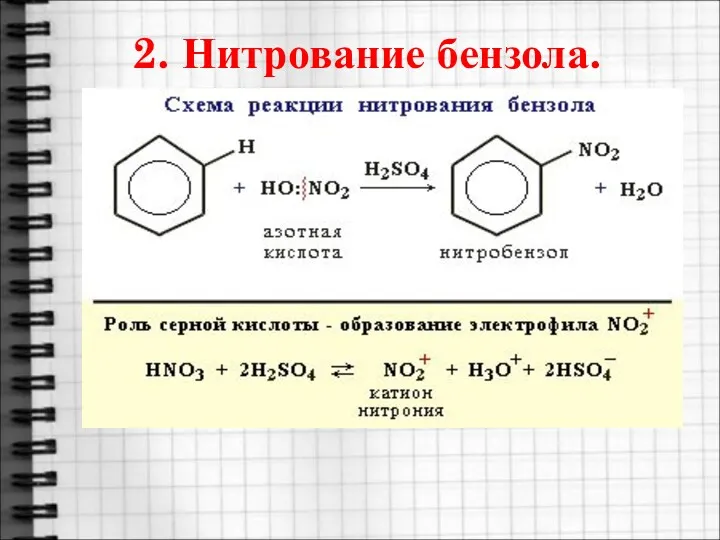
- 17. 2. Нитрование бензола.
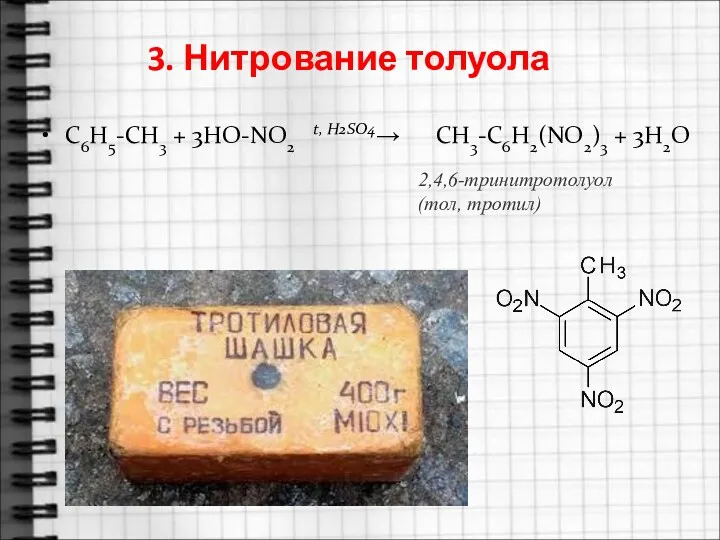
- 18. 3. Нитрование толуола C6H5-CH3 + 3HO-NO2 t, H2SO4→ СH3-C6H2(NO2)3 + 3H2O 2,4,6-тринитротолуол (тол, тротил)
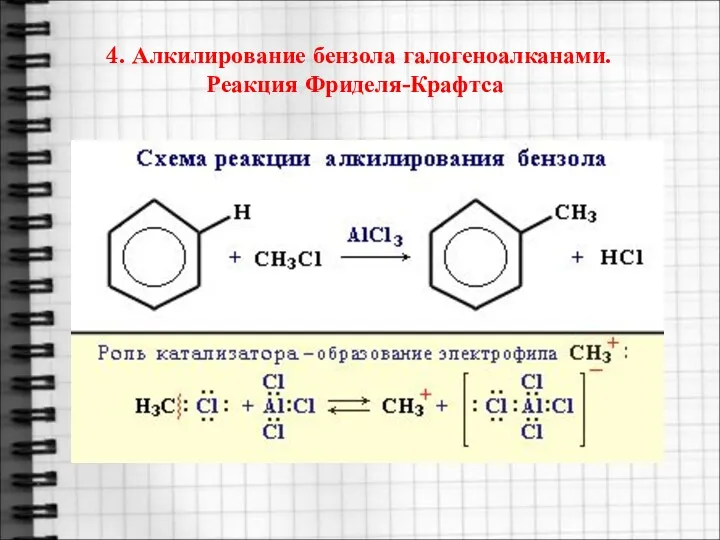
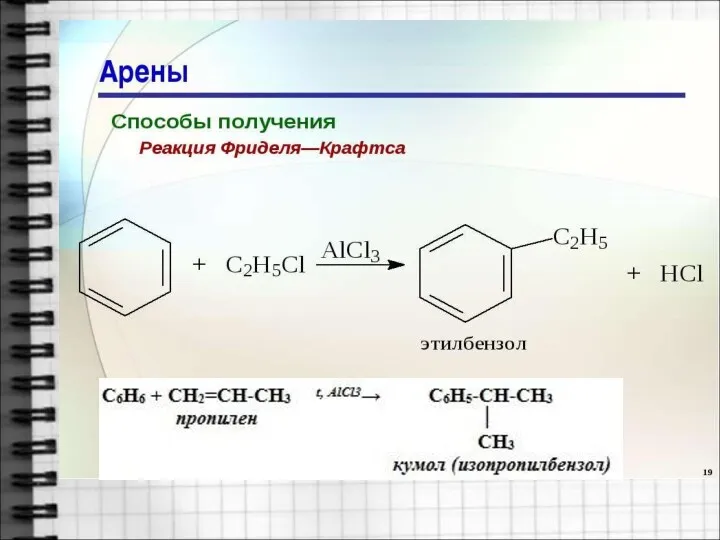
- 19. 4. Алкилирование бензола галогеноалканами. Реакция Фриделя-Крафтса
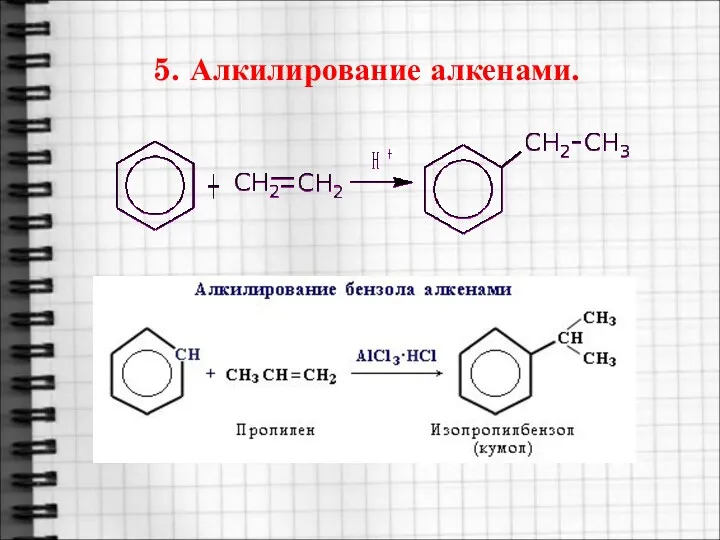
- 20. 5. Алкилирование алкенами.
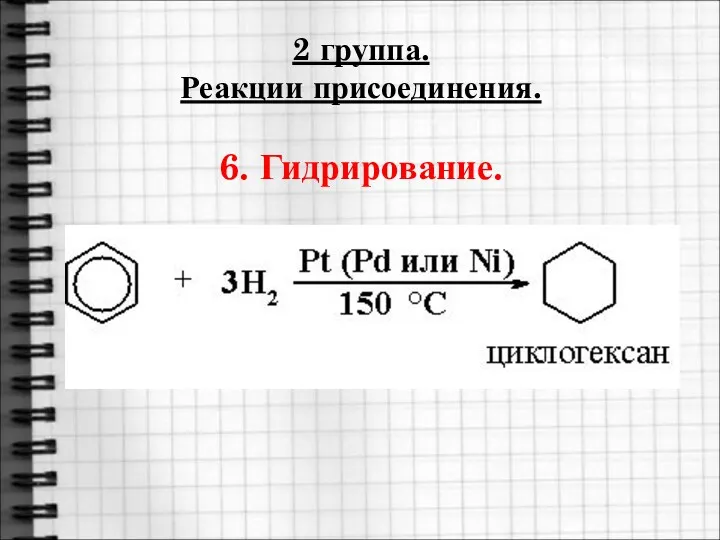
- 21. 2 группа. Реакции присоединения. 6. Гидрирование.
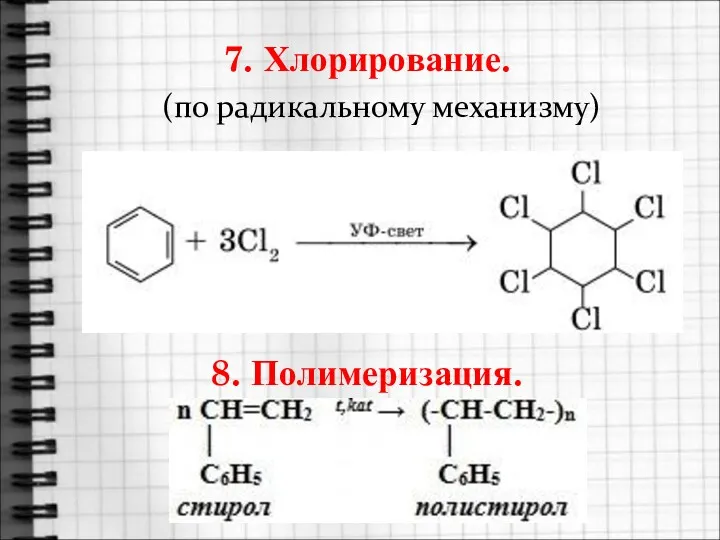
- 22. 7. Хлорирование. (по радикальному механизму) 8. Полимеризация.
- 23. 3 группа. Окисление. Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому
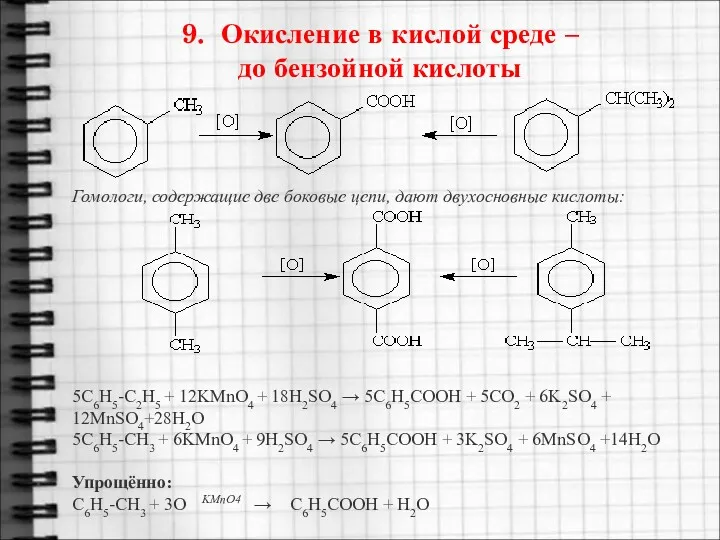
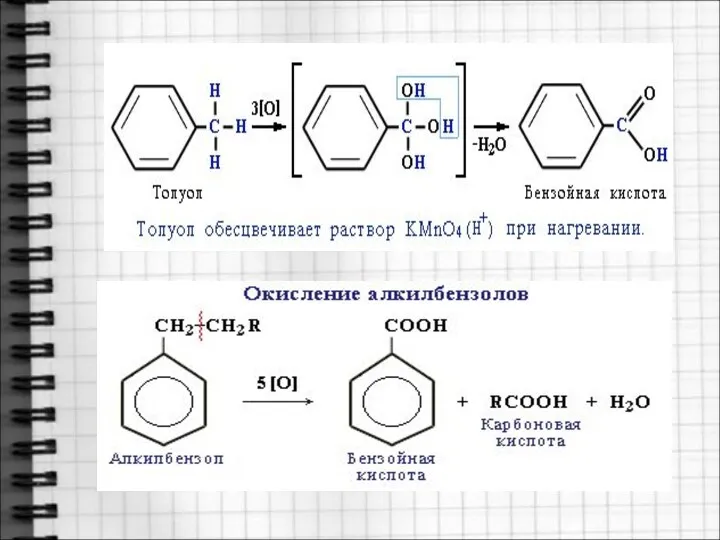
- 24. 9. Окисление в кислой среде – до бензойной кислоты Гомологи, содержащие две боковые цепи, дают двухосновные
- 26. 10. Окисление в нейтральной и слабощелочной среде Гомологи бензола могут быть окислены раствором перманганата калия в
- 27. 7. Горение (полное окисление). Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким
- 28. Получение аренов В лаборатории 1. Сплавление солей бензойной кислоты с твёрдыми щелочами C6H5-COONa + NaOH t
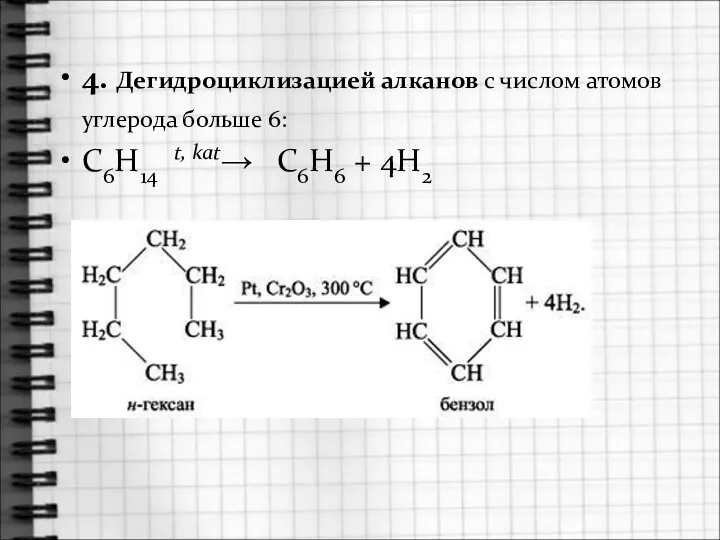
- 30. 4. Дегидроциклизацией алканов с числом атомов углерода больше 6: C6H14 t, kat→ C6H6 + 4H2
- 31. 5. Тримеризация ацетилена (только для бензола) – реакция Зелинского: 3 С2H2 600°C, акт. уголь → C6H6
- 32. Применение бензола и его гомологов. Бензол C6H6 – хороший растворитель. Бензол в качестве добавки улучшает качество
- 33. Применение бензола и его гомологов. Толуол C6H5–CH3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых
- 34. Применение бензола и его гомологов. Ксилолы C6H4(CH3)2. Технический ксилол – смесь трех изомеров (орто-, мета- и
- 35. Применение бензола и его гомологов. Изопропилбензол C6H5–CH(CH3)2 служит для получения фенола и ацетона.
- 36. Применение бензола и его гомологов. Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле
- 38. Скачать презентацию















 Аминокислоты 2
Аминокислоты 2 Магний. Нахождение в природе
Магний. Нахождение в природе Цветные металлы и сплавы
Цветные металлы и сплавы Концентрации растворов
Концентрации растворов Небезпечні хімічні речовини
Небезпечні хімічні речовини Медь и её соединения
Медь и её соединения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов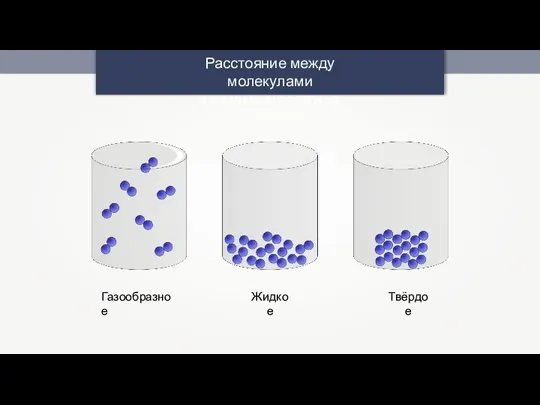 Расстояние между молекулами в разных агрегатных состояниях
Расстояние между молекулами в разных агрегатных состояниях Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Азотовмісні сполуки
Азотовмісні сполуки Кристаллография, кристаллохимия, минералогия
Кристаллография, кристаллохимия, минералогия Знаки химических элементов. Химические формулы. Химический диктант
Знаки химических элементов. Химические формулы. Химический диктант Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Изомерия и ее виды
Изомерия и ее виды Берилій
Берилій Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Алмазы. Бриллианты
Алмазы. Бриллианты Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность