Содержание
- 2. Гомеостаз – состояние относительного постоянства внутренней среды организма. Изогидрия – один из важнейших факторов гомеостаза живых
- 3. Теория С.Аррениуса (классическая) НС1 = Н+ + С1-, кислота – донор протона NaOH = OН- +
- 4. Теория Бренстеда-Лоури (протонная) НА = Н+ + А-, кислота – донор протона В + Н+ =
- 5. Электронная теория Льюиса Ограниченность протонной теории – не объясняет кислотно-основные свойства ряда веществ (BCl3, SiCl4 и
- 6. Вода слабый электролит 2Н2О ↔ Н3О+ + ОН- или Н2О + Н2О ↔ Н3О+ + ОН-
- 9. Виды кислотности Активная кислотность – концентрация свободных ионов Н+. Потенциальная (резервная) кислотность – концентрация ионов Н+,
- 10. Биохимические процессы протекают при определенном значении рН. рН биологических жидкостей: Сдвиг рН от нормы – наличие
- 11. Ацидоз – устойчивое нарушение рН ниже нормы (передозировка снотворного). Алкалоз – устойчивое нарушение рН выше нормы
- 12. Диссоциация кислот и оснований НА → Н+ + А- или НА + Н2О → Н3О+ +
- 17. Для 2-х кислотных оснований k1>>k2, тогда рН = 14 – 0,5рК1 + 0,5lgСосн kкисл и kосн
- 18. РЕЗЮМЕ: рН = -lgCK – для сильных кислот рН = 14 + lgCосн – для сильных
- 19. Гидролиз – реакция разложения водой. Гидролизу подвергаются белки, полисахариды, нуклеиновые кислоты, липиды, соли. При гидролизе солей
- 20. Соли образуются при взаимодействии кислот и оснований. Кислоты Основания сильные слабые сильные слабые
- 21. Четыре типа солей: 1. Образованные сильной кислотой и сильным основанием. В этом случае реакция нейтрализации идет
- 28. Для солей, образованных слабыми 2-х или многоосновными кислотами или солей многозарядных металлов, рассматривают только гидролиз по
- 30. Гидролиз обратимый процесс. Поэтому гидролиз можно уменьшить (ослабить) или усилить. Гидролиз по катиону ослабляется при действии
- 31. Соли, образованные очень слабыми кислотами и очень слабыми основаниями подвергаются необратимому гидролизу. При этом отдельные продукты
- 32. Гетерогенные равновесия
- 33. В организме человека есть костная система, находящаяся в твердом виде, и биологические жидкости, омывающие твердую фазу.
- 35. Суть правила произведения растворимости: «В насыщенном растворе труднорастворимого электролита произведение равновесных концентраций ионов, входящих в состав
- 36. В общем виде: АmBn ↔ mAn+ + nBm- ПР = Ks = [An+]m⋅[Bm-]n Например: Ag3PO4 ↔
- 37. Из правила произведения растворимости вытекает 2 следствия: 1) Условие образования осадка 2) Условие растворения осадка
- 38. Если С(Ag+)⋅C(Cl-) > ПР, то получается пересыщенный раствор и выпадает осадок, или ИП > ПР Если
- 39. Зная эти следствия, можно предвидеть образование и растворение осадка. Например: Если в моче концентрация ионов кальция
- 41. Скачать презентацию











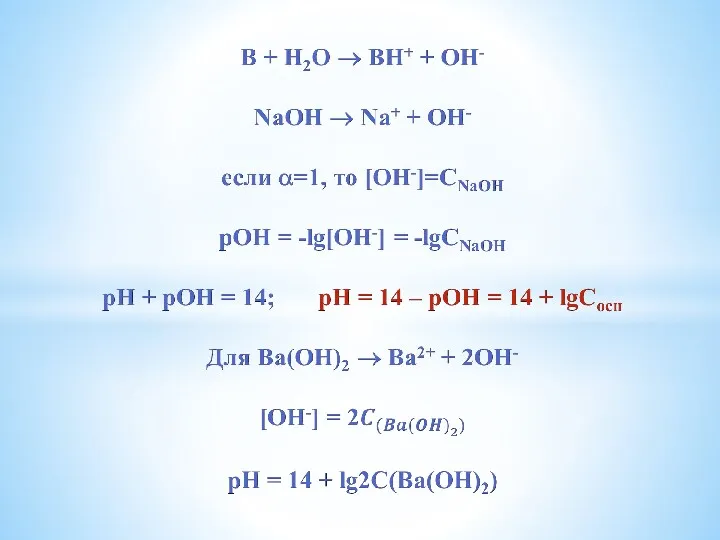











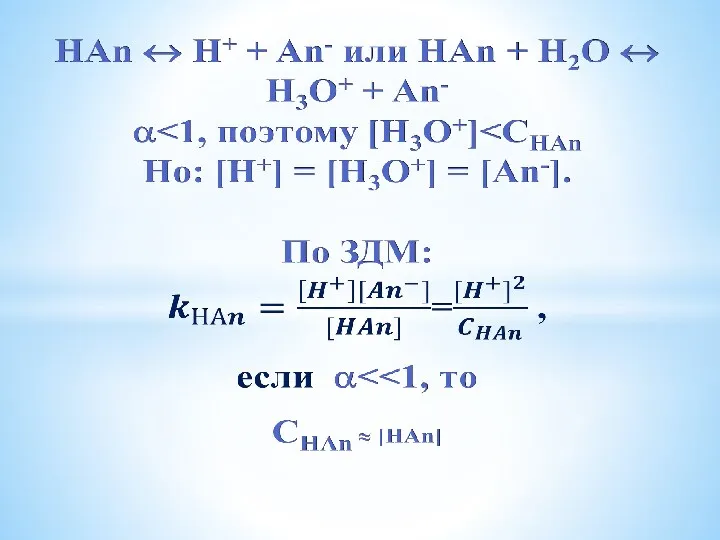














 Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Виды коррозии
Виды коррозии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Нуклеин қышқылдары
Нуклеин қышқылдары Ртуть. Использование ртути
Ртуть. Использование ртути Художественная обработка камня
Художественная обработка камня Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Кристаллическое состояние вещества
Кристаллическое состояние вещества Биохимия нуклеиновых кислот
Биохимия нуклеиновых кислот Химические чистящие средства
Химические чистящие средства Химические вещества как строительные и поделочные материалы
Химические вещества как строительные и поделочные материалы Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9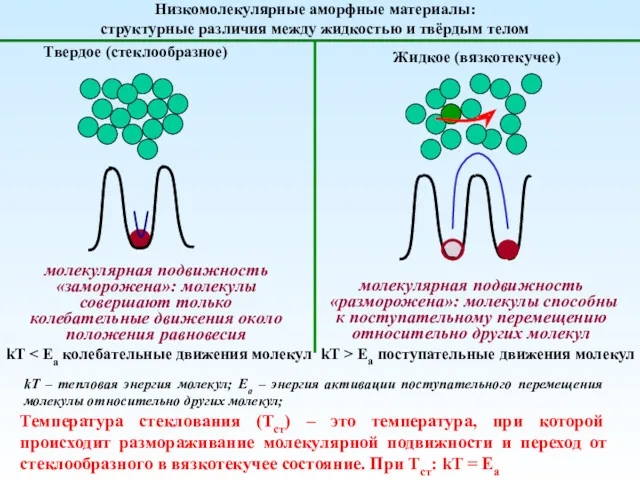 Механика полимеров
Механика полимеров Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Химические реакции. Условия необходимые для протекания химических реакций?
Химические реакции. Условия необходимые для протекания химических реакций? Петрография
Петрография Смоги и их влияние на человека
Смоги и их влияние на человека Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Качественные реакции на функциональные группы. Классификация функциональных групп
Качественные реакции на функциональные группы. Классификация функциональных групп Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Металлы. Общая характеристика
Металлы. Общая характеристика Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД)