Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4 презентация
Содержание
- 2. 1. Общая характеристика,гомологический ряд,номенклатура ,изомерия. Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну
- 3. Формулы ацетилена (этина)
- 4. Гомологический ряд Этин: C2H2 Пропин: C3H4 Бутин: C4H6 Пентин: C5H8 Гексин: C6H10 Гептин: C7H12 Октин: C8H14
- 5. Номенклатура Систематическая (международная) номенклатура: а) выбираем длинную цепочку с тройной связью; б) нумеруем цепочку с той
- 6. 2. Рациональная номенклатура: а) выбираем 2 центральных атома, соединённых тройной связью; б) отсекаем все связи, отходящие
- 7. Изомерия Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6)
- 8. 2. Методы синтеза алкенов. 1.Разложением водой карбида кальция СаС2,который получают спеканием негашеной извести СаО с коксом:
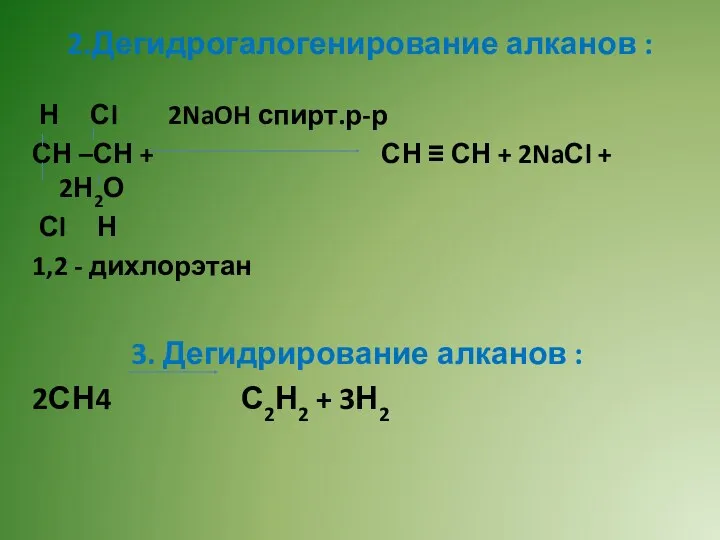
- 9. Н Сl 2NaOH спирт.р-р СН –СН + СН ≡ СН + 2NaСl + 2Н2О Сl Н
- 10. 3. Физические свойства алканов Ацетиленовые углеводороды, содержащие в молекуле от двух до четырех углеродных атомов (при
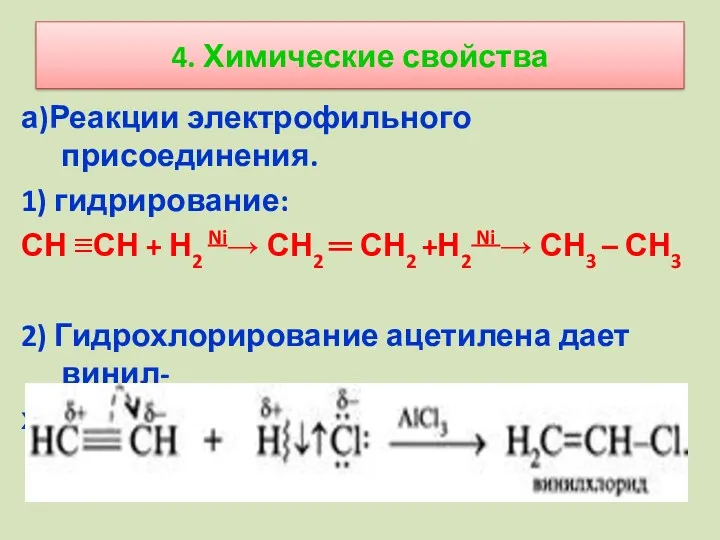
- 11. 4. Химические свойства а)Реакции электрофильного присоединения. 1) гидрирование: СН ≡СН + Н2 Ni→ СН2 ═ СН2
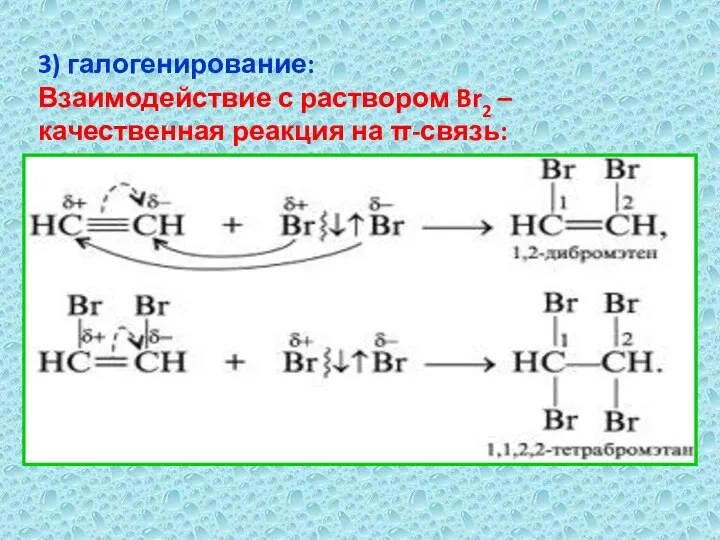
- 12. 3) галогенирование: Взаимодействие с раствором Br2 – качественная реакция на π-связь:
- 13. 4) Гидратация ацетилена по Кучерову (1881): Отличительной чертой алифатических ненасыщенных соединений, содержащих гидроксильную группу при двойной
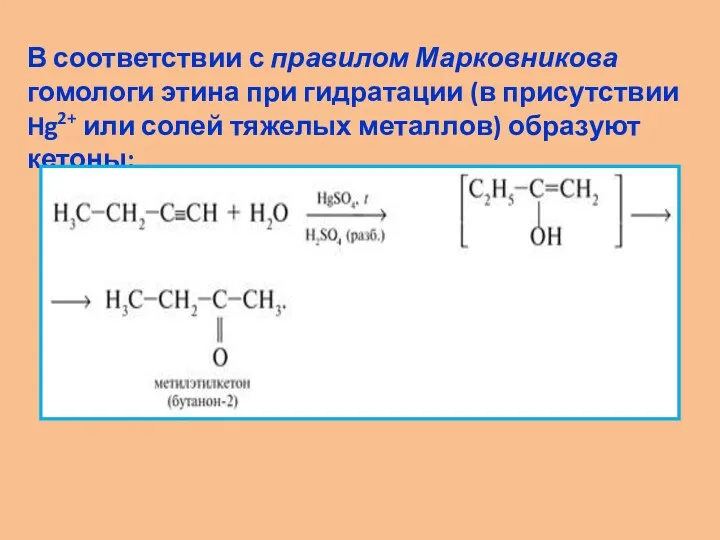
- 14. В соответствии с правилом Марковникова гомологи этина при гидратации (в присутствии Hg2+ или солей тяжелых металлов)
- 15. б). Реакции замещения Особенностью алкинов, явл. их способность отще- плять протон по действием сильных оснований, т.е.
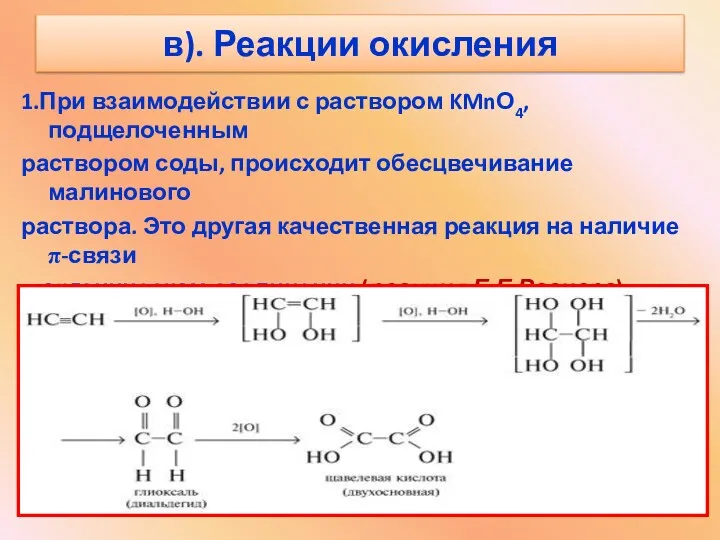
- 16. в). Реакции окисления 1.При взаимодействии с раствором KMnО4, подщелоченным раствором соды, происходит обесцвечивание малинового раствора. Это
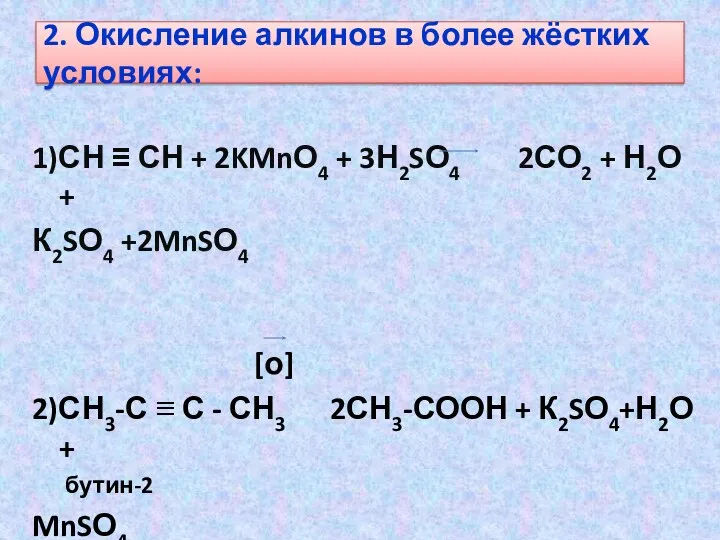
- 17. 2. Окисление алкинов в более жёстких условиях: 1)СН ≡ СН + 2KMnО4 + 3Н2SО4 2СО2 +
- 18. г). Реакции полимеризации Как и алкены, алкины вступают в реакцию полимеризации. Полимеризация этина и его гомо-
- 19. Вследствие более высокой электроотрицательности sp-гибридного атома С по сравнению с sp2-гибридным атомом С электронная плотность в
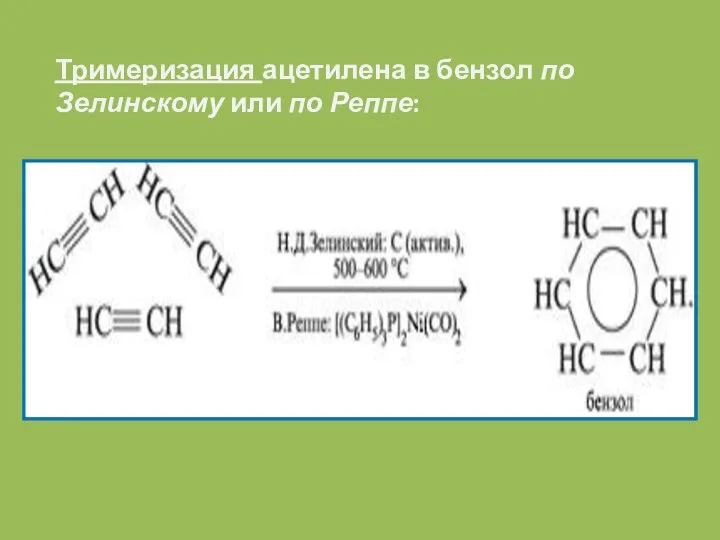
- 20. Тримеризация ацетилена в бензол по Зелинскому или по Реппе:
- 21. 5. Отдельные представители алкинов Наибольшее практическое значение имеют ацетилен H–C ≡ C–H и винилацетилен CH2= CH–C
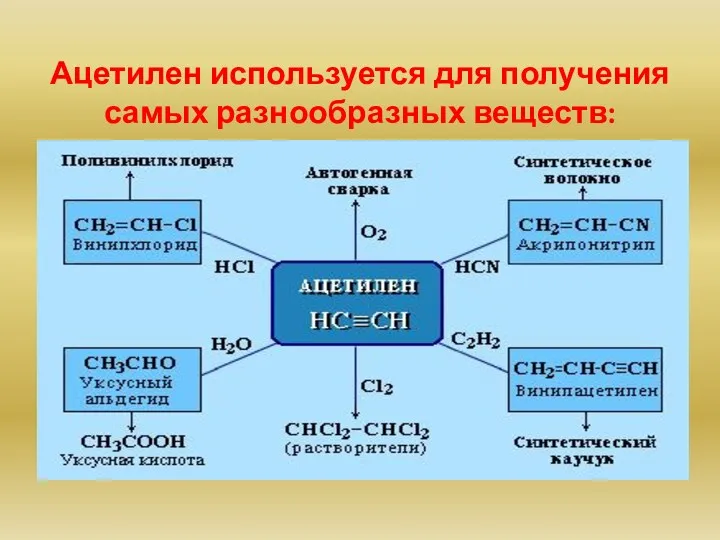
- 22. Ацетилен используется для получения самых разнообразных веществ:
- 24. Скачать презентацию













 Предельные одноатомные спирты
Предельные одноатомные спирты Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов
Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Химические реакции
Химические реакции Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Твердость минералов и их применение
Твердость минералов и их применение Строение атома
Строение атома Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Теорія горіння та вибуху
Теорія горіння та вибуху Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Адсорбция. Раздел III
Адсорбция. Раздел III Кислоты. Определение и классификация
Кислоты. Определение и классификация Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Благородные металлы
Благородные металлы Альдегиды и кетоны
Альдегиды и кетоны Классификация органических соединений
Классификация органических соединений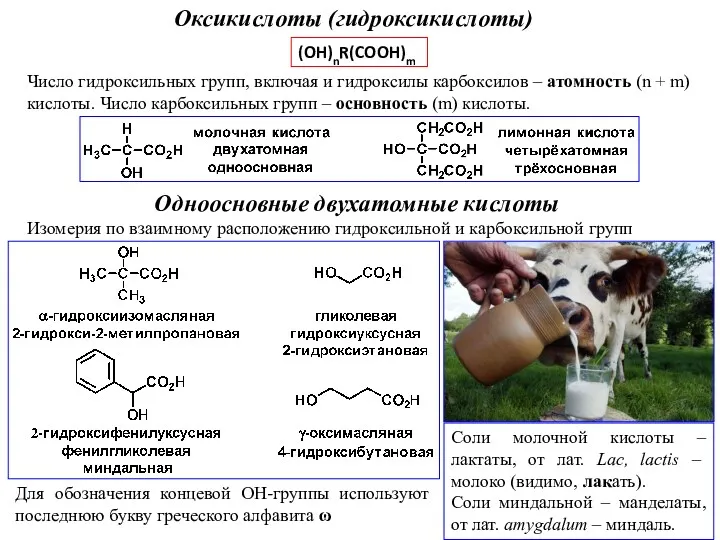 Оксикислоты (гидроксикислоты)
Оксикислоты (гидроксикислоты) Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Химиялық жарыс кеші
Химиялық жарыс кеші Химическая термодинамика
Химическая термодинамика Сложные эфиры. Жиры
Сложные эфиры. Жиры Дефекты в твердых телах
Дефекты в твердых телах Water
Water Элемент цинк
Элемент цинк