Содержание
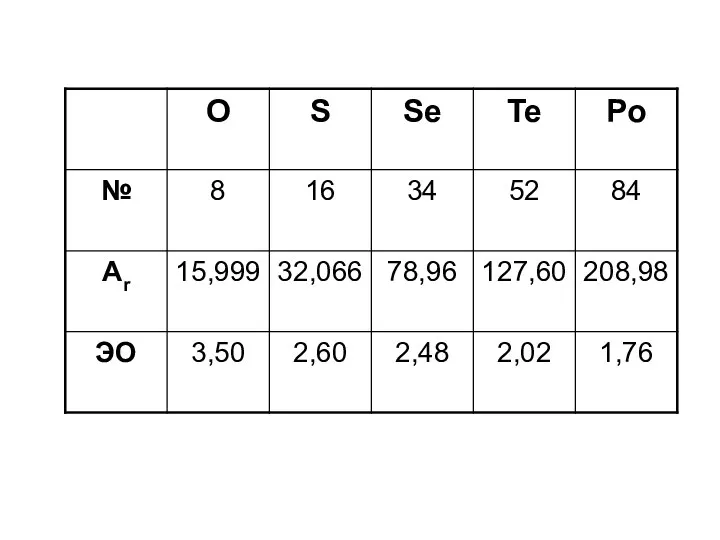
- 2. O Халькогены, т.е. S « рождающие руды». Se Te Po
- 3. Se и Te -минералов не образуют Ро - очень редкий радиоактивный элемент
- 5. Кислород
- 6. Кислород – самый распространенный элемент на Земле (49,5% масс.). Кислород существует в самородном виде (воздух) и
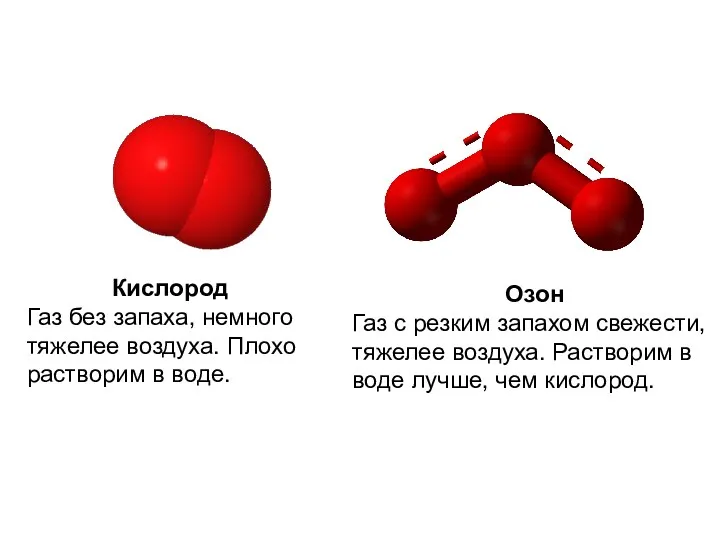
- 7. Аллотропные модификации кислорода
- 8. Озон Газ с резким запахом свежести, тяжелее воздуха. Растворим в воде лучше, чем кислород. Кислород Газ
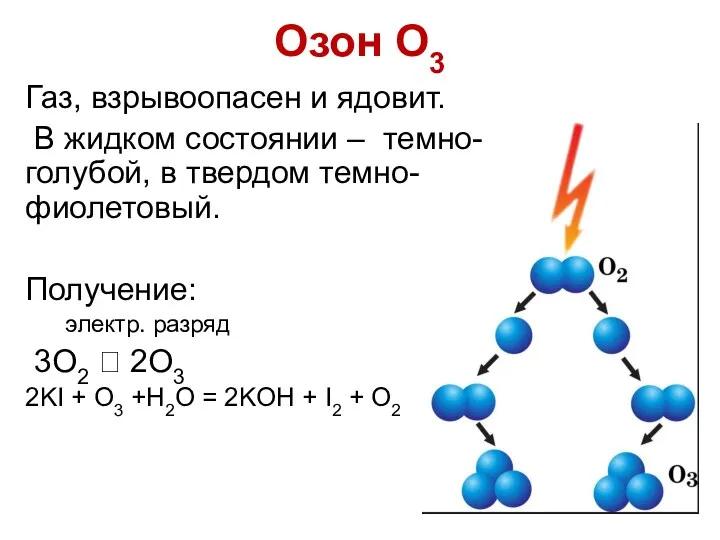
- 9. Газ, взрывоопасен и ядовит. В жидком состоянии – темно-голубой, в твердом темно-фиолетовый. Получение: электр. разряд 3O2
- 10. Получение кислорода 2KMnO4 = K2MnO4 + MnO2 + O2↑ 2H2O2 = 2H2O + O2↑ 2KClO3 =
- 11. Химические свойства кислорода: напрямую не взаимодействует с галогенами, благородными газами, золотом и платиновыми металлами.
- 12. Активно взаимодействует со щелочными металлами даже без нагревания. Металлы средней и низкой активности реагируют с кислородом
- 13. Реакция горения При взаимодействии металлов и неметаллов с кислородом зачастую происходит выделение большого количества тепла и
- 14. Взаимодействие кислорода с азотом происходит только при нагревании свыше 2000 °C или же при электрическом разряде.
- 15. Кислород довольно активно взаимодействует не только с простыми, но и со сложными веществами. CH4 + 2O2
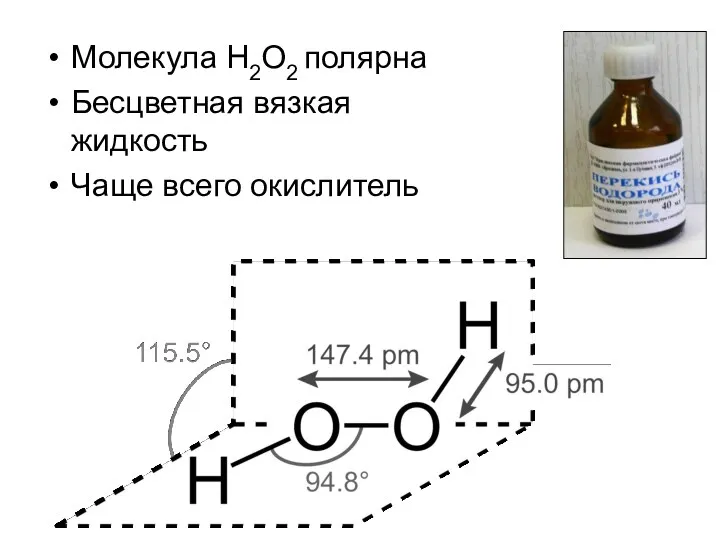
- 16. Пероксид водорода H2O2
- 17. Молекула H2O2 полярна Бесцветная вязкая жидкость Чаще всего окислитель
- 18. В разбавленных растворах пероксид водорода неустойчив и диспропорционирует: 2H2O2–1 = 2H2O–2 + O20↑
- 19. Сера
- 20. Сера- химический элемент Сера - химический элемент ΙΙΙ( малого) периода,3 ряда, VΙ(А) группы Атомный номер 16
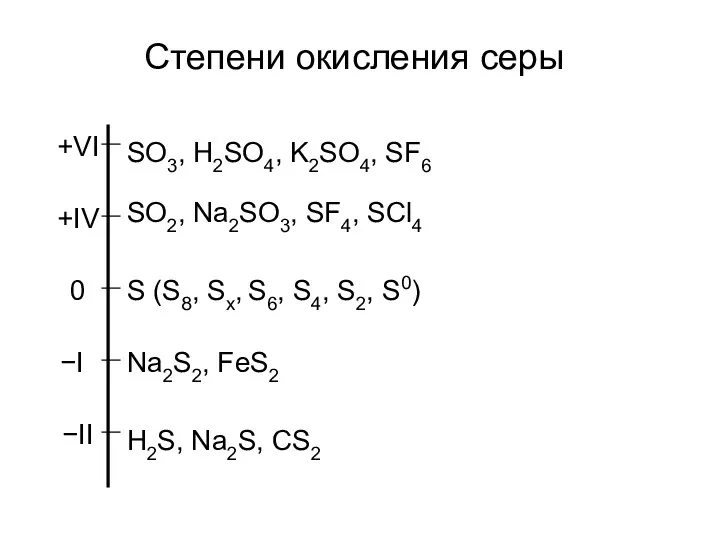
- 21. Степени окисления серы SO3, H2SO4, K2SO4, SF6 SO2, Na2SO3, SF4, SCl4 Na2S2, FeS2 H2S, Na2S, CS2
- 22. Самородная сера
- 23. Самородная сера Фумаролы
- 24. FeS2 PbS As2S3 HgS
- 25. Пирит Марказит Пирротин
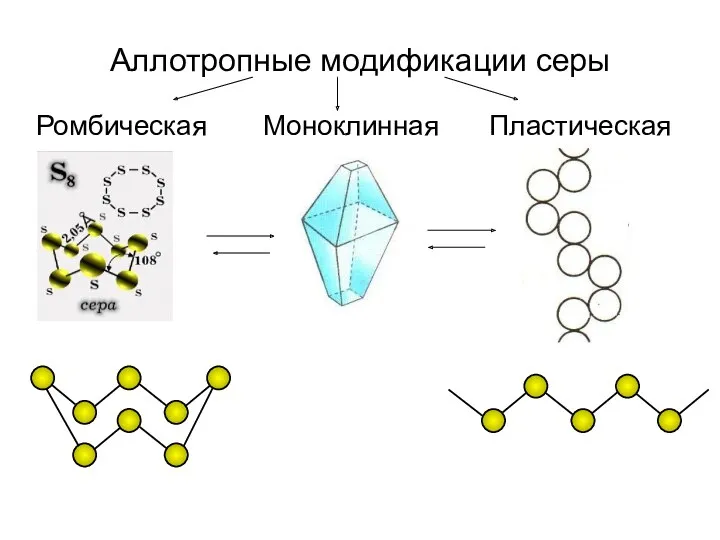
- 27. Аллотропные модификации серы
- 28. — твердое агрегатное состояние — желтого цвета — не растворима в воде — не смачивается водой
- 29. Аллотропные модификации серы Ромбическая Моноклинная Пластическая
- 30. Обычная ромбическая сера состоит из циклических молекул S8. Ромбическая сера полупрозрачная, лимонно-жёлтая, температура плавления: 112,8 ˚С.
- 31. Пластическая сера Резиноподобное вещество коричневого цвета.
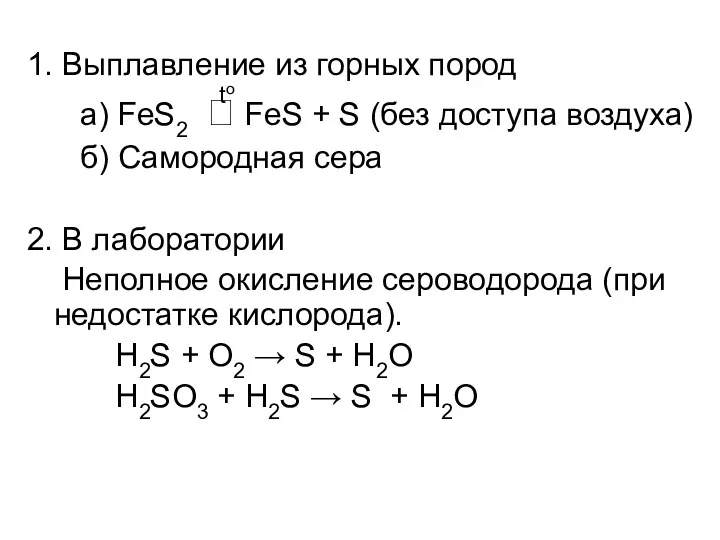
- 32. Получение серы
- 33. 1. Выплавление из горных пород а) FeS2 ⮀ FeS + S (без доступа воздуха) б) Самородная
- 34. Химические свойства серы
- 35. Mg + S = MgS 2Al + 3S = Al2S3 При нагревании взаимодействует со многими металлами,
- 36. S + O2 = SO2 не SO3! Из неметаллов с серой не реагируют только азот, йод
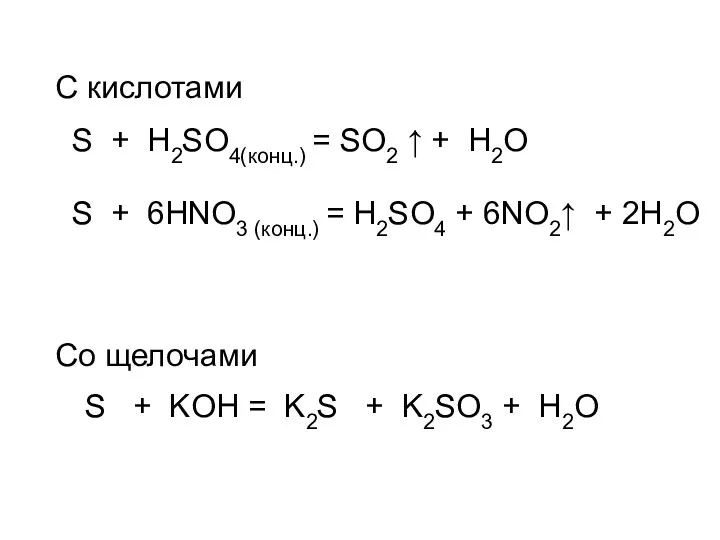
- 37. C кислотами S + H2SO4(конц.) = SO2 ↑ + H2O S + 6HNO3 (конц.) = H2SO4
- 38. Применение серы
- 39. Сероводород Бесцветный газ с неприятным запахом Ядовит Растворим в воде Слабая двухосновная кислота
- 40. 1) H2 + S ⮀ H2S 2) Вытеснение сероводорода из сульфидов сильными кислотами 2HCl + FeS
- 41. Химические свойства !! Только восстановитель 2H2S + O2 (недост) → 2S + 2H2O 2H2S + 3O2(изб)
- 42. SO2 Бесцветный газ с резким запахом Ядовит Тяжелее воздуха Хорошо растворим в воде
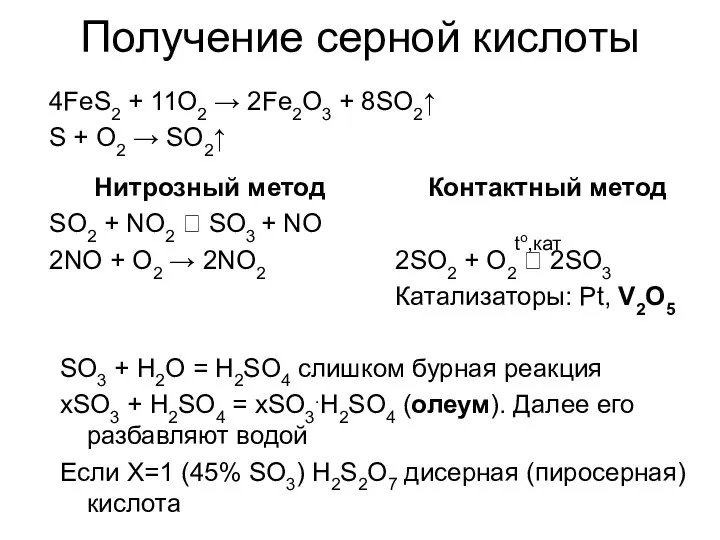
- 43. Получение 1. В промышленности: обжиг сульфидов 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 2. В лаборатории:
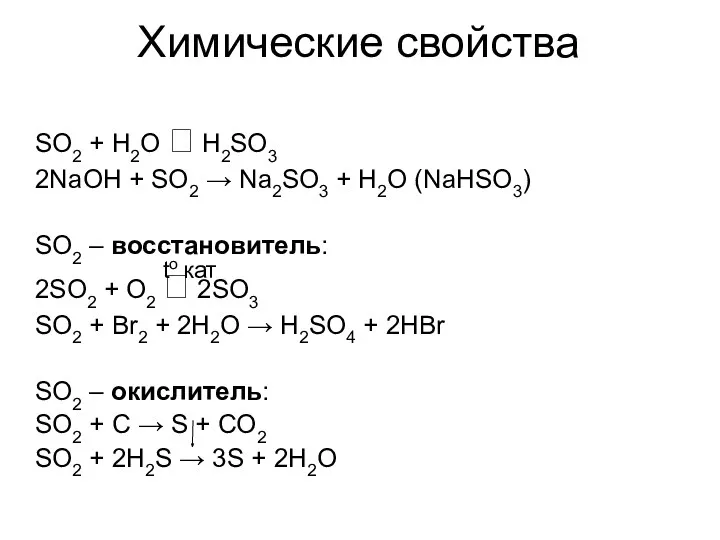
- 44. Химические свойства SO2 + H2O ⮀ H2SO3 2NaOH + SO2 → Na2SO3 + H2O (NaHSO3) SO2
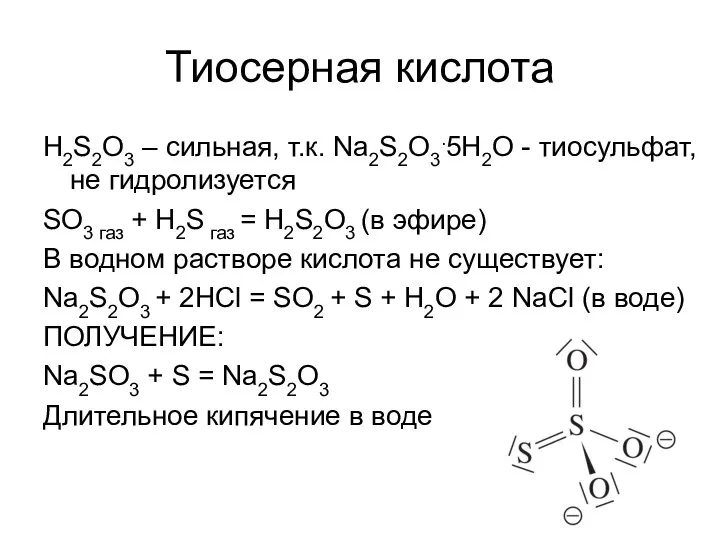
- 45. Тиосерная кислота H2S2O3 – сильная, т.к. Na2S2O3.5H2O - тиосульфат, не гидролизуется SO3 газ + H2S газ
- 46. Тиосульфаты Мягкий восстановитель S2O32- + 4Cl2 изб +5H2O = 2SO42- + 8Cl- +10H+ S2O32- + Br2
- 47. SO3 Бесцветная жидкость При температуре белая кристаллическая масса Гигроскопичен
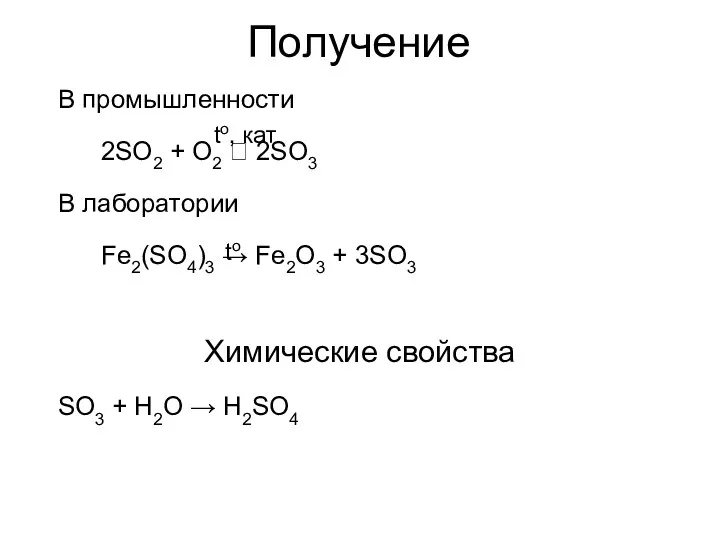
- 48. Получение В промышленности 2SO2 + O2 ⮀ 2SO3 В лаборатории Fe2(SO4)3 → Fe2O3 + 3SO3 to,
- 49. Контактный метод 2SO2 + O2 ⮀ 2SO3 Катализаторы: Pt, V2O5 to,кат 4FeS2 + 11O2 → 2Fe2O3
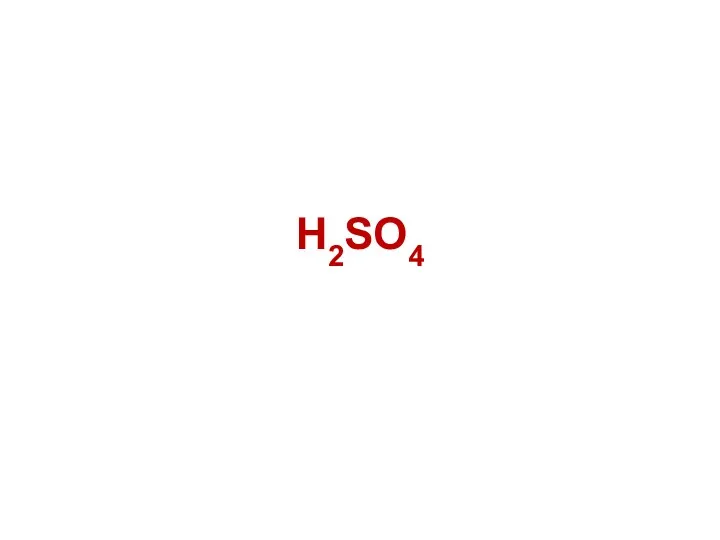
- 50. H2SO4
- 51. Соли серной кислоты
- 52. Серная кислота в природе Кислотное озеро на глубине вулкана Малый Семячик Кипящее озеро (Курильские острова) Европа
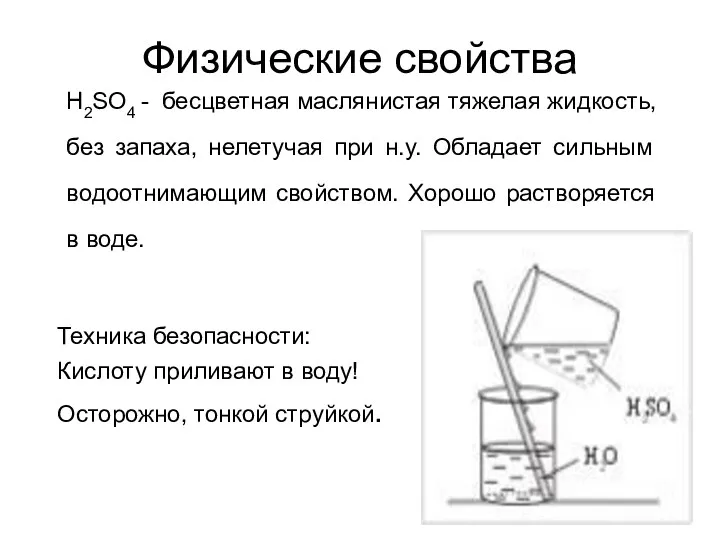
- 53. Физические свойства H2SO4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим
- 54. Химические свойства разбавленной H2SO4 1. Взаимодействие с металлами (стоящими до Н2 в РНМ) Zn + H2SO4
- 55. 2. Взаимодействие с основными и амфотерными оксидами H2SO4 + CuO = CuSO4 + H2O 3. Взаимодействие
- 56. 4. Взаимодействие с солями (ионный обмен) H2SO4 + BaCl2 = BaSO4↓+ 2HCl Качественная реакция – выпадение
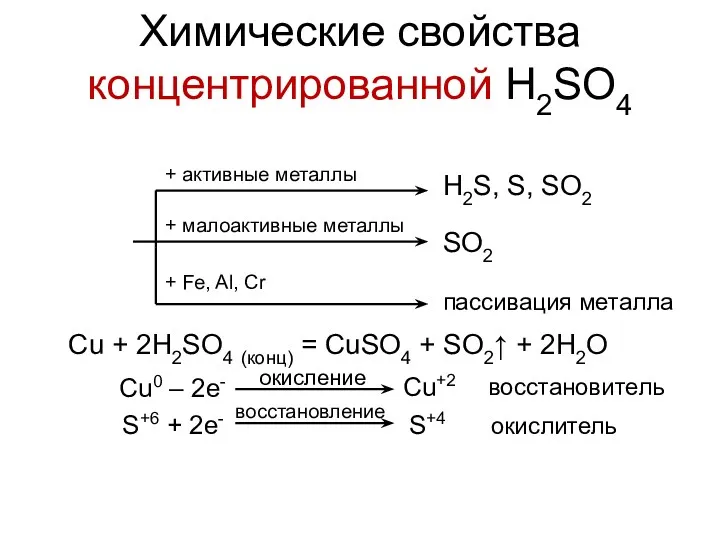
- 57. + активные металлы + малоактивные металлы + Fe, Al, Cr H2S, S, SO2 SO2 пассивация металла
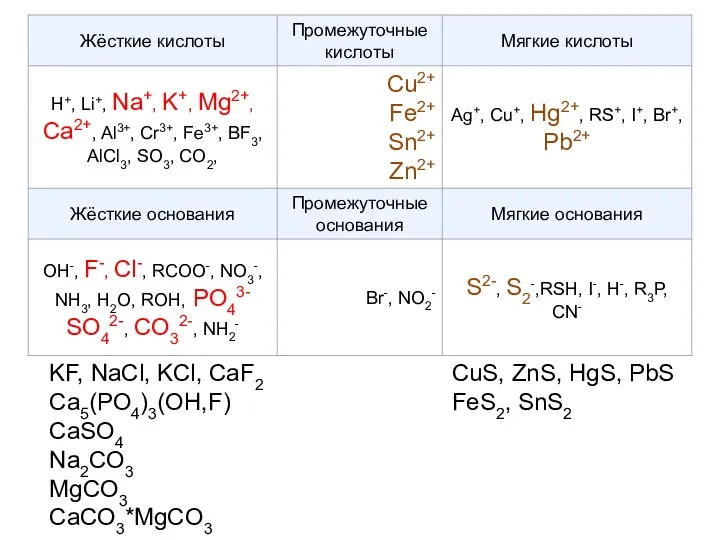
- 58. Почему образуются именно такие сульфидные минералы – принцип жёстких и мягких кислот и оснований Пирсона
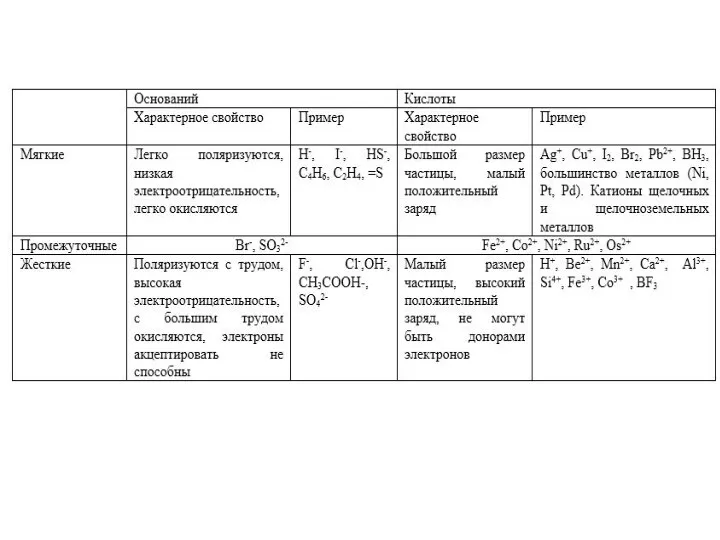
- 59. ЖМКО Пирсона Жёсткие кислоты —акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и
- 61. KF, NaCl, KCl, CaF2 Ca5(PO4)3(OH,F) CaSO4 Na2CO3 MgCO3 CaCO3*MgCO3 CuS, ZnS, HgS, PbS FeS2, SnS2
- 62. Задачи Определите степени окисления серы в соединениях : SO2, H2S, SO3, CaS, Na2SO4, NaHS, KHSO4, MgSO4,
- 63. 1. Распределение электронов по энергетическим уровням в атоме серы: А. 2, 6. В. 2, 8, 6.
- 64. 3. Свойство, характерное для серы: А. Хорошо растворима в воде. Б. Имеет металлический блеск. В. Твердое
- 66. Скачать презентацию














































 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Crystal defects
Crystal defects Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Аммиак. Состав вещества
Аммиак. Состав вещества Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Введение в химию
Введение в химию Обмен нуклеотидов
Обмен нуклеотидов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Возраст в геологии
Возраст в геологии Соединения щелочных металлов
Соединения щелочных металлов Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Гетерофункциональные производные бензольного ряда как лекарственные средства
Гетерофункциональные производные бензольного ряда как лекарственные средства Кислородные соединения азота
Кислородные соединения азота Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Предельные углеводороды
Предельные углеводороды Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Массообменные процессы
Массообменные процессы Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Аномальные свойства воды
Аномальные свойства воды Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Моющие и чистящие средства
Моющие и чистящие средства