Содержание
- 2. План Решение задач на определение массовой и объемной доли вещества для смесей и растворов. Нахождение массы,
- 3. Основные законы и закономерности Mr =M (г/моль) Число структурных единиц N= NA∙ ν; ν (моль) Постоянная
- 4. (1) W= m в-ва m р-ра = m в-ва m р-ля +m в-ва m р-ля -
- 5. Молярная концентрация С = ʋ(в-ва) Vр-ра ʋ(вещ-ва) – количество растворенного вещества Vр-ра – объем раствора, л
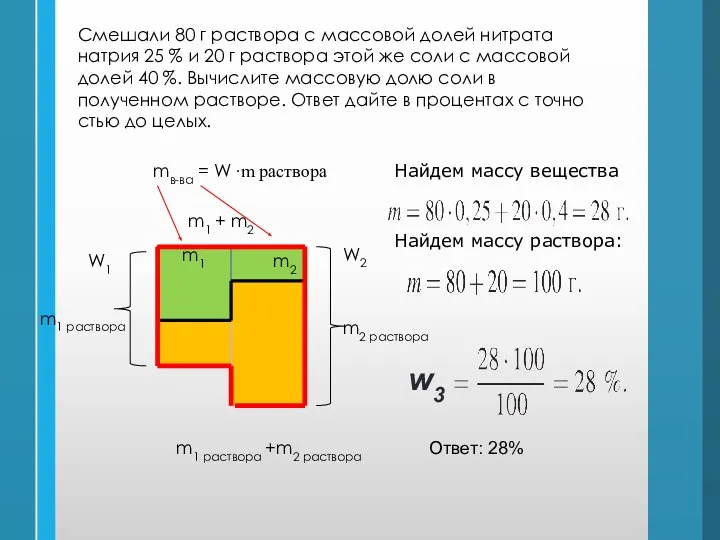
- 6. m1 m2 m1 + m2 m1 раствора m2 раствора W1 W2 mв-ва = W ∙m раствора
- 7. Вычислите массу нитрата калия (в граммах), который следует растворить в 150 г раствора с массовой долей
- 8. Упариванием 500 г раствора с массовой долей соли 10 % получен раствор с массовой долей соли
- 9. К 250 г 10%-ного раствора нитрата натрия добавили 10 г этой же соли и 50 мл
- 10. К 250 г 20 %-ной серной кислоты добавили 50 мл 60 %-ной кислоты (плотностью 1,6 г/мл).
- 11. Вычисления по уравнениям химических реакций хА + уВ = аС ν(А) : ν( ν(В) = х
- 12. В процессе химической реакции не образуется осадок или газ ЕСЛИ В ПРОЦЕССЕ ХИМИЧЕСКОЙ РЕАКЦИИ НЕ ОБРАЗУЕТСЯ
- 13. 1. Оксид фосфора(V)массой 21,3 г растворили в 400 г горячей воды. Вычислите массовую долю ортофосфорной кислоты
- 14. 3) Вычислите массу раствора серной кислоты с массовой долей 61,25 %, в котором надо растворить 40
- 15. Самостоятельно Оксид бария массой 382,5 г растворили в 400г воды. Вычислите массовую долю гидроксида бария в
- 16. При растворении серы в концентрированной серной кислоте образовался газ объёмом 26,88 л (в пересчёте на н.
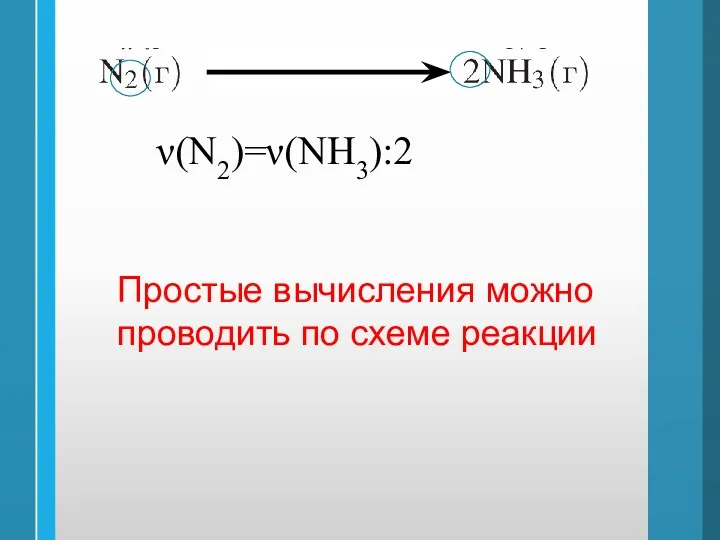
- 17. Вычислите объём азота (при н. у.), который необходимо взять для получения 17 г аммиака при условии
- 18. ν(N2)=ν(NH3):2 Простые вычисления можно проводить по схеме реакции
- 19. Вычислите массу серного колчедана, необходимого для получения 100%-й серной кислоты массой 1кг. 4FeS2 + 11O2 =
- 20. Вычислите объём азота (н. у.), образующегося при полном сгорании 20 л аммиака в избытке кислорода. Ответ
- 21. Рассчитайте, какой объём азота (н.у.) образуется при полном сгорании 67,2 л (н.у.) аммиака. (Запишите число с
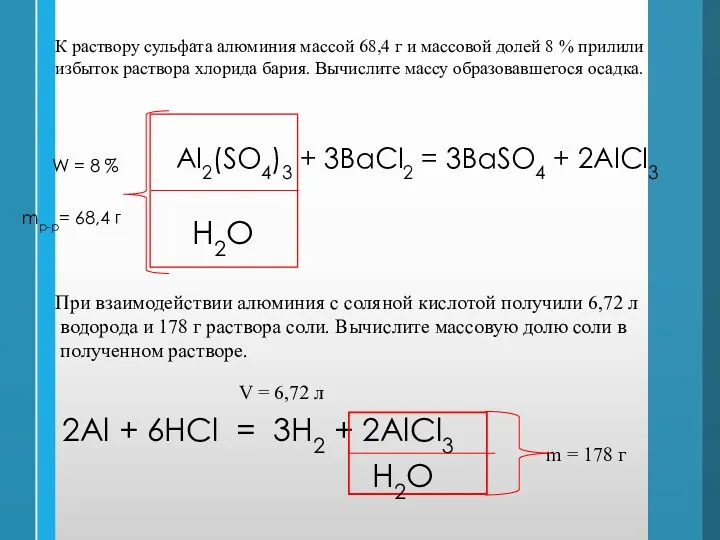
- 22. К раствору сульфата алюминия массой 68,4 г и массовой долей 8 % прилили избыток раствора хлорида
- 23. Смесь сульфита кальция и карбоната кальция общей массой 60,0 г обработали избытком соляной кислоты. Выделившийся газ
- 24. Вычисление массы/объема/количества вещества продуктов реакции, если одно из реагирующих веществ в избытке В условиях задач данного
- 25. Вещество взятое в избытке не реагирует с продуктом реакции Определите массу нитрата магния, образовавшегося при взаимодействии
- 26. Смешали 9 г алюминия и 9 г серы смесь нагрели. Вычислите массу сульфида алюминия Какой объём
- 27. Продукты реакции могут взаимодействовать с избытком реагента
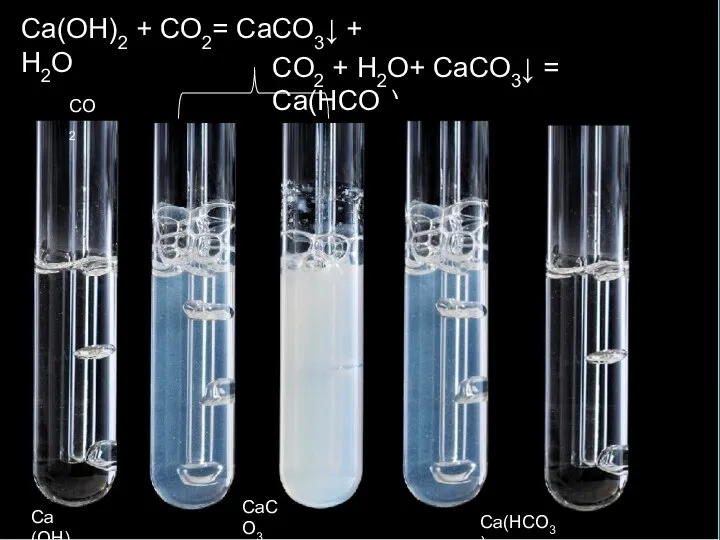
- 28. Са(OH)2 + CO2= CaCO3↓ + H2O CO2 + H2O+ CaCO3↓ = Ca(HCO3)2 Са(OH)2 CO2 CaCO3 Ca(HCO3)2
- 29. раствор Газ, Газ, выделившийся при полном разложении 135 г карбоната кальция СаСО3 = СаО + СО2
- 30. Какой объем раствора гидроксида калия (ρ = 1,18 г/мл) с массовой долей щелочи 20% израсходуется на
- 31. Выход реакции по продукту η = mпр / mтеор = Vпр/Vтеор = νпр /νтеор
- 32. Определите массу меди, вступившей в реакцию с концентрированной серной кислотой для получения 3 л оксида серы(IV)
- 33. Определите массу серной кислоты, которую можно получить из тонны пирита, если выход реакции обжига составляет 90%,
- 34. 1. Определение состава смеси, все компоненты которой взаимодействуют с указанными реагентами При растворении в соляной кислоте
- 35. 1. Способ – составление алгебраического уравнения Для решения массу/объем одного компонента обозначают х, а массу/объем второго
- 36. m = х г V-? 2Al + 6 HCl = 2 AlCl3 + 3 H2 ν(Al)
- 37. V(H2) =(х/18) ∙22,4 +((11-х) / 56) ∙22,4 = 8,96 (х/18) +((11-х) / 56) = 8,96/22,4 =0,4
- 38. 2 Способ. Составление системы уравнений Для решения количество вещества одного компонента обозначают х, а количество вещества
- 39. ν = х моль V-? 2Al + 6 HCl = 2 AlCl3 + 3 H2 ν(H2)
- 40. Определение состава смеси, не все компоненты которой взаимодействуют с указанными реагентами
- 41. Вычислите массу железа, меди и алюминия в смеси, если при действии на смесь массой 13 г
- 42. Из трех металлов (железо, медь и алюминий) с кислотой реагируют алюминий и железо ν(Al) =0,2 моль
- 43. ν= 0,1 моль Fe + 2HCl = FeCl2 + H2 ν(Fe) = 0,1моль m(Fe)= ν∙М =
- 44. При растворении в серной кислоте 10 г сплава цинка с магнием выделяется 5,75 л водорода (н.у.)
- 45. При сгорании органического вещества массой 7,2 г образовались углекислый газ массой 9,9 г и вода массой
- 46. Вывод формул По массовым долям элементов По молярной массе вещества По данным о продуктах сгорания или
- 47. Установление молекулярной формулы газообразного вещества по продуктам сгорания
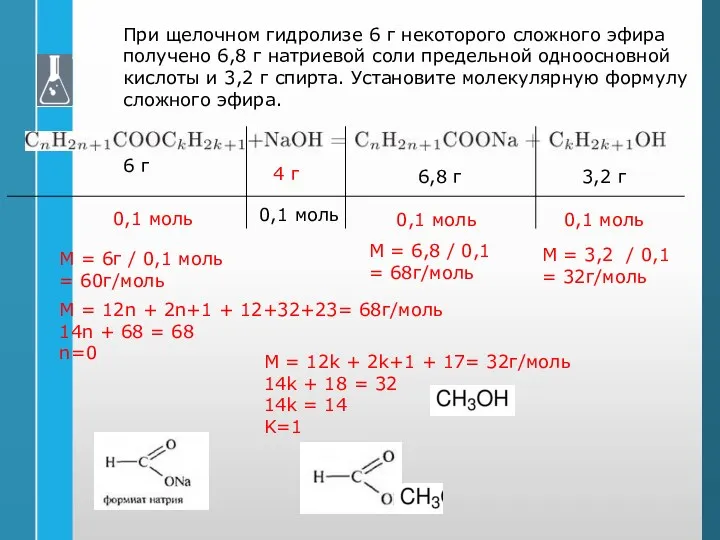
- 48. При щелочном гидролизе 6 г некоторого сложного эфира получено 6,8 г натриевой соли предельной одноосновной кислоты
- 49. Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4
- 50. При полном сгорании органического вещества массой 25,9 г образовалось 23,52 л (при н. у.) углекислого газа
- 51. Анализ условия позволяет выбрать путь решения Массовые доли железа, кислорода и водорода в гидроксиде железа равны
- 52. Вычислим количество вещества атомов железа, кислорода и водорода: ν(Fe)= 62,22г/ 56г/моль = 1,11моль ν(O) = 35,56г
- 53. Найти формулу углеводорода, в котором содержится 14,29 % водорода, а его Найдём молярную массу СхНу :
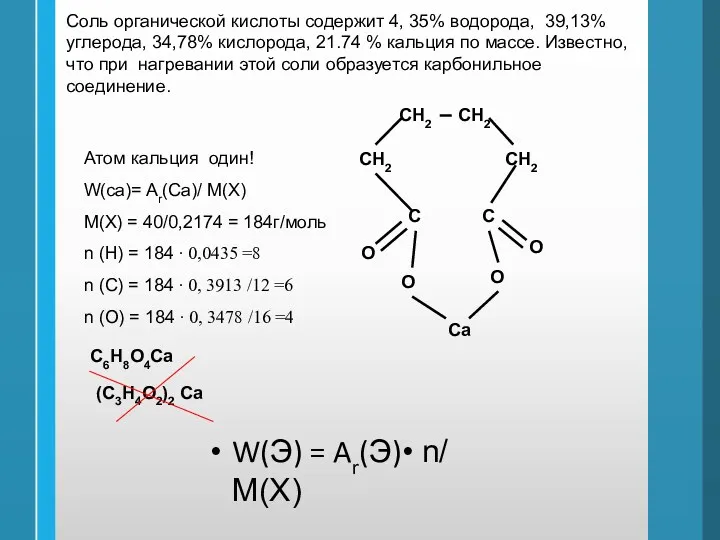
- 54. Соль органической кислоты содержит 4, 35% водорода, 39,13% углерода, 34,78% кислорода, 21.74 % кальция по массе.
- 55. 1. Еремин В.В., Кузьменко Н.Е., Теренин В.И., Дроздов А.А., Лунин В.В. Химия. 10 класс. Углубленный уровень.
- 57. Скачать презентацию








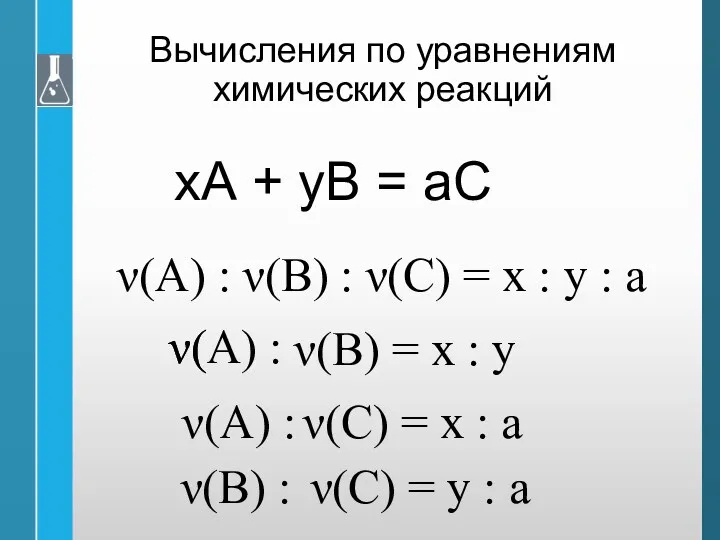





















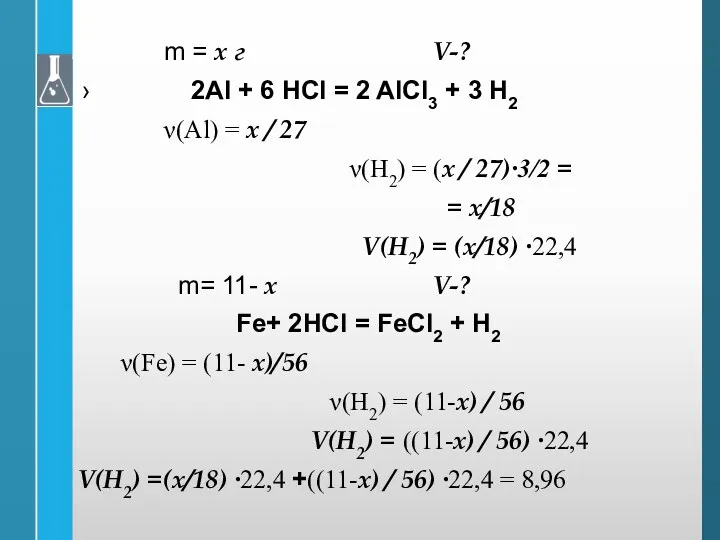

















 Сахар - вред или польза?
Сахар - вред или польза? Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Иониты и цеолиты. Цеолитные катализаторы
Иониты и цеолиты. Цеолитные катализаторы Термическая переработка газов, нефтяных фракций и остатков нефтепереработки
Термическая переработка газов, нефтяных фракций и остатков нефтепереработки Кислотные дожди
Кислотные дожди Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Неметаллы. 11 класс
Неметаллы. 11 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Химический процесс. Практические занятия
Химический процесс. Практические занятия Сабын
Сабын Каталитический риформинг
Каталитический риформинг Применение серной кислоты
Применение серной кислоты Решение задач по теме Растворы
Решение задач по теме Растворы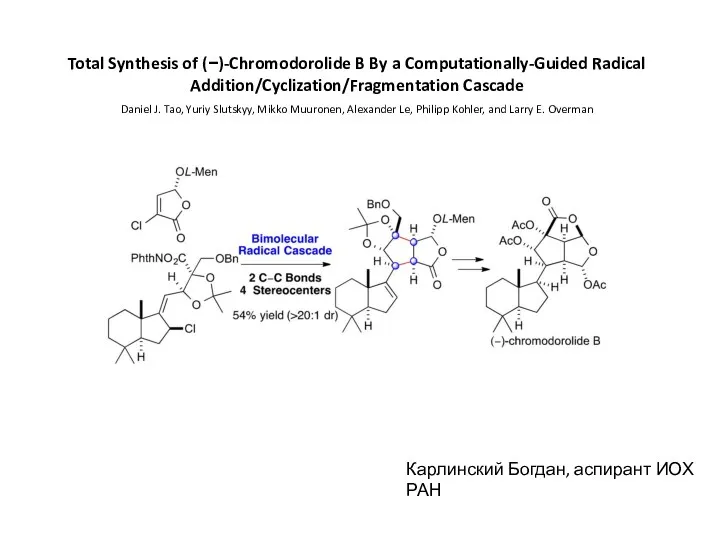 Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical
Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical Гидролиз солей
Гидролиз солей Химические и физические свойства воды
Химические и физические свойства воды Пряности глазами химика
Пряности глазами химика Introduction to Biochemistry
Introduction to Biochemistry Роль химии в современной цивилизации
Роль химии в современной цивилизации Пневмовакуум-формование
Пневмовакуум-формование Массовая доля вещества в растворе
Массовая доля вещества в растворе Азот
Азот Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Химическое вещество
Химическое вещество Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз