Содержание
- 2. Редокс -процессы (ОВР) и равновесия; редокс- потенциалы, его биологическая роль Окислительно-восстановительный процесс /или редокс- процесс (ОВП)
- 3. окисленная форма (окислитель /Ox, сопряженный восстановитель) является акцептором электронов и восстанавливается, принимая электроны. восстановленная форма (восстановитель
- 4. Сопряженная окислительно-восстановительная пара Любая ОВР является совокупностью двух сопряженных процессов – полуреакций: окисления восстановителя и восстановления
- 5. Например: Типы редокс- системы 1/ Если между окисленной и восстановленной формами осуществляется только перенос электронов, то
- 6. Примеры окислителей и восстановителей Окислители и восстановители: S и др. неметаллы, SO2,KNO2,HCl,H2O2
- 7. Классификация ОВР ОВР разделяют на 4-е группы или типы: 1. Внутримолекулярные. Реакция внутримолекулярного окисления-восстановления, в которой
- 8. 3. Реакции диспропорционирования. При реакциях диспропорцирования (перераспределения) атомы одного и того же элемента проявляют окислительные и
- 9. Составление уравнений окислительно-восстановительных реакций Существует два основных способа составления уравнений окислительно-восстановительных реакций: метод электронного баланса и
- 10. В целом: Баланс атомов O2 в ОВР, протекающих в различных средах:
- 11. Эквивалент Эквивалент окислителя – реальная или условная частица его, которая в процессе восстановления принимает 1ē. Эквивалент
- 13. Факторы, влияющие на протекание ОВР Концентрации реагента Температуры реакции (при нагревании и охлаждении ) Наличие катализатора
- 14. Для организма перманганаты ядовиты Для обезвреживания острых отравлений перманганатом KMnO4 используют восстановитель - 3% раствор пероксида
- 15. Редокс -потенциал Таким образом, редокс-потенциал можно рассматривать как частный случай электродного потенциала, возникающего на межфазной границе,
- 16. Уравнение Нернста-Петерса Для расчета редокс-потенциала (единица измерения — вольт (В)) окислительно-восстановительной реакции используют уравнение Нернста:
- 17. -значения стандартных рдокс-потенциалов являются справочными; -измеряются относительно потенциала редокс-системы 2Н+/Н2, значение стандартного потенциала которой принято равным
- 18. Направление самопроизвольного протекания ОВР Согласно второму закону термодинамики, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением свободной
- 20. Глубина протекания ОВР Чем больше стандартный потенциал реакции (φо), тем выше ее константа равновесия (Кр) и
- 21. В общем виде схему сложного окислительно-восстановительного электрода можно записать следующим образом восстановление окисление Потенциал такого электрода
- 28. Гальванический элемент
- 29. Этот элемент состоит из медной пластинки, погруженной в раствор сульфата меди и цинковой пластинки, погруженной в
- 30. – электрод, на котором протекает процесс окисления. Катионы металла переходят в раствор, масса анода уменьшается. Анод
- 31. – электрод, на котором протекает процесс восстановления катионов металла из раствора, масса катода увеличивается. Катод заряжается
- 32. Условная запись гальванического элемента В схеме гальванического элемента согласно правилам ИЮПАК (Международный союз теоретической и прикладной
- 34. 1 2 3 4 5
- 38. Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов- это последовательность, в которой металлы расположены
- 39. Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами
- 40. - Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют
- 41. Электролиз – это окислительно-восстановительный процесс, протекающий на электродах в растворах или расплавах электролитов при пропускании электрического
- 42. Сущность электролиза заключается в том, что за счет электрической энергии осуществляется химическая реакция, которая не может
- 43. Законы Фарадея
- 44. Второй закон Фарадея (формула без эквивалента)
- 46. • В расплавах катионы металла восстанавливаются до свободного металла: Мn+ + nē = М0 На катоде
- 47. Электролиз в расплавах На аноде происходит процесс окисления • В расплавах анионы бескислородных кислот (кроме фторидов)
- 48. Электролиз расплава NaCl К(-) NaCl А(+) ↓ ← Na+ + Cl- → Na+ + 1ē =
- 49. К(-) CuCl2 А(+) ↓ ← Cu2+ + 2Cl- → Cu2+ + 2ē = Cu0 2Cl- -
- 50. Электролиз расплава NaOH К(-) NaOH А(+) ↓ ← Na+ + OH- → Na+ + 1ē =
- 51. Электролиз в растворах 1)процесс на катоде В растворах процесс на катоде не зависит от материала катода,
- 52. Электролиз в растворах (процесс на катоде) б) Если металл расположен в ряду напряжений между Al и
- 53. Процесс на аноде В растворах процесс на аноде зависит от материала анода и от природы аниона.
- 54. Процесс на аноде б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление
- 55. Электролиз раствора NaCl на инертном аноде К(-) NaCl А(+) ↓ ← Na+ + Cl- → 2Н2О
- 56. Электролиз раствора CuSO4 на инертном аноде К(-) CuSO4 А(+) ↓ ← Cu2+ + SO42- → Cu2+
- 57. Электролиз раствора NaCl на растворимом аноде К(-) NaCl А(+) ↓ (Cu) ← Na+ + Cl- →
- 58. Вещества, образующиеся при электролизе некоторых электролитов В целом
- 59. Коррозией называется процесс разрушения металлов вследствие химического или электрохимического взаимодействия их с внешней средой. Химическая коррозия
- 61. Скачать презентацию
 Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Генетическая взаимосвязь между основными классами неорганических соединений
Генетическая взаимосвязь между основными классами неорганических соединений фосфор
фосфор Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Свойства НЦ
Свойства НЦ Химическая технология. Введение
Химическая технология. Введение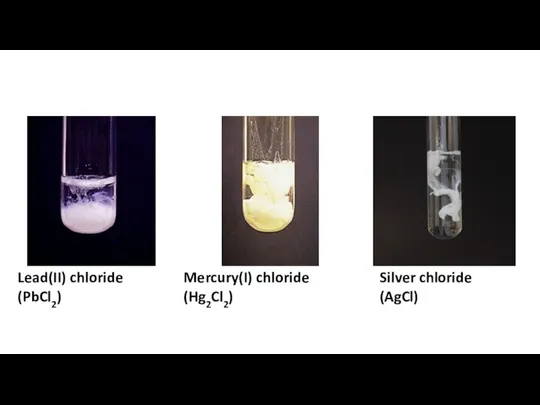 Separation amp confirmation
Separation amp confirmation Електеу дегеніміз
Електеу дегеніміз Генетическая связь между классами веществ
Генетическая связь между классами веществ Природные источники углеводородов. 10 класс
Природные источники углеводородов. 10 класс Обмен липидов. Классификация липидов
Обмен липидов. Классификация липидов Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1)
Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1) Общая характеристика и классификация топлива
Общая характеристика и классификация топлива Тест: полимеры
Тест: полимеры Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Химия элементов IVA группы
Химия элементов IVA группы Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Теория электролитической диссоциации. Водородный показатель
Теория электролитической диссоциации. Водородный показатель Элементы теории горения
Элементы теории горения Властивості і застосування каучуків. (Урок 15)
Властивості і застосування каучуків. (Урок 15) Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Хімія у побуті
Хімія у побуті Металлы побочных подгрупп
Металлы побочных подгрупп Вуглецеві наноматеріали (наноматеріали із карбону). Алотропні модифікації карбону. Алмаз. Карбін. Графен
Вуглецеві наноматеріали (наноматеріали із карбону). Алотропні модифікації карбону. Алмаз. Карбін. Графен Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева