Содержание
- 2. Содержание Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации
- 3. Классификация углеводов Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по
- 4. Углеводы Моносахариды пентозы – рибоза C5H10O5, дезоксирибоза C5H10O4, гексозы – C6H12O6 глюкоза, фруктоза. Дисахариды Сахароза, мальтоза
- 5. Моносахариды Углеводы имеют общую формулу Cn(H2O)m. Моносахариды являются гетерофункциональными соединениями. В их молекулах одновременно содержатся и
- 6. Нахождение в природе В свободном виде глюкоза содержится почти во всех органах зеленых растений. Особенно её
- 7. Изомерия Наиболее часто встречаются два моносахарида: глюкоза и фруктоза. Они являются изомерами и имеют молекулярну формулу
- 8. Получение В свободном виде в природе встречается преимущественно глюкоза. Она же является структурной единицей многих полисахаридов.
- 9. Впервые глюкоза получена в 1811 году русским химиком Г.Э.Кирхгофом при гидролизе крахмала. Позже синтез моносахаридов из
- 10. В промышленности глюкозу получают гидролизом крахмала в присутствии серной кислоты. H2SO4,t° (C6H10O5)n + nH2O → nC6H12O6
- 11. Физические свойства Моносахариды – твердые вещества, легко растворимые в воде, плохо – в спирте и совсем
- 12. Химические свойства Моносахариды проявляют свойства спиртов и карбонильных соединений. Вещества, проявляющие характерные свойства двух различных классов
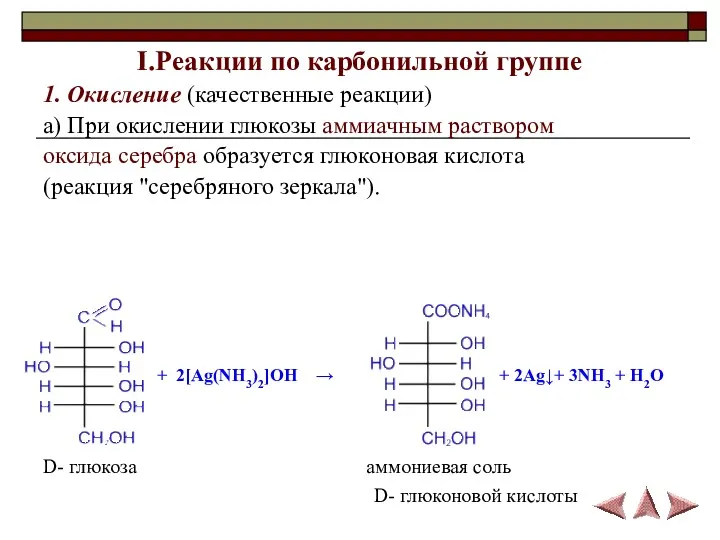
- 13. I.Реакции по карбонильной группе 1. Окисление (качественные реакции) а) При окислении глюкозы аммиачным раствором оксида серебра
- 14. б) Реакция глюкозы с гидроксидом меди при нагревании так же приводит к образованию глюконовой кислоты. O
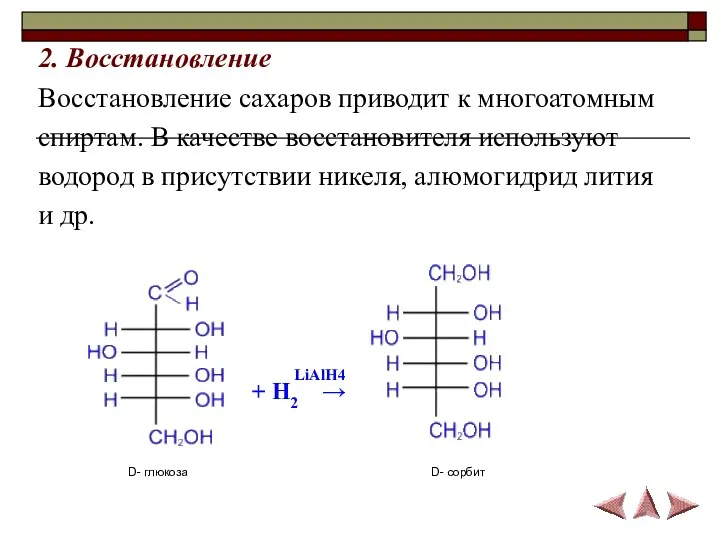
- 15. 2. Восстановление Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии никеля,
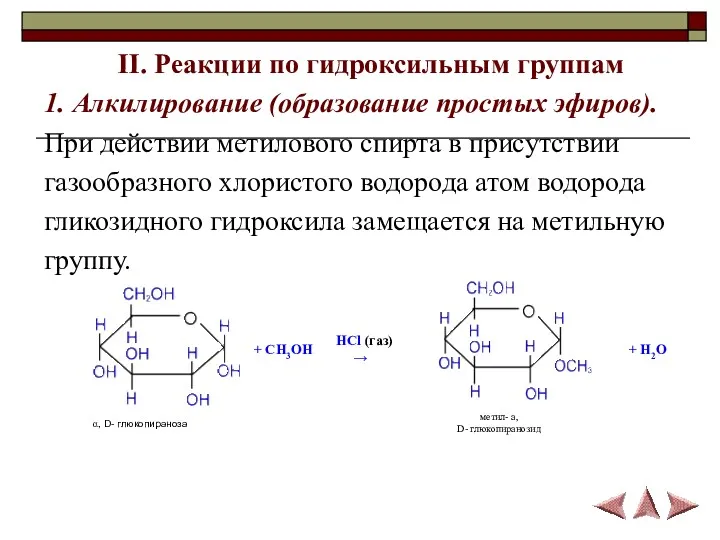
- 16. II. Реакции по гидроксильным группам 1. Алкилирование (образование простых эфиров). При действии метилового спирта в присутствии
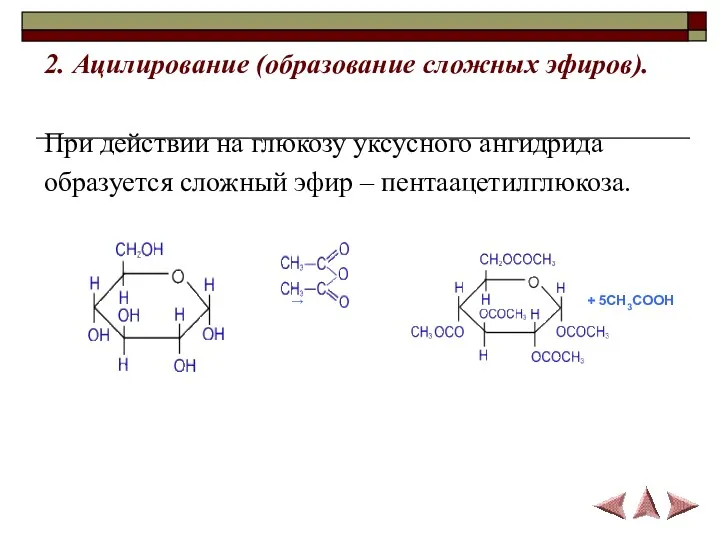
- 17. 2. Ацилирование (образование сложных эфиров). При действии на глюкозу уксусного ангидрида образуется сложный эфир – пентаацетилглюкоза.
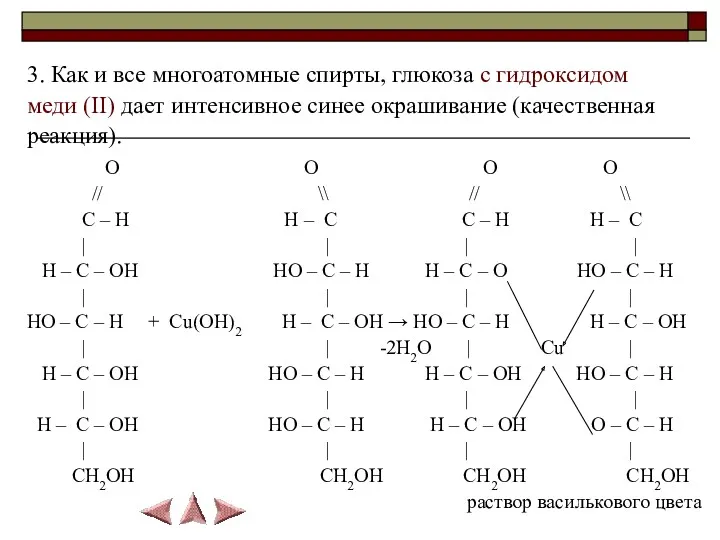
- 18. 3. Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная
- 19. III. Специфические реакции Глюкоза характеризуется и некоторыми специфическими свойствами – процессами брожения. Брожением называется расщепление молекул
- 20. б) молочнокислое брожение молочно-кислые бактерии C6H12O6 → 2 CH3 – CH – COOH | OH молочная
- 21. г) маслянокислое брожение масляно-кислые бактерии C6H12O6 → CH3 – CH2 – CH2 – COOH + 2H2O
- 22. IV.Горение и разложение глюкозы. Как все органические вещества, глюкоза может гореть и разлагаться при нагревании: C6H12O6
- 23. Источники информации 1. Денисов В.Г. Химия. 10 класс. Поурочные планы. – Волгоград: Учитель, 2004. 2. Аргишева
- 24. 4. Хомченко Г.П. Пособие по химии для поступающих в вузы. – М.: ООО «Издательство Новая Волна»,
- 26. Скачать презентацию


















 Химический элемент хлор
Химический элемент хлор Углеводы, 10 класс
Углеводы, 10 класс Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Простые вещества
Простые вещества Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Реакции деструкции макромолекул
Реакции деструкции макромолекул Воздух и его состав
Воздух и его состав Биохимия
Биохимия Относительная атомная масса химических элементов. Знаки химических элементов
Относительная атомная масса химических элементов. Знаки химических элементов Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Двойной электрический слой, его строение. Электродный потенциал
Двойной электрический слой, его строение. Электродный потенциал Классификации, номенклатура, строение и свойства органических соединений
Классификации, номенклатура, строение и свойства органических соединений Electron configuration and periodicity
Electron configuration and periodicity Железо. Строение атома, химические и физические свойства. Урок №1
Железо. Строение атома, химические и физические свойства. Урок №1 Комплексні сполуки
Комплексні сполуки Химия титанорганических соединений
Химия титанорганических соединений Химическая реакция
Химическая реакция Физико-химические методы анализа. Лекция 1
Физико-химические методы анализа. Лекция 1 Бытовая химия
Бытовая химия Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Углерод. Аллотропные состояния углерода
Углерод. Аллотропные состояния углерода Вода - розчинник. Урок 41
Вода - розчинник. Урок 41 Основания. 8 класс
Основания. 8 класс Алканы. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза
Алканы. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза Строение атома. Химическая связь
Строение атома. Химическая связь Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Содержание кислорода и углекислого газа в помещениях школы
Содержание кислорода и углекислого газа в помещениях школы