Содержание
- 2. II Основные понятия о химической реакции Химическая реакция – разрыв старых и образование новых химических связей.
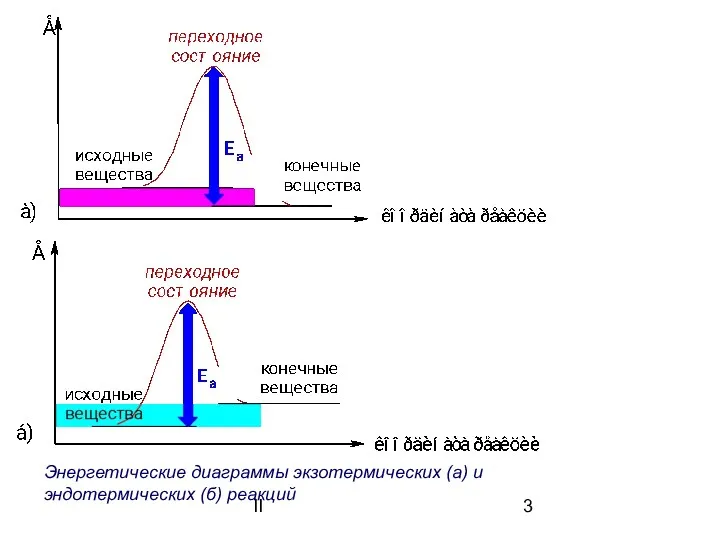
- 3. II Энергетические диаграммы экзотермических (а) и эндотермических (б) реакций
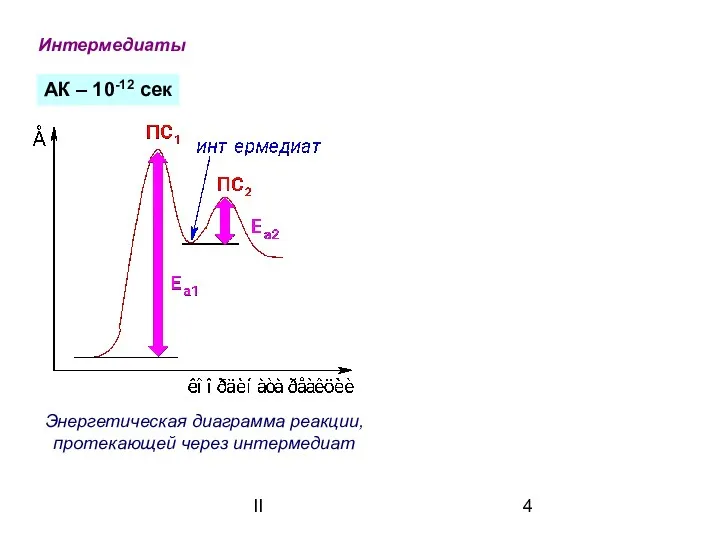
- 4. II Энергетическая диаграмма реакции, протекающей через интермедиат АК – 10-12 сек Интермедиаты
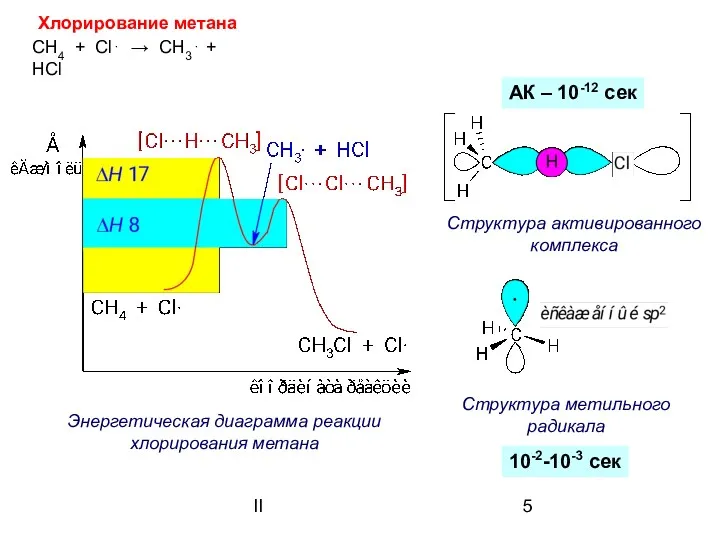
- 5. II Энергетическая диаграмма реакции хлорирования метана АК – 10-12 сек CH4 + Cl⋅ → CH3⋅ +
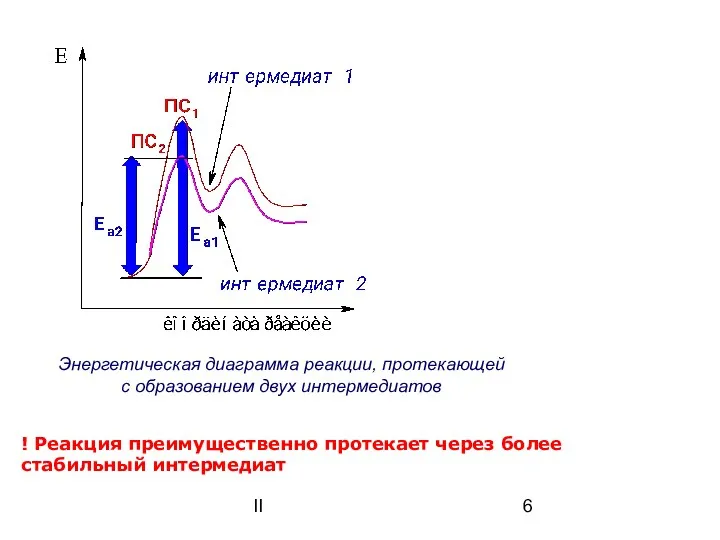
- 6. II Энергетическая диаграмма реакции, протекающей с образованием двух интермедиатов ! Реакция преимущественно протекает через более стабильный
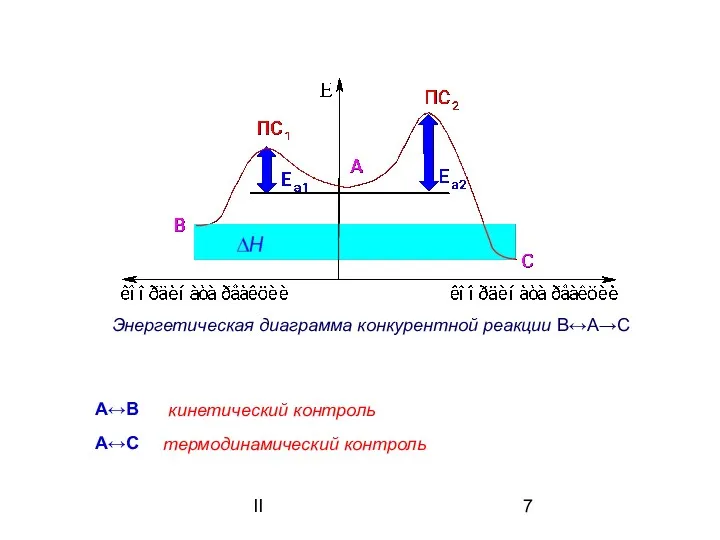
- 7. II Энергетическая диаграмма конкурентной реакции В↔А→С А↔В А↔С кинетический контроль термодинамический контроль
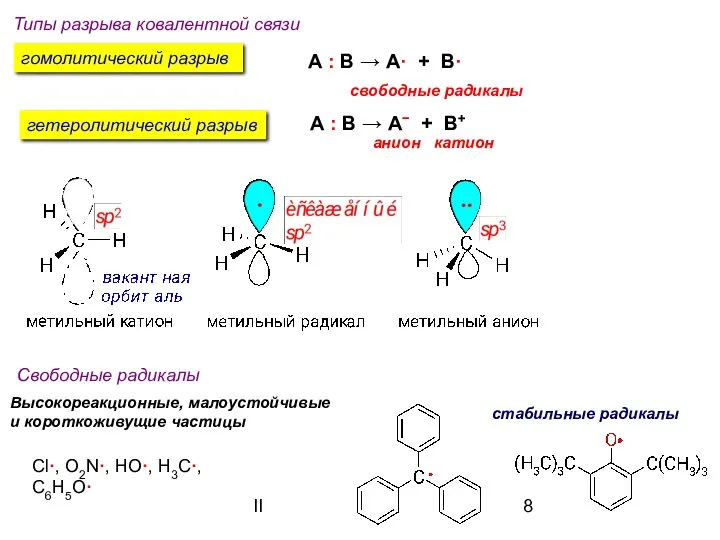
- 8. II Типы разрыва ковалентной связи гомолитический разрыв гетеролитический разрыв А : В → А· + В·
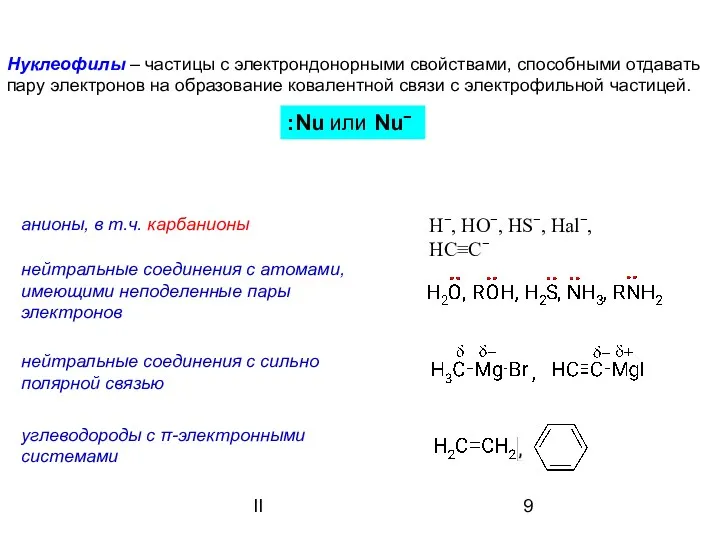
- 9. II Нуклеофилы – частицы с электрондонорными свойствами, способными отдавать пару электронов на образование ковалентной связи с
- 10. II Электрофилы – частицы с электроноакцепторными свойствами, способные образовывать ковалентную связь с нуклеофильной компонентой за счет
- 11. II Типы реакций реакции присоединения (А от англ. addition) реакции замещения (S от англ. substitution) реакции
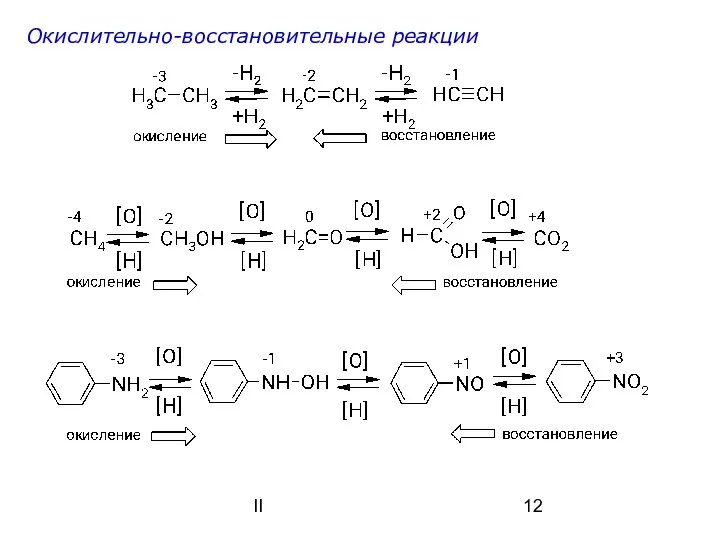
- 12. II Окислительно-восстановительные реакции
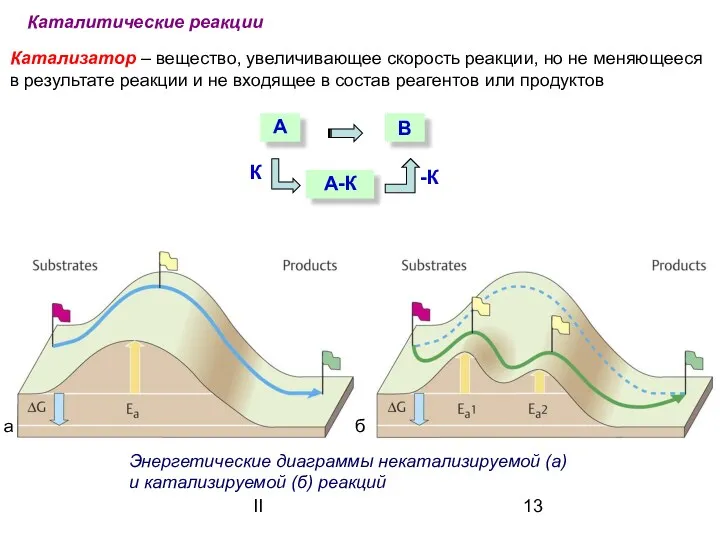
- 13. II Энергетические диаграммы некатализируемой (а) и катализируемой (б) реакций Катализатор – вещество, увеличивающее скорость реакции, но
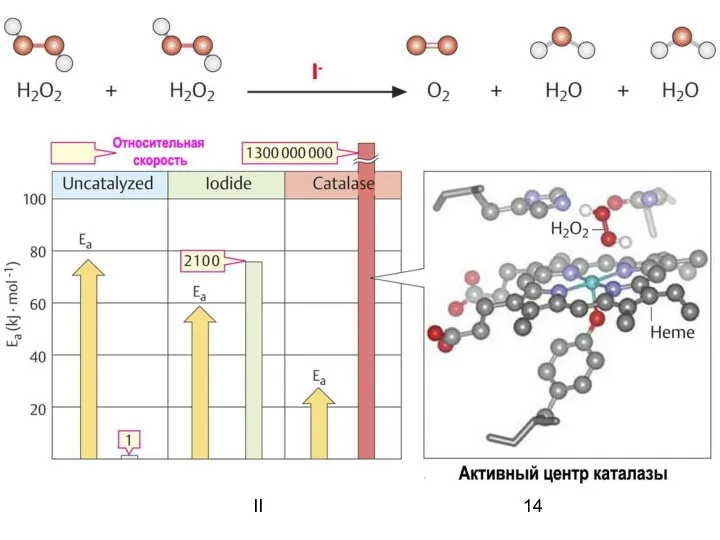
- 14. II
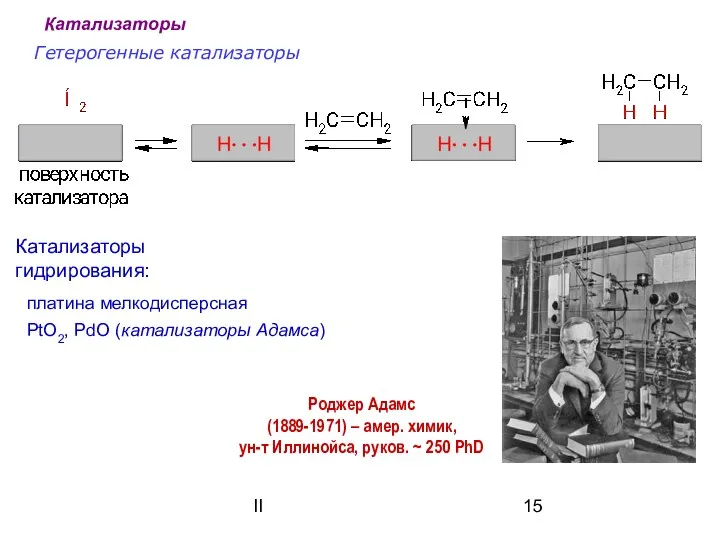
- 15. II Гетерогенные катализаторы Катализаторы гидрирования: платина мелкодисперсная PtO2, PdO (катализаторы Адамса) Катализаторы Роджер Адамс (1889-1971) –
- 16. II Катализаторы гидрирования: никель Ренея (скелетный никель) CuO⋅Cr2O3 (катализатор Адкинса) никель порошковый Поль Сабатье (1854-1941) –
- 17. II Гомогенные катализаторы [(C6H5)3P]3RhCl [(C6H5)3P]3Ru.HCl и др. Джефри Уилкинсон (1921-1996) – англ. химик 1973, химия катализатор
- 18. II Межфазный катализ Межфазные катализаторы: четвертичные аммонийные соли
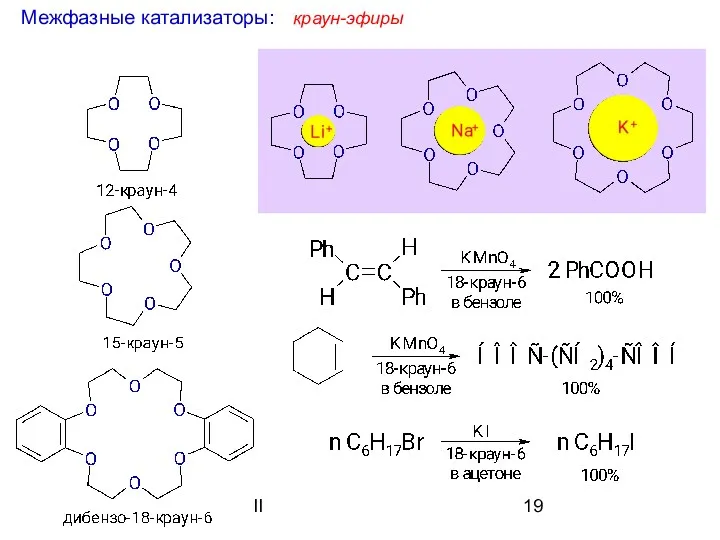
- 19. II краун-эфиры Межфазные катализаторы:
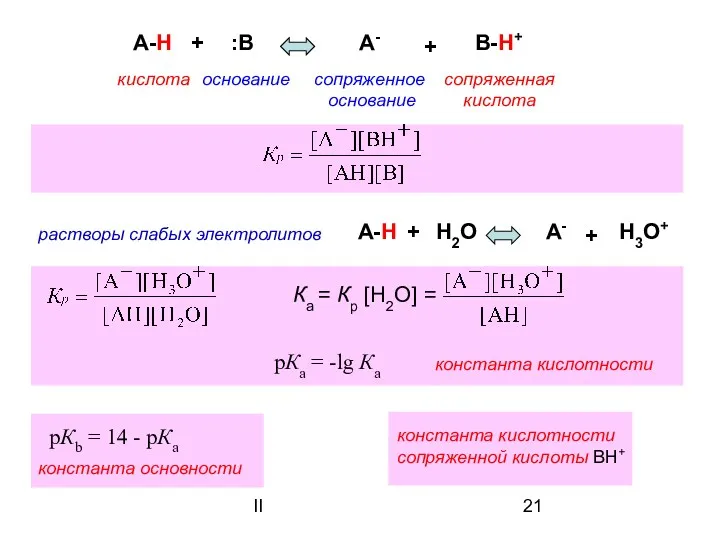
- 20. II Теория Брёнстеда-Лоури A-H + :B A- B-H+ + кислота основание сопряженная кислота сопряженное основание Кислотность
- 21. II A-H + :B A- B-H+ + кислота основание сопряженная кислота сопряженное основание растворы слабых электролитов
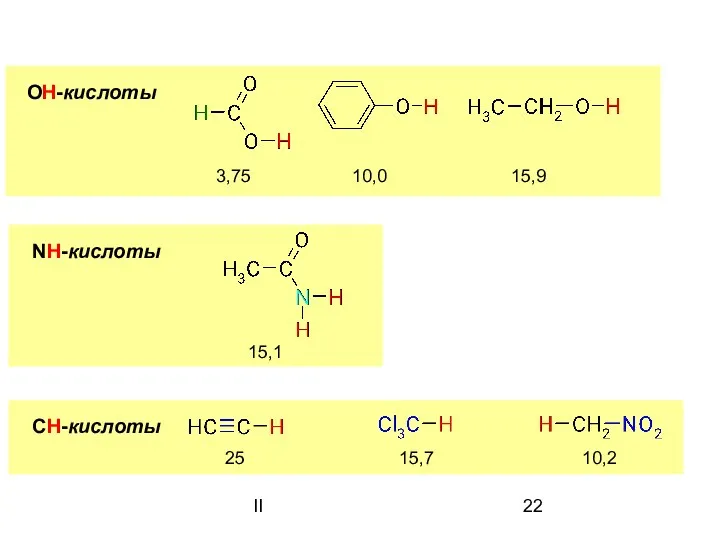
- 22. II ОН-кислоты 3,75 10,0 15,9 NH-кислоты СН-кислоты 15,1 25 15,7 10,2
- 23. II Теория Льюиса Кислотность – способность соединения принимать электронную пару на свободную орбиталь. Основность – способность
- 25. Скачать презентацию




![II Гомогенные катализаторы [(C6H5)3P]3RhCl [(C6H5)3P]3Ru.HCl и др. Джефри Уилкинсон (1921-1996)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/384441/slide-16.jpg)



 Химия в жизни общества
Химия в жизни общества Organic molecules
Organic molecules Первичная переработка нефти
Первичная переработка нефти Состав газированной воды
Состав газированной воды Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Галогены (солеобразующие)
Галогены (солеобразующие) Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями
Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Углекислый газ
Углекислый газ Неон. Получение
Неон. Получение Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
 Химическая связь
Химическая связь Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Типы химических реакций в органической химии
Типы химических реакций в органической химии СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Хімічні сполуки у побуті
Хімічні сполуки у побуті Основные классы неорганических веществ
Основные классы неорганических веществ Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала Химический элемент и вещество
Химический элемент и вещество Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива