NO-оксид азота (II)
Бесцветный газ, не имеет запаха. В воде малорастворим. Образуется
из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
N2 + O2 ? 2NO
В лаборатории: Сu + HNO3 == Cu(NO3)2 + NO + H2O
разб.
II II
N=О молекула линейна, имеет неспаренный электрон, поэтому является радикалом, используется как донор электронов.
Окислительно-восстановительная двойственность
Восстановитель:
2NO + O2 = 2NO2 (легко!)
так как радикал, очень легко подвергается окислению
Окислитель:
2NO + 2SO2 = 2SO3 + N2
Нитрозный способ получения серной кислоты
3
8
3
2
4







 Газы, применяемые при сварке
Газы, применяемые при сварке Циклоалканы
Циклоалканы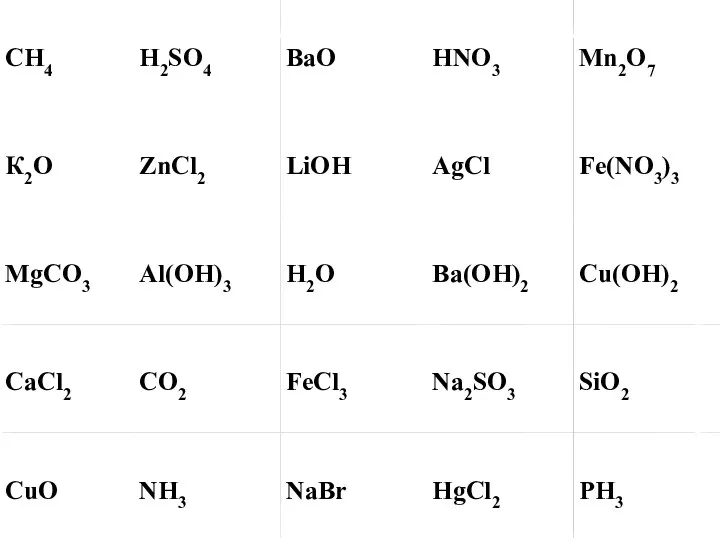 Химические реакции
Химические реакции Роль химии в жизни человека
Роль химии в жизни человека Исследование снежного покрова
Исследование снежного покрова Фазовые равновесия в растворах
Фазовые равновесия в растворах Благородные газы
Благородные газы Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Электрохимические процессы
Электрохимические процессы Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Драгоценные камни
Драгоценные камни Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Виды коррозии
Виды коррозии Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Полусинтетическое масло
Полусинтетическое масло Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Медь и её сплавы
Медь и её сплавы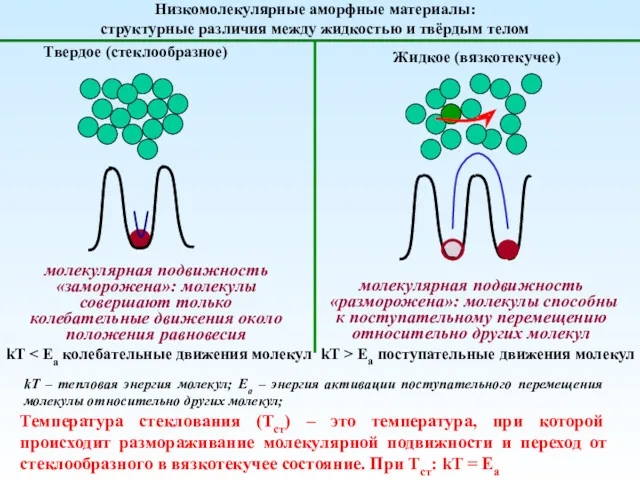 Механика полимеров
Механика полимеров Влияние фтора на организм человека
Влияние фтора на организм человека Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Серная кислота и её свойства
Серная кислота и её свойства Массообменные процессы
Массообменные процессы Объёмная доля компонента смеси
Объёмная доля компонента смеси Марганец и хром
Марганец и хром Физико-химические процессы переработки нефти. Термические процессы
Физико-химические процессы переработки нефти. Термические процессы Виды присадок к моторным топливам
Виды присадок к моторным топливам Классификация и номенклатура неорганических веществ
Классификация и номенклатура неорганических веществ Галогены. Нахождение в природе
Галогены. Нахождение в природе