Содержание
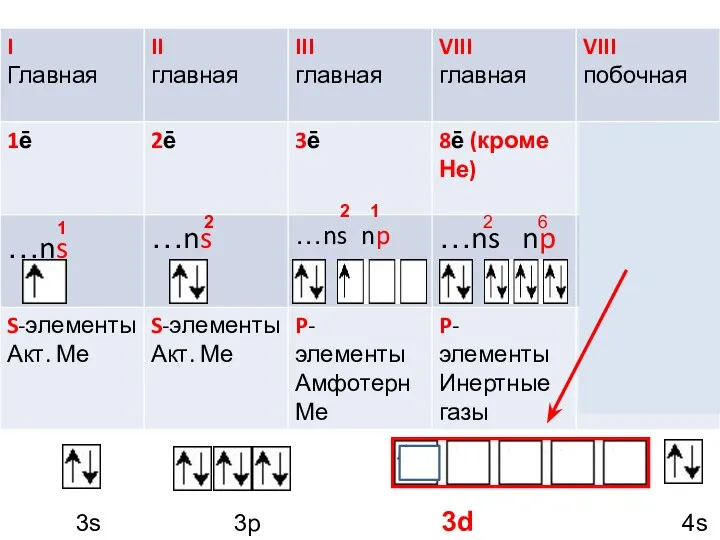
- 2. 1 3s 3p 3d 4s 2 2 1 2 6
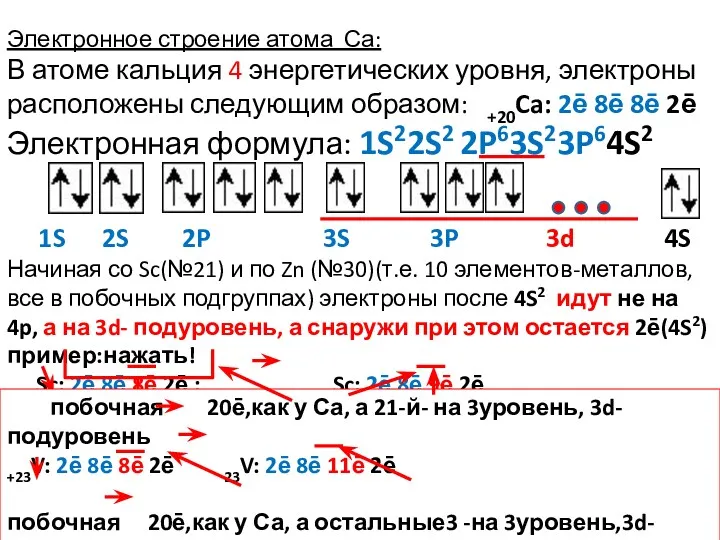
- 3. Электронное строение атома Са: В атоме кальция 4 энергетических уровня, электроны расположены следующим образом: +20Ca: 2ē
- 4. Попробуйте распределить электроны у железа по алгоритму, проверьте себя: стр 202-прочитать 26Fe: 2ē 8ē 8ē …2ē
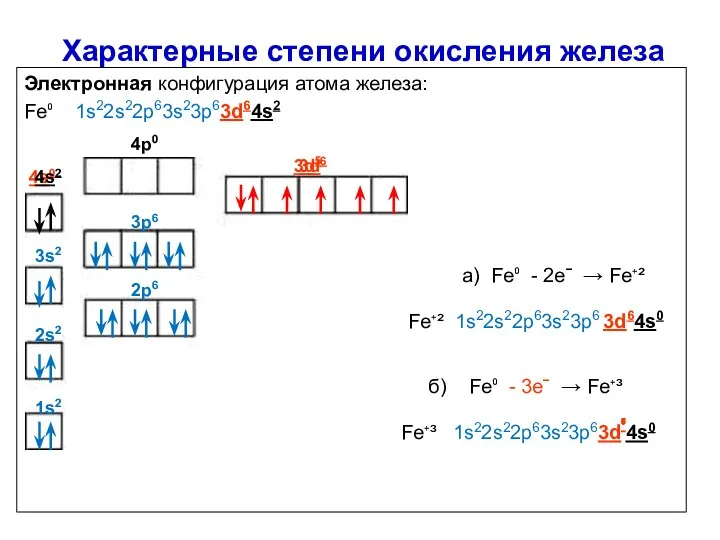
- 5. Характерные степени окисления железа Электронная конфигурация атома железа: Fe⁰ 1s22s22p63s23p63d64s2 а) Fe⁰ - 2eˉ → Fe⁺²
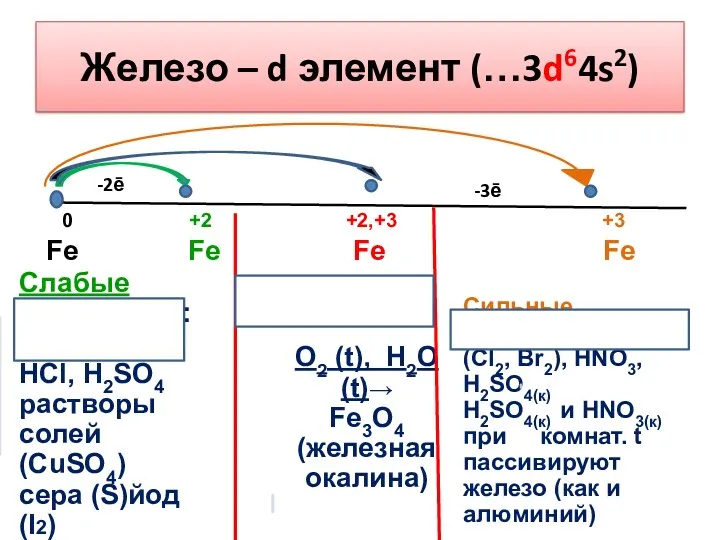
- 6. Железо – d элемент (…3d64s2) -2ē -3ē 0 +2 +2,+3 +3 Fe Fe Fe Fe Кислород,вода(t)
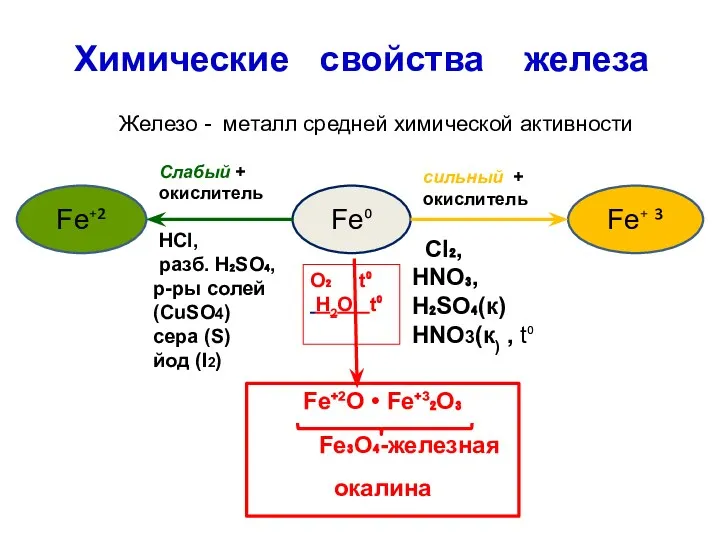
- 7. Химические свойства железа Железо - металл средней химической активности Fe⁰ Fe⁺² Fe⁺ ³ сильный + окислитель
- 9. 1) Взаимодействие железа с простыми веществами:
- 10. Проверьте себя: 3 Fe⁰ + 2 O2⁰ → Fe⁺²O¯²• Fe⁺³₂O₃ Fe₃O₄ Fe⁰ - восстановитель O⁰2 -
- 11. Проверьте себя: 2 Fe⁰ + 3 Cl2⁰ → 2 Fe⁺³Cl¯¹3 Fe⁰ - восстановитель Cl2⁰ - окислитель
- 12. 2) Взаимодействие железа со сложными веществами: Fe + H2O → Fe3O4 + H2↑ Задание 4: расставьте
- 13. Проверьте себя: 2) Взаимодействие железа со сложными веществами: 3 Fe⁰ + 4 H⁺¹2O → + 4
- 14. В) взаимодействие железа с кислотами а) Железо растворяется в HCl и разбавленной H₂SO₄ : кислота +
- 15. Проверьте себя: 1) Fe + 2 HCl → FeCl₂ + H2↑ Fe⁰ + 2 H⁺ +
- 16. Задание 6: напишите молекулярные, полные и краткие ионные уравнения возможных реакций а) Fe + CuCl₂ →
- 17. а) Fe + CuCl₂ → FeCl₂ + Cu↓ Fe⁰ + Cu²⁺ + 2 Cl⁻ → Fe²⁺
- 18. Физические свойства железа Тугоплавкий металл (tпл=1539оС) серебристо-белого цвета; пластичен, различные примеси повышают его твердость и хрупкость.
- 19. Домашнее задание: 1: Привести уравнения реакций со стр.203-204, можно в форме таблицы под схемой, понять и
- 20. Урок №2 Соединения железа . Генетические ряды железа(II)/(III). Получение железа.
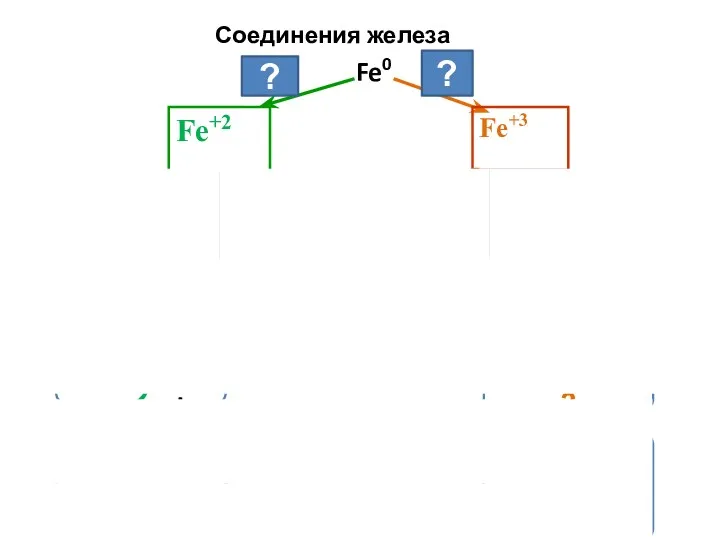
- 21. Соединения железа Fe0 Fe+3 Fe+2 +О2, Н2О t t OH- OH- окисление окисление HCl Cl2 ?
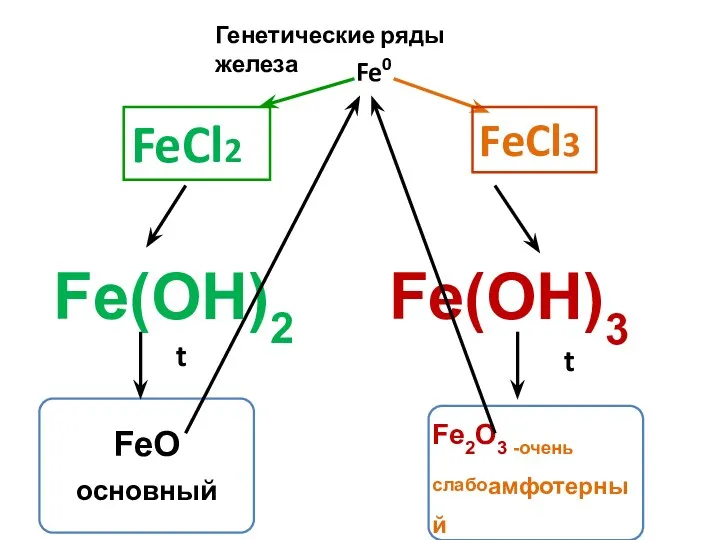
- 22. Переход соединений Fe+2 в соединения Fe+3 ( и обратно) 2 FeCl2 + Cl2 = 2FeCl3 –
- 23. Генетические ряды железа Fe0 FeCl3 FeCl2 t t
- 24. https://youtu.be/hLBSwoHS23s - получение и свойства гидроксида железа(II) https://youtu.be/t3uV5O3Sar4 - получение и свойства гидроксида железа(III) Цветная вкладка
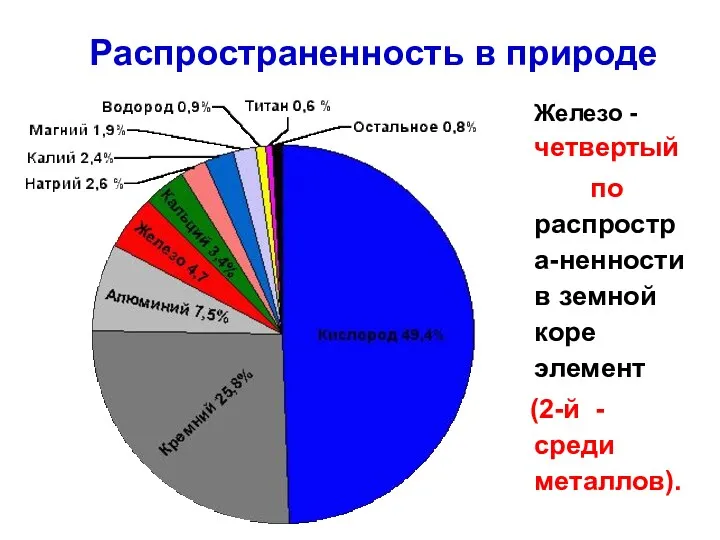
- 25. Распространенность в природе Железо - четвертый по распростра-ненности в земной коре элемент (2-й - среди металлов).
- 26. Минералы железа лимонит Fe2O3 • nH2O гематит Fe2O3 пирит FeS2 магнетит Fe3O4
- 27. Получение железа . 3) При прямом получении железа из руд используют бедные железные руды, шлаки других
- 28. Проверьте себя: 1) 3 Fe2O3 + CO = 2 Fe3O4 + CO2 Fe3O4 + CO =
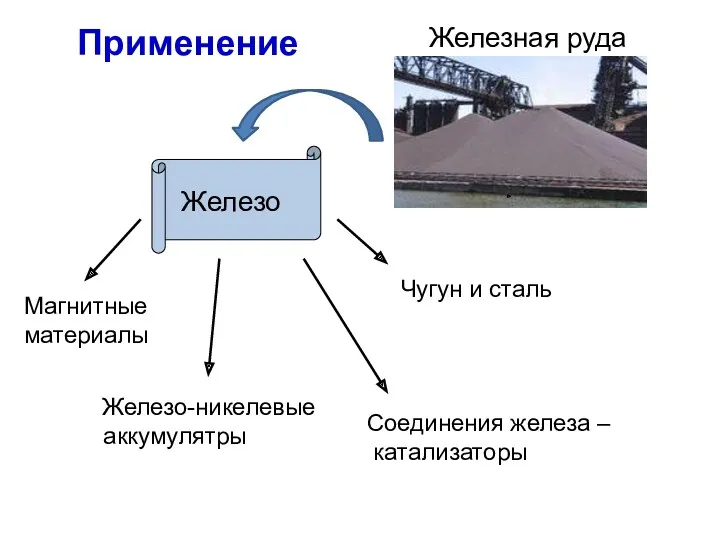
- 29. Применение Железо Чугун и сталь Магнитные материалы Железо-никелевые аккумулятры Железная руда Соединения железа – катализаторы
- 30. Железо - основной конструкционный материал
- 32. Скачать презентацию




















 Серная кислота и её свойства
Серная кислота и её свойства Химия и война. Альманах
Химия и война. Альманах Твердые тела
Твердые тела Полимеры. Полимерные материалы
Полимеры. Полимерные материалы Материаловедение. Диаграммы состояния
Материаловедение. Диаграммы состояния Проект установки каталитического риформинга мощностью 1200 тыс. тонн
Проект установки каталитического риформинга мощностью 1200 тыс. тонн Химическая кинетика
Химическая кинетика Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год Кислоты: названия, получение, свойства, применение
Кислоты: названия, получение, свойства, применение Спирты
Спирты Особая роль углерода в наномире
Особая роль углерода в наномире Превращение веществ
Превращение веществ Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Двойной электрический слой, его строение. Электродный потенциал
Двойной электрический слой, его строение. Электродный потенциал Гетероциклические соединения
Гетероциклические соединения Окислительные методы получения органических соединений
Окислительные методы получения органических соединений Хімічні властивості оксидів
Хімічні властивості оксидів Метрологические основы аналитической химии
Метрологические основы аналитической химии Железо. Fe (лат. Феррум)
Железо. Fe (лат. Феррум) История органической химии. Характерные особенности органических соединений
История органической химии. Характерные особенности органических соединений Вещества. Чистые вещества. Смеси
Вещества. Чистые вещества. Смеси Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Химические свойства получение и применение солей
Химические свойства получение и применение солей Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Углекислый газ
Углекислый газ Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Нуклеиновые кислоты
Нуклеиновые кислоты Бензин: догадкии реальность
Бензин: догадкии реальность