Содержание
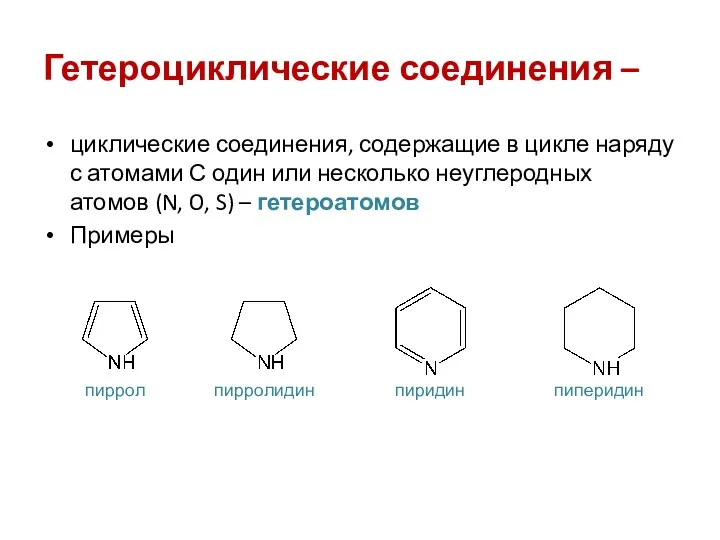
- 2. Гетероциклические соединения – циклические соединения, содержащие в цикле наряду с атомами С один или несколько неуглеродных
- 3. Классификации гетероциклов
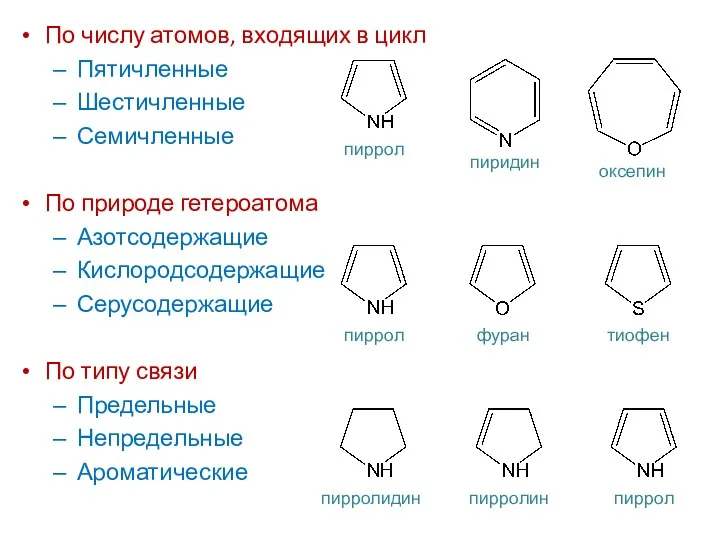
- 4. По числу атомов, входящих в цикл Пятичленные Шестичленные Семичленные По природе гетероатома Азотсодержащие Кислородсодержащие Серусодержащие По
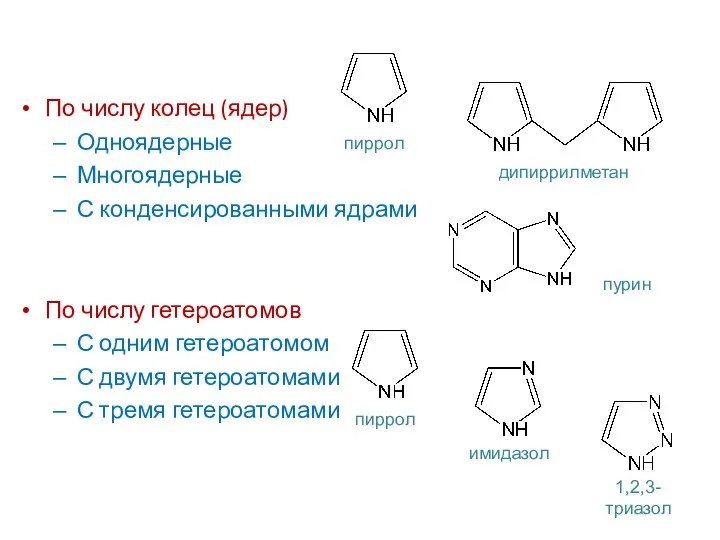
- 5. По числу колец (ядер) Одноядерные Многоядерные С конденсированными ядрами По числу гетероатомов С одним гетероатомом С
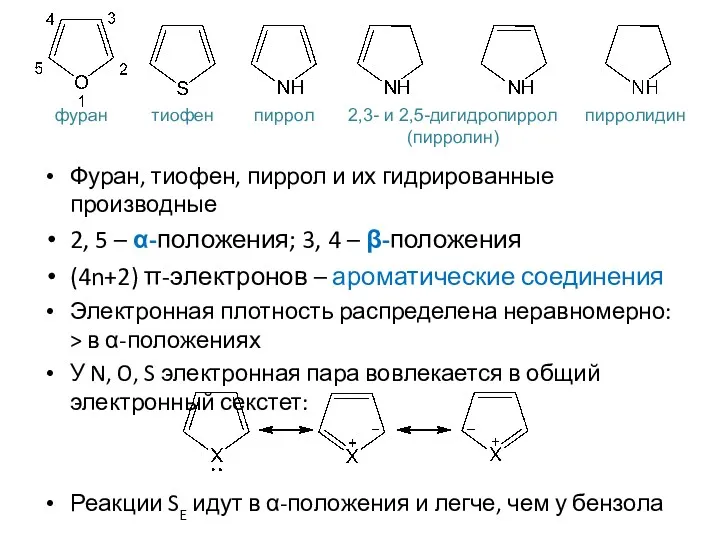
- 6. Пятичленные гетероциклы с одним гетероатомом
- 7. Фуран, тиофен, пиррол и их гидрированные производные 2, 5 – α-положения; 3, 4 – β-положения (4n+2)
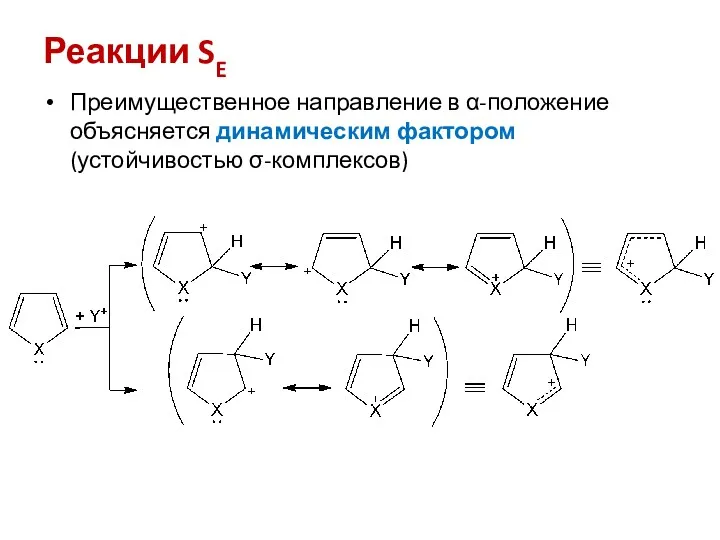
- 8. Реакции SE Преимущественное направление в α-положение объясняется динамическим фактором (устойчивостью σ-комплексов)
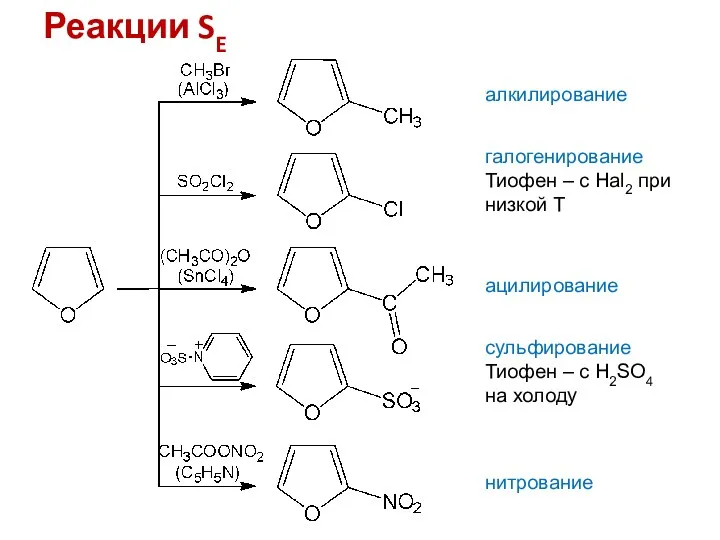
- 9. Реакции SE алкилирование галогенирование Тиофен – с Hal2 при низкой Т ацилирование сульфирование Тиофен – с
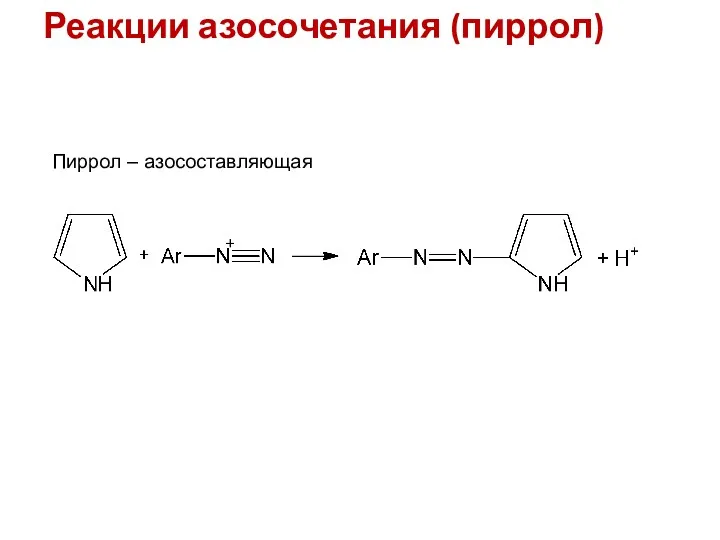
- 10. Реакции азосочетания (пиррол) Пиррол – азосоставляющая
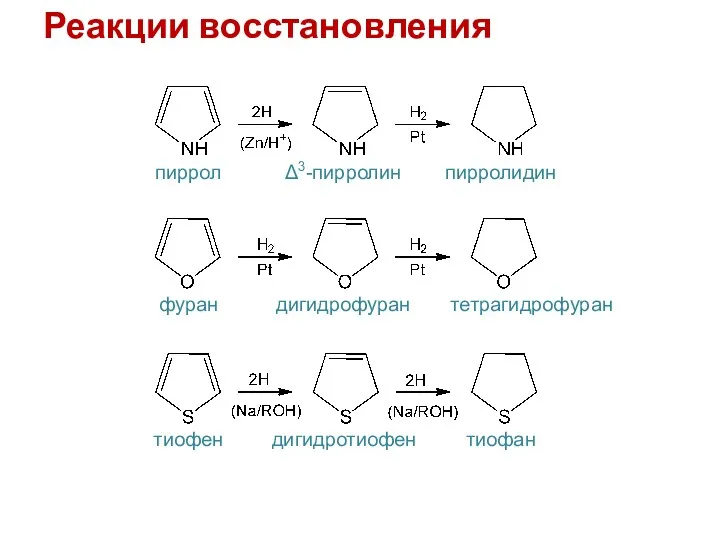
- 11. Реакции восстановления пиррол Δ3-пирролин пирролидин фуран дигидрофуран тетрагидрофуран тиофен дигидротиофен тиофан
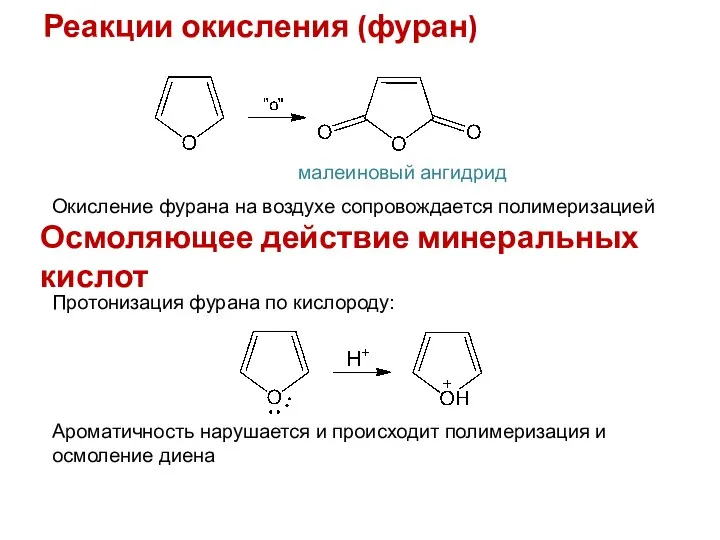
- 12. Реакции окисления (фуран) малеиновый ангидрид Окисление фурана на воздухе сопровождается полимеризацией Осмоляющее действие минеральных кислот Протонизация
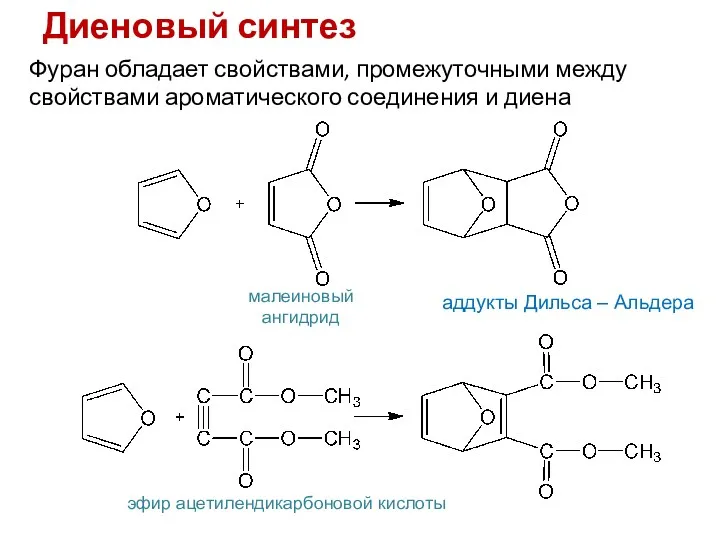
- 13. Диеновый синтез Фуран обладает свойствами, промежуточными между свойствами ароматического соединения и диена малеиновый ангидрид эфир ацетилендикарбоновой
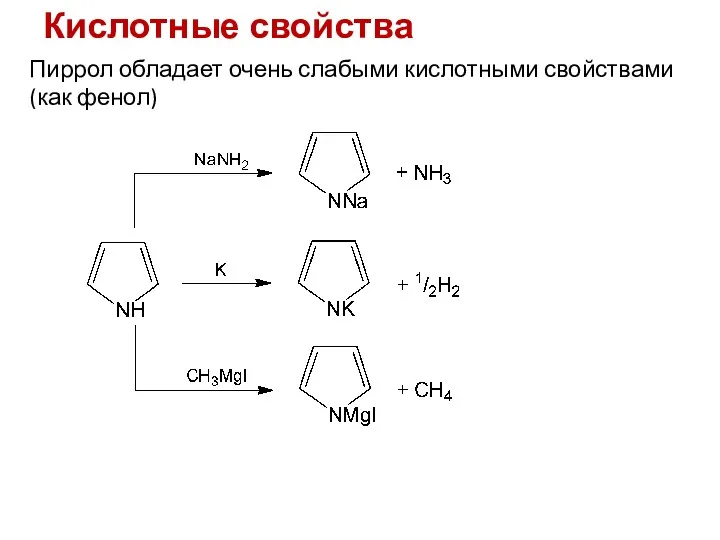
- 14. Кислотные свойства Пиррол обладает очень слабыми кислотными свойствами (как фенол)
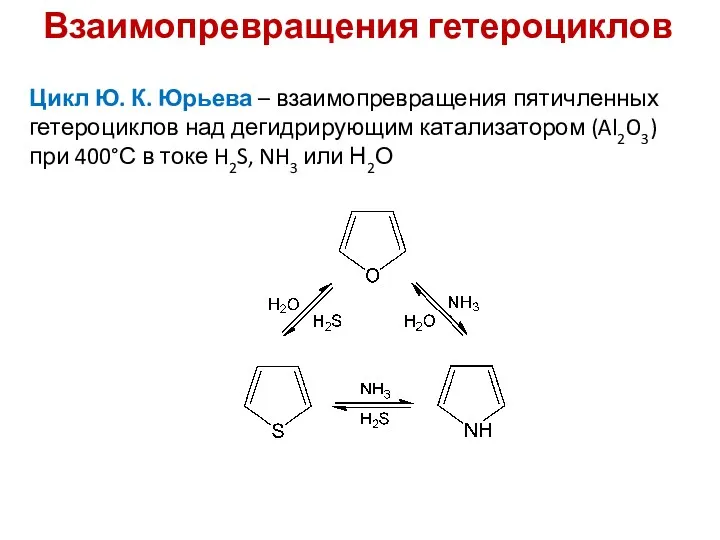
- 15. Взаимопревращения гетероциклов Цикл Ю. К. Юрьева – взаимопревращения пятичленных гетероциклов над дегидрирующим катализатором (Al2O3) при 400°С
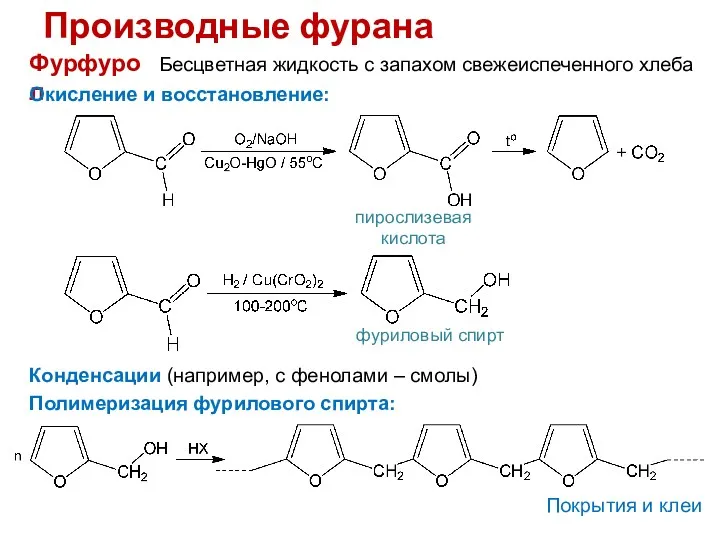
- 16. Производные фурана Фурфурол Бесцветная жидкость с запахом свежеиспеченного хлеба Окисление и восстановление: пирослизевая кислота фуриловый спирт
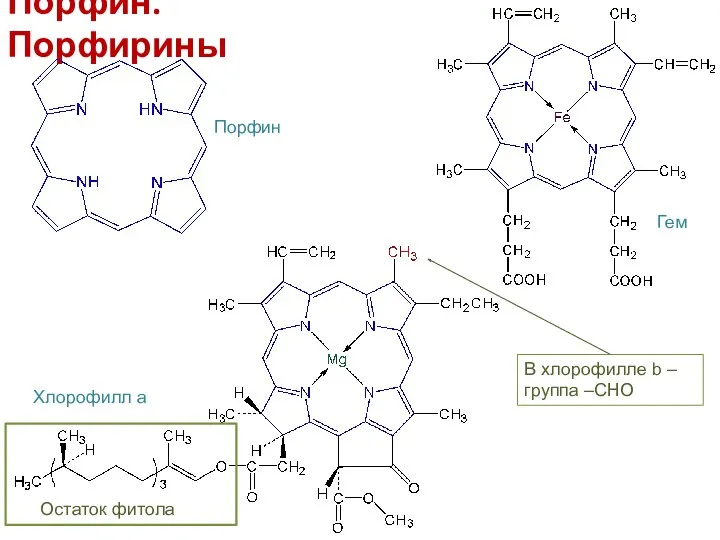
- 17. Порфин. Порфирины Порфин Гем Хлорофилл а Остаток фитола В хлорофилле b – группа –СНО
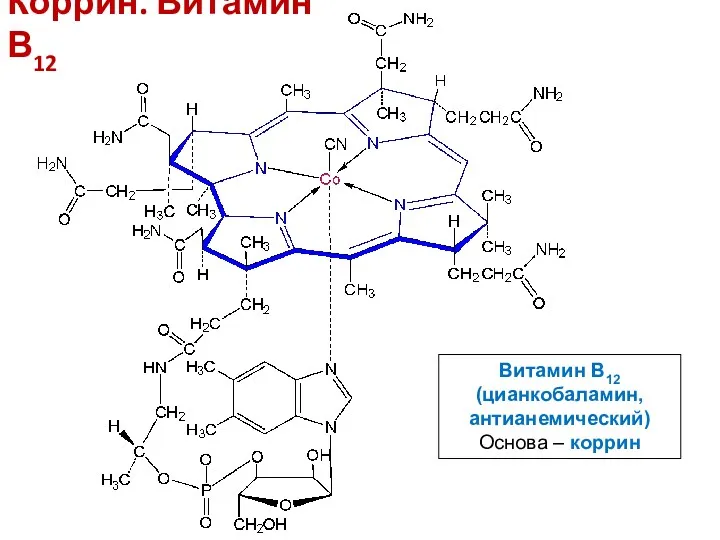
- 18. Коррин. Витамин В12 Витамин В12 (цианкобаламин, антианемический) Основа – коррин
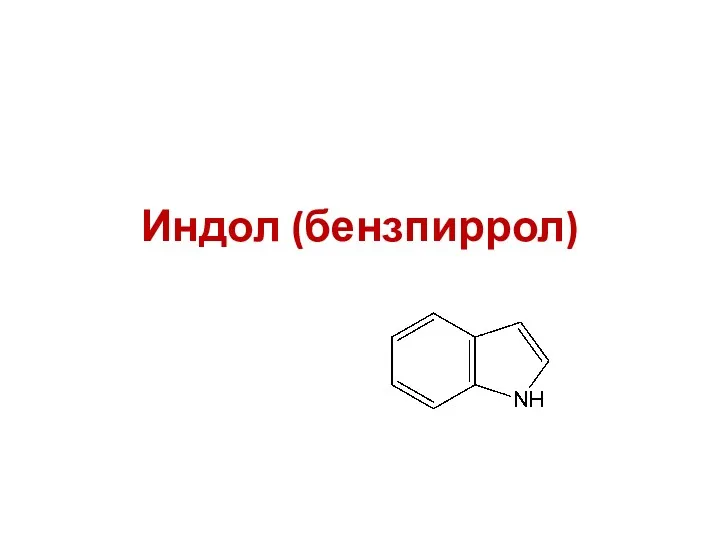
- 19. Индол (бензпиррол)
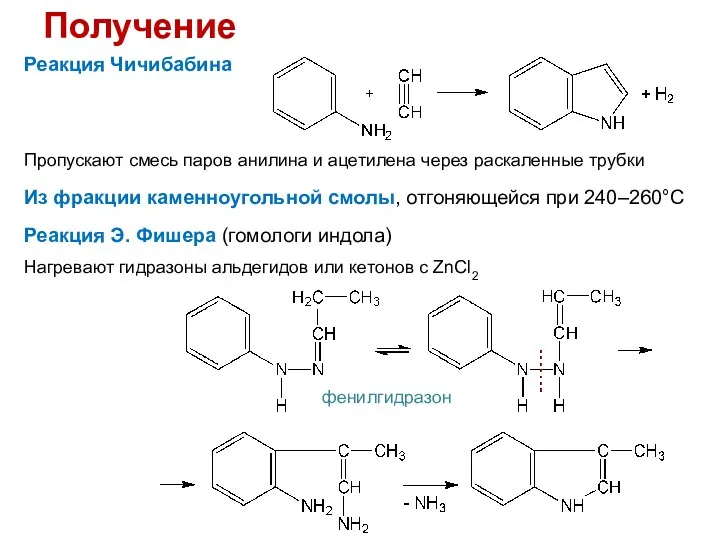
- 20. Получение Реакция Чичибабина Пропускают смесь паров анилина и ацетилена через раскаленные трубки Реакция Э. Фишера (гомологи
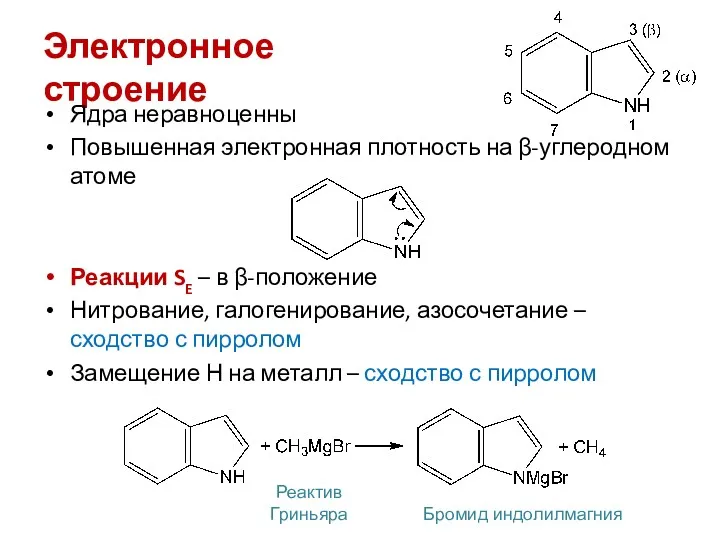
- 21. Электронное строение Ядра неравноценны Повышенная электронная плотность на β-углеродном атоме Реакции SE – в β-положение Нитрование,
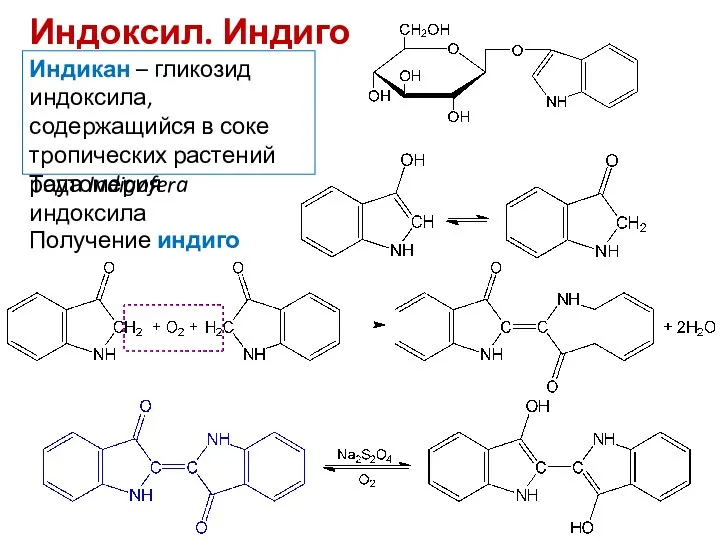
- 22. Индоксил. Индиго Индикан – гликозид индоксила, содержащийся в соке тропических растений рода Indigofera Таутомерия индоксила Получение
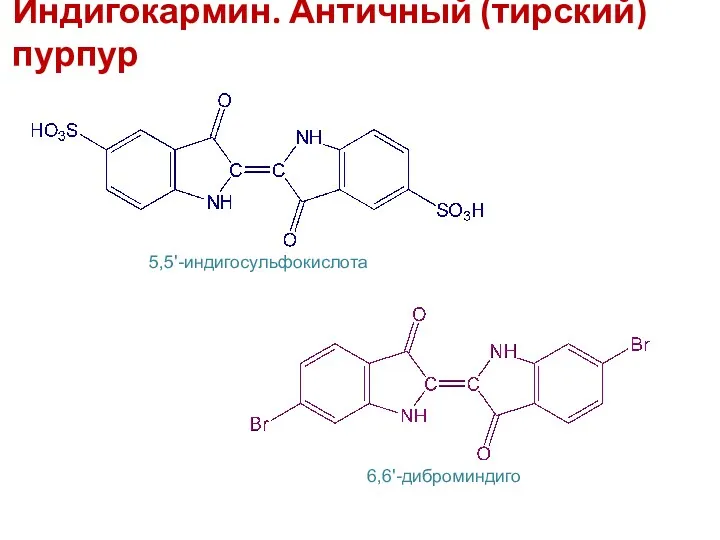
- 23. Индигокармин. Античный (тирский) пурпур 5,5'-индигосульфокислота 6,6'-диброминдиго
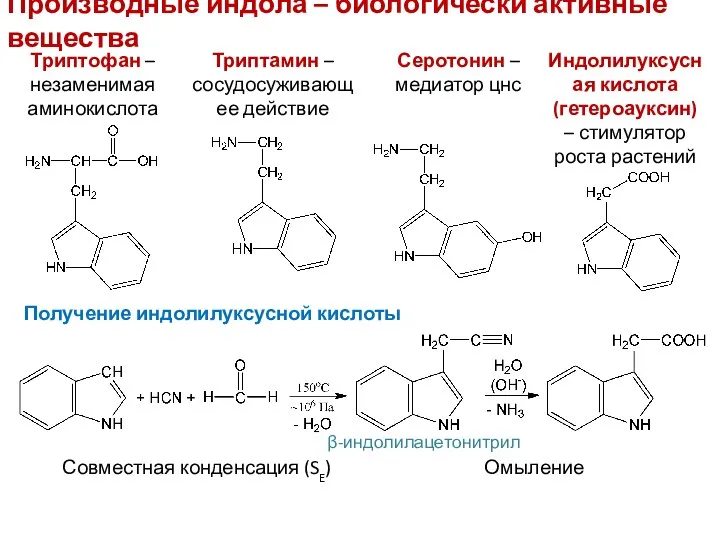
- 24. Производные индола – биологически активные вещества Триптофан – незаменимая аминокислота Триптамин – сосудосуживающее действие Серотонин –
- 25. Шестичленные гетероциклы с одним гетероатомом. Пиридин
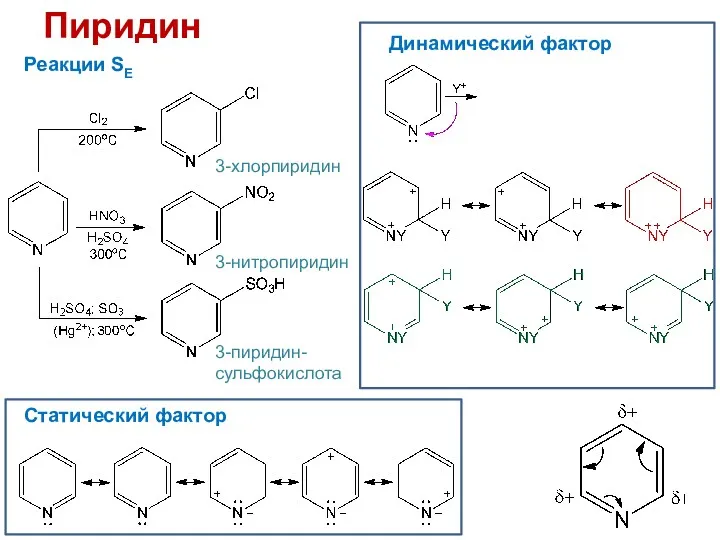
- 26. Пиридин Реакции SE 3-хлорпиридин 3-нитропиридин 3-пиридин-сульфокислота Статический фактор Динамический фактор
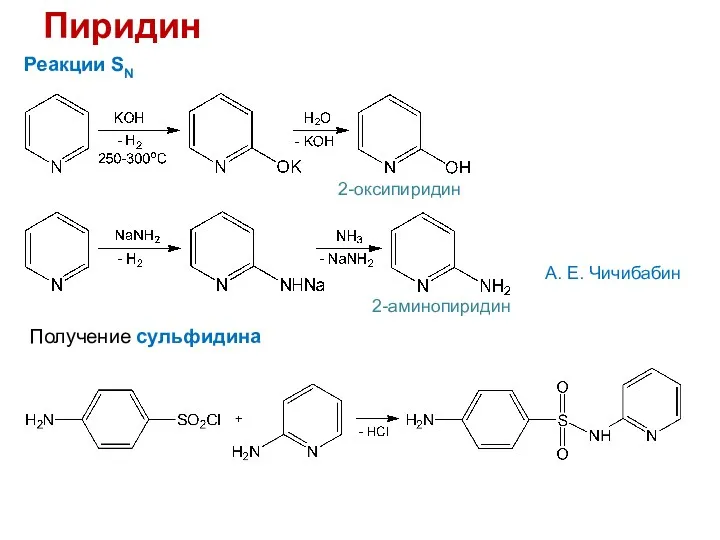
- 27. Пиридин Реакции SN 2-оксипиридин А. Е. Чичибабин 2-аминопиридин Получение сульфидина
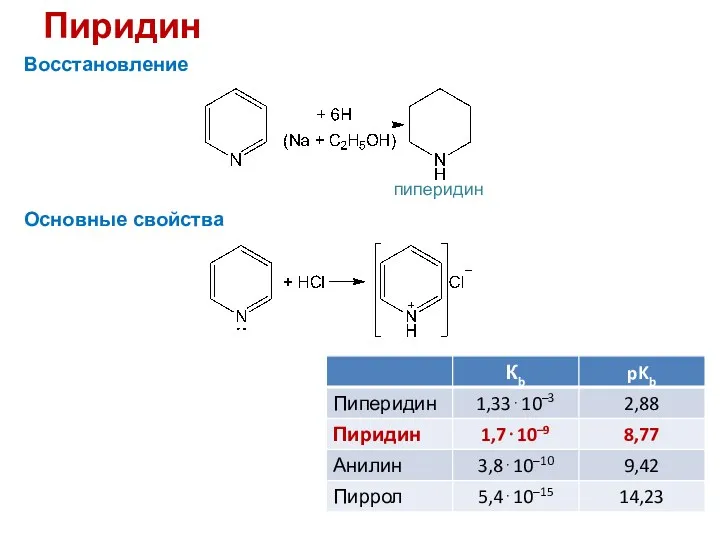
- 28. Пиридин Восстановление Основные свойства пиперидин
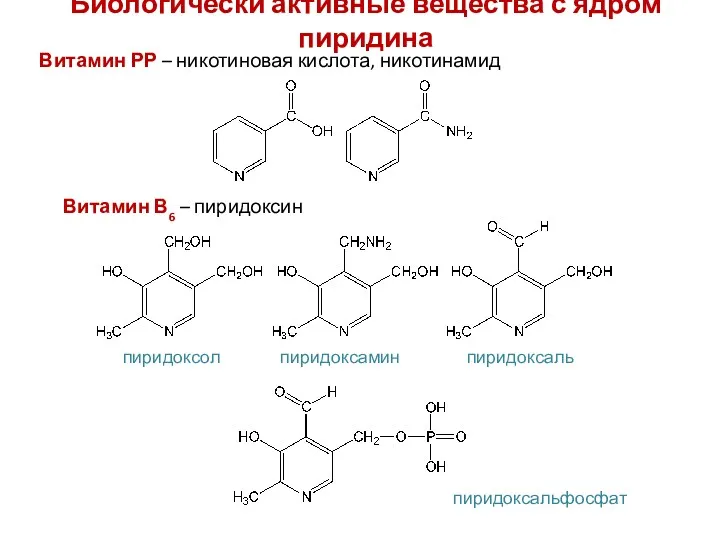
- 29. Биологически активные вещества с ядром пиридина Витамин РР – никотиновая кислота, никотинамид Витамин В6 – пиридоксин
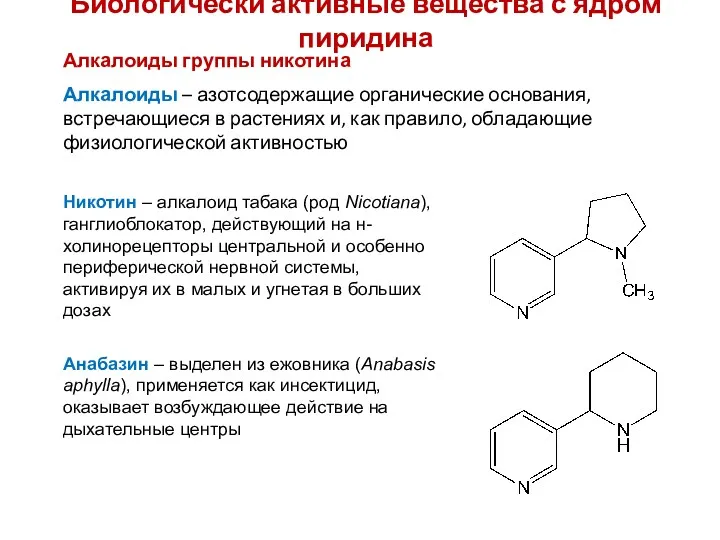
- 30. Биологически активные вещества с ядром пиридина Алкалоиды группы никотина Алкалоиды – азотсодержащие органические основания, встречающиеся в
- 31. Пятичленные гетероциклы с двумя гетероатомами
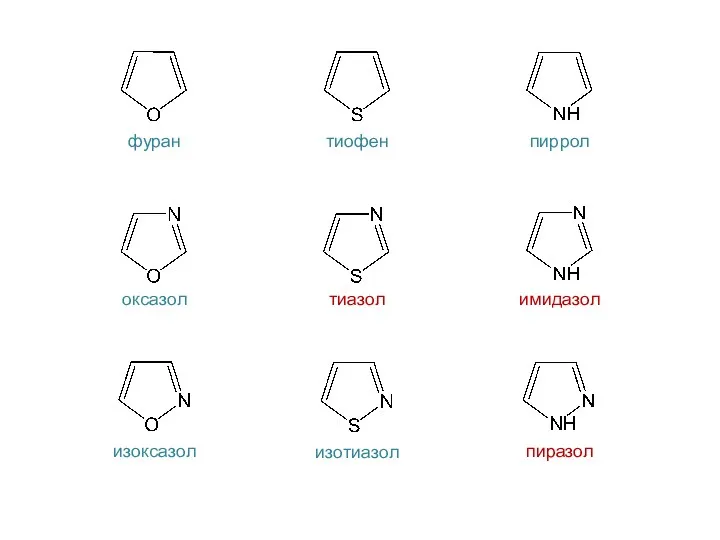
- 32. фуран тиофен пиррол оксазол тиазол имидазол изоксазол изотиазол пиразол
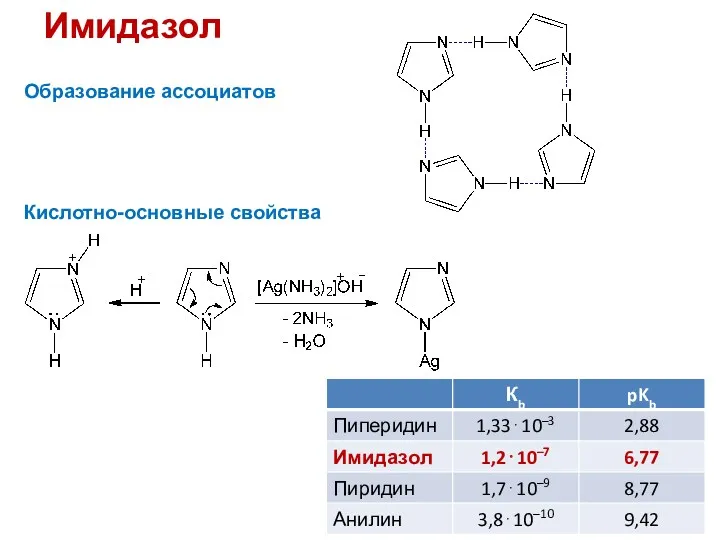
- 33. Имидазол Образование ассоциатов Кислотно-основные свойства
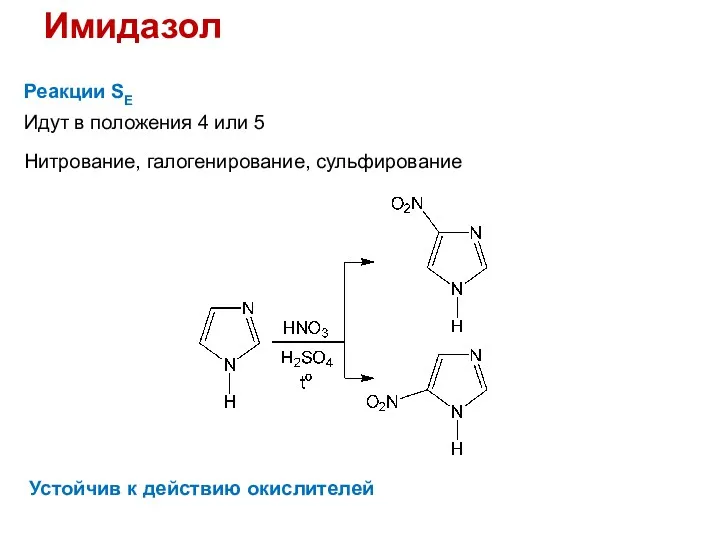
- 34. Имидазол Реакции SE Идут в положения 4 или 5 Нитрование, галогенирование, сульфирование Устойчив к действию окислителей
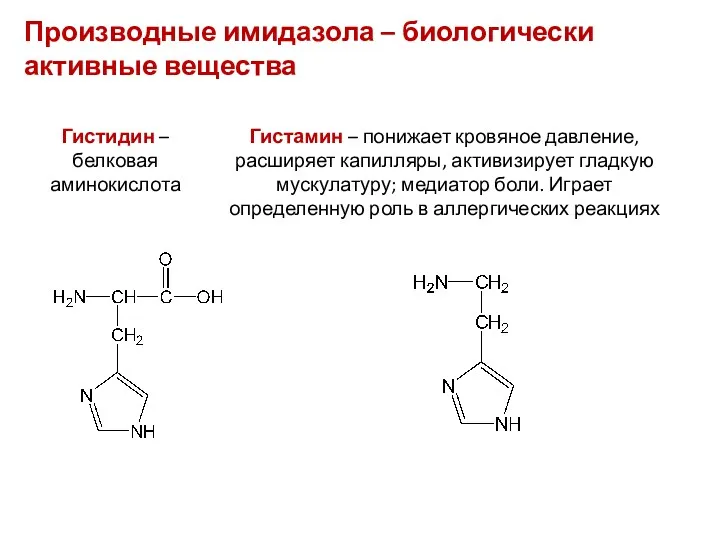
- 35. Производные имидазола – биологически активные вещества Гистидин – белковая аминокислота Гистамин – понижает кровяное давление, расширяет
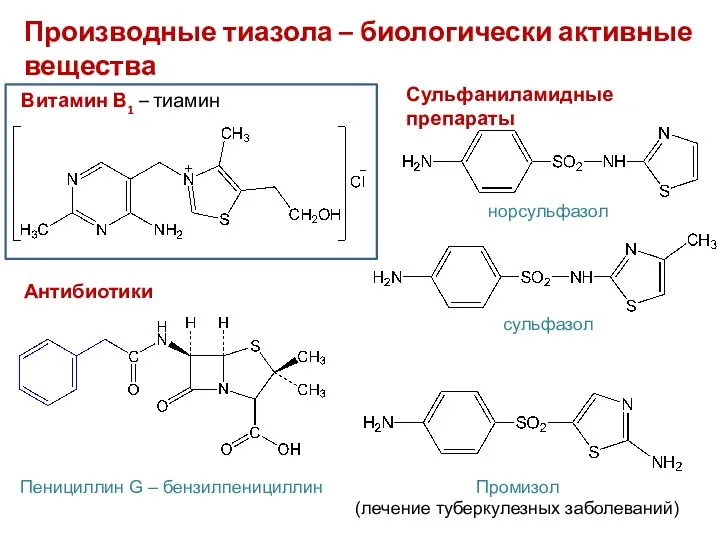
- 36. Производные тиазола – биологически активные вещества Витамин В1 – тиамин Антибиотики Пенициллин G – бензилпенициллин Сульфаниламидные
- 37. Шестичленные гетероциклы с двумя гетероатомами
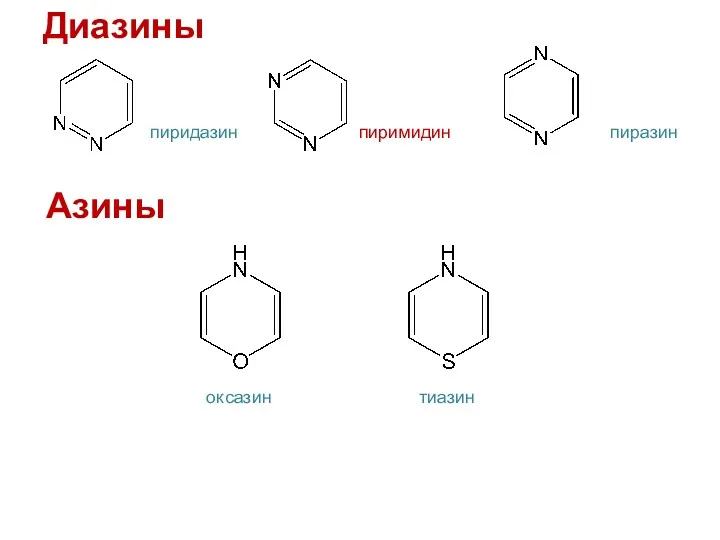
- 38. пиридазин пиразин пиримидин Диазины Азины оксазин тиазин
- 39. Пиримидиновые и пуриновые основания
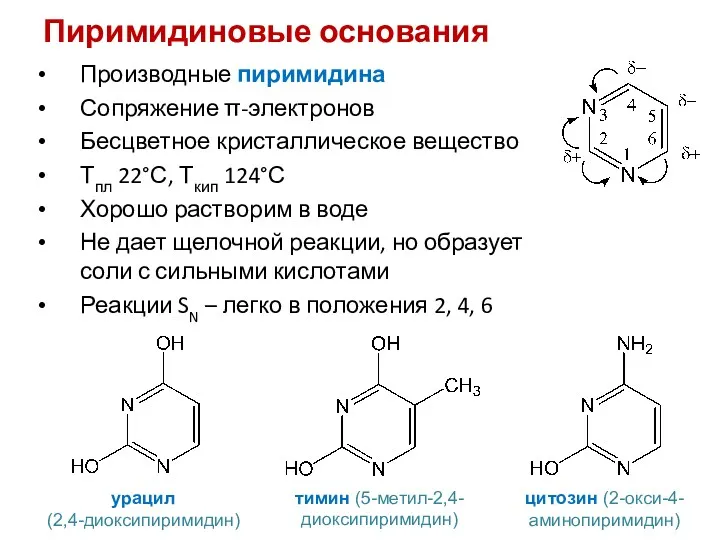
- 40. Пиримидиновые основания Производные пиримидина Сопряжение π-электронов Бесцветное кристаллическое вещество Тпл 22°С, Ткип 124°С Хорошо растворим в
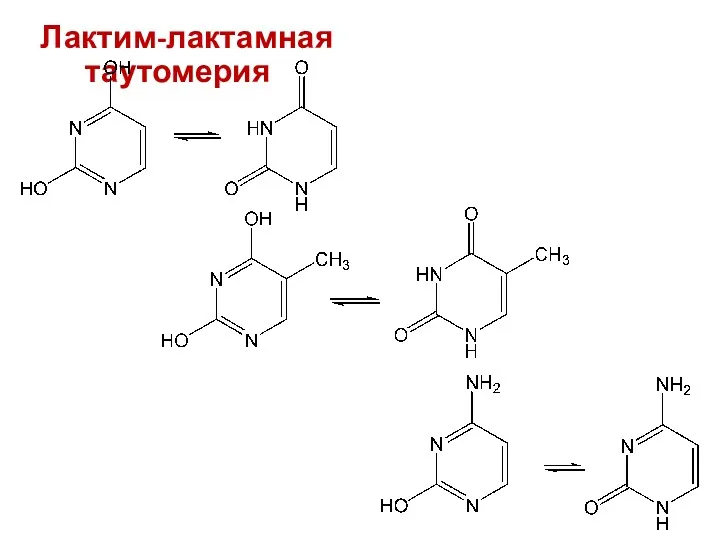
- 41. Лактим-лактамная таутомерия
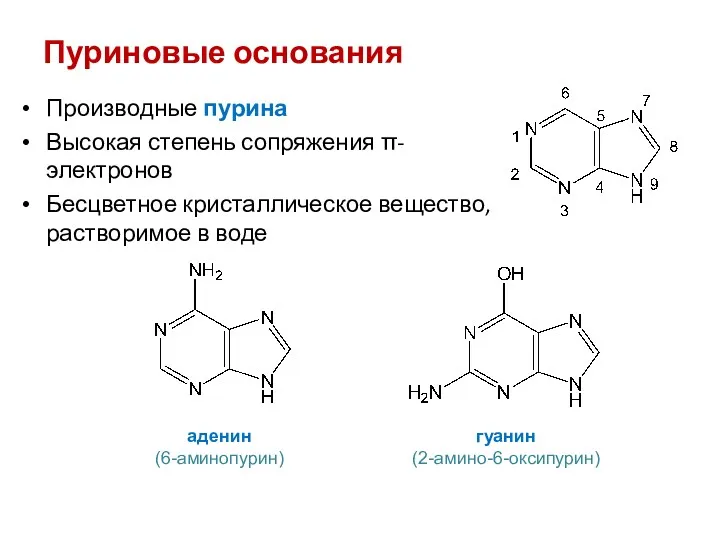
- 42. Пуриновые основания Производные пурина Высокая степень сопряжения π-электронов Бесцветное кристаллическое вещество, растворимое в воде аденин (6-аминопурин)
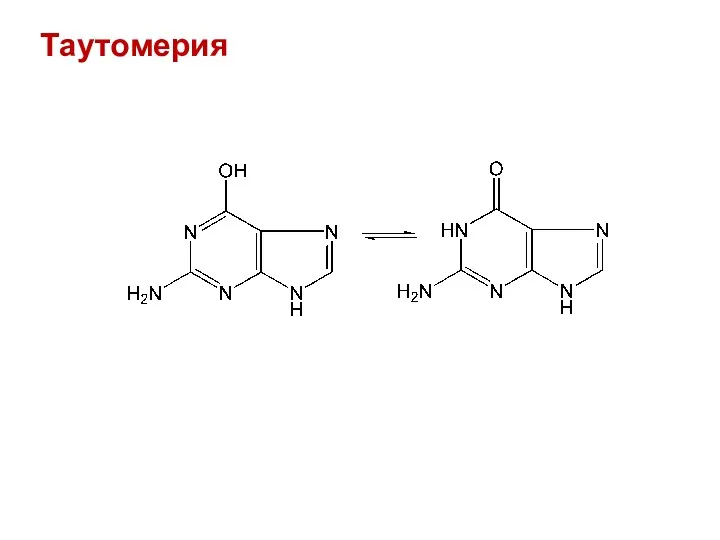
- 43. Таутомерия
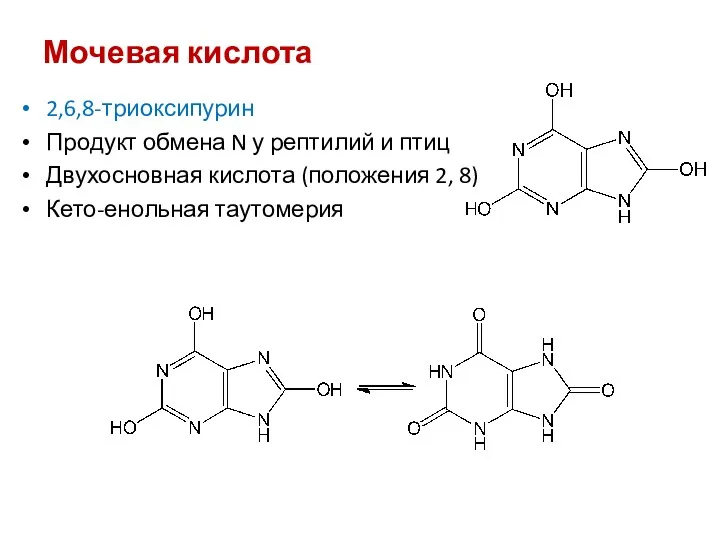
- 44. Мочевая кислота 2,6,8-триоксипурин Продукт обмена N у рептилий и птиц Двухосновная кислота (положения 2, 8) Кето-енольная
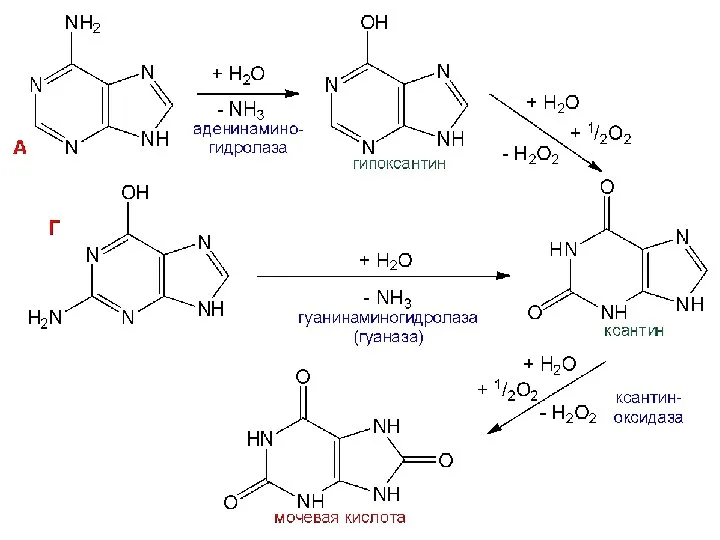
- 45. Распад пуриновых оснований Синтез мочевой кислоты
- 47. Распад пиримидиновых оснований
- 49. Скачать презентацию








 Хром
Хром Металлы. Лекция № 9
Металлы. Лекция № 9 Решение упражнений по теме: Углеводы
Решение упражнений по теме: Углеводы Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Защитные материалы
Защитные материалы Магнитные наночастицы: проблемы и достижения
Магнитные наночастицы: проблемы и достижения Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Общая характеристика неметаллов
Общая характеристика неметаллов Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Оксиды. Понятия об оксидах
Оксиды. Понятия об оксидах Путешествие на остров Соединений химических элементов. Урок-игра
Путешествие на остров Соединений химических элементов. Урок-игра Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул Алюминий и его соединения
Алюминий и его соединения Растворы. (Лекция 7)
Растворы. (Лекция 7) Химические методы определения U, Pu, Th
Химические методы определения U, Pu, Th Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Химическое равновесие
Химическое равновесие d997-13229e5e
d997-13229e5e Типы химических реакций
Типы химических реакций Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Соли аммония
Соли аммония Минералогический состав почв
Минералогический состав почв Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Азотсодержащие органические соединения
Азотсодержащие органические соединения История развитии химии
История развитии химии Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Аллотропные модификации кремния
Аллотропные модификации кремния