Содержание
- 2. Лекция 1 Введение. Классификация физико-химический методов анализа. Электрохимические методы анализа. Потенциометрия (ионометрия)
- 3. Длительность ~ 50 ак. часов 8 лекций (неделя I, 1.5 ак. ч.) 8 семинаров (неделя I,
- 4. Цель курса Цель данного курса лекций - ознакомление с принципами физико-химических (инструментальных) методов анализа, чтобы ориентироваться
- 5. Задачи курса обобщить и систематизировать знания и представления о фундаментальных законах и основных методах исследования физико-химических
- 6. Литература Аналитическая химия и физико-химические методы анализа. В 2 т. Т. 1,2 :учеб. для студ. учреждений
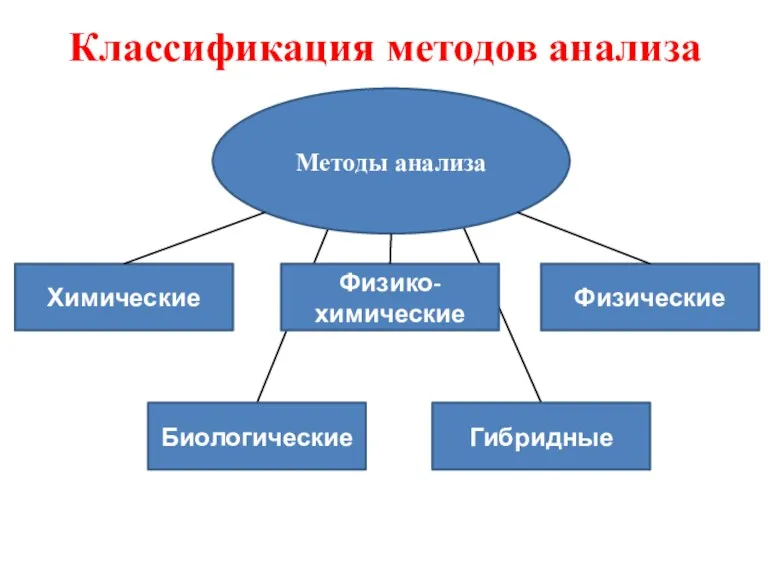
- 7. Классификация методов анализа Методы анализа Химические Физико-химические Физические Биологические Гибридные
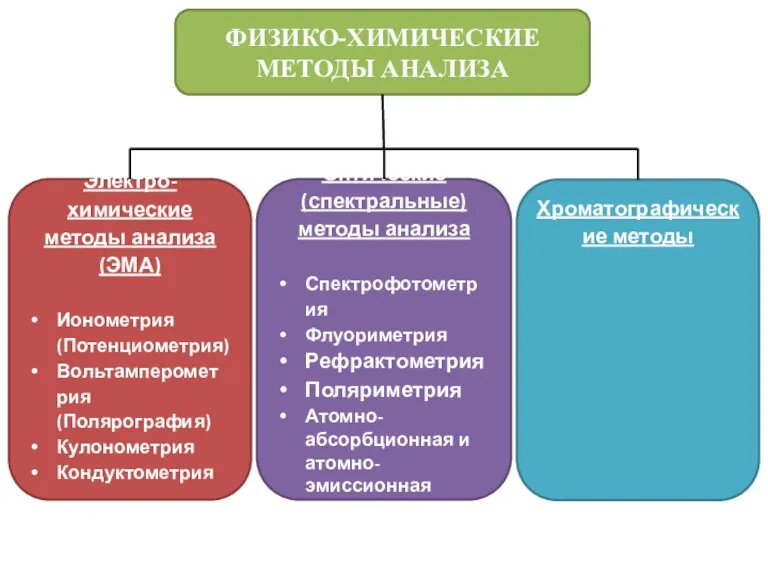
- 8. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Электро-химические методы анализа (ЭМА) Ионометрия (Потенциометрия) Вольтамперометрия (Полярография) Кулонометрия Кондуктометрия Оптические (спектральные) методы
- 9. Классификация электрохимических методов анализа (ЭХМА) в зависимости от измеряемого электрического параметра
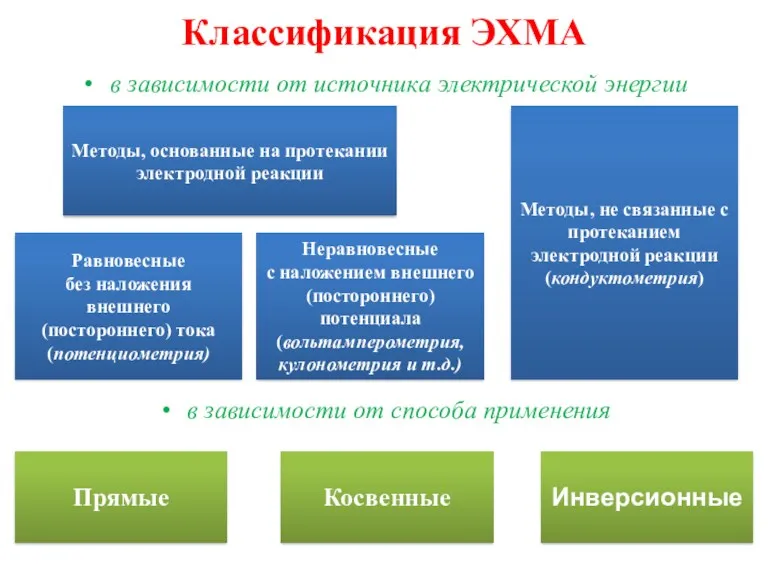
- 10. Классификация ЭХМА в зависимости от источника электрической энергии Методы, основанные на протекании электродной реакции Равновесные без
- 11. Основные понятия электрохимии ЭХМА основаны на реакциях на электродах, протекающих в электрохимической ячейке. Электрод — это
- 12. Гальванический элемент Даниэля-Якоби Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе: СuSO4 + Zn = ZnSO4 + Cu
- 13. Уравнение Нернста Потенциал любого электрода зависит от активности (концентрации) ионов, которые участвуют в электродной реакции, в
- 14. Стандартный водородный электрод Состоит из платиновой пластинки, покрытой слоем мелкозернистой платины – платиновой чернью Пластинка частично
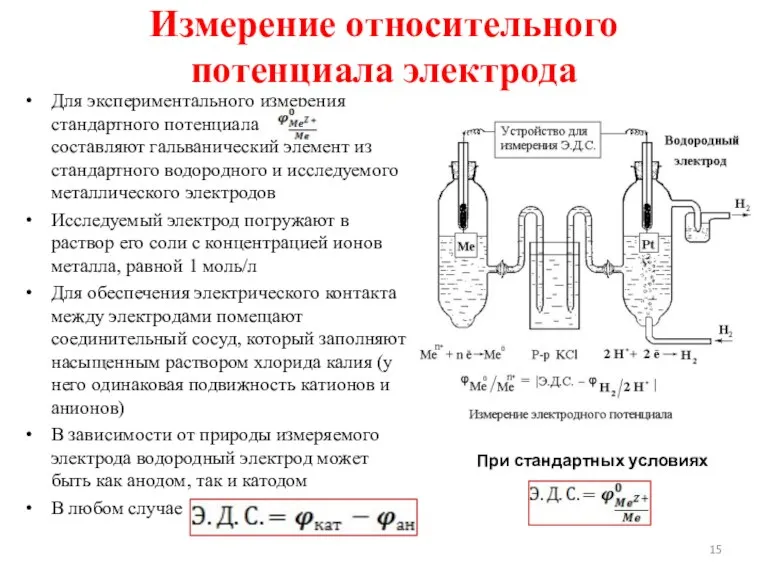
- 15. Измерение относительного потенциала электрода Для экспериментального измерения стандартного потенциала составляют гальванический элемент из стандартного водородного и
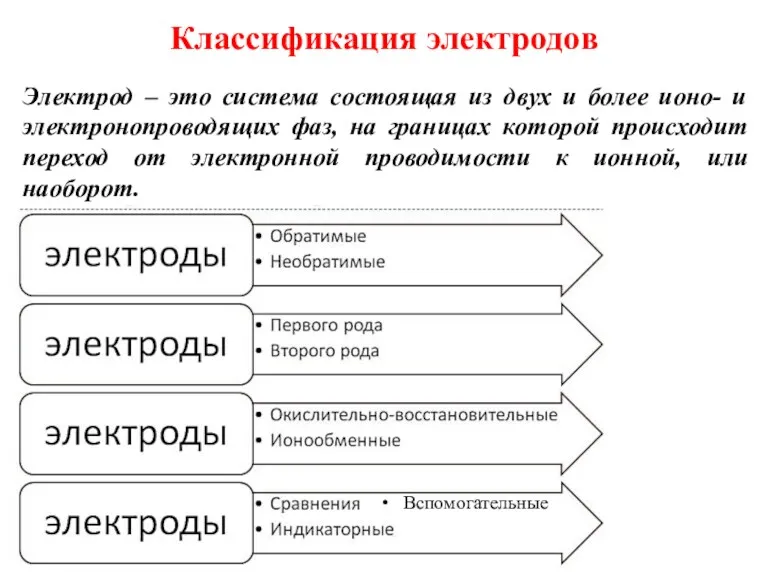
- 16. Классификация электродов Электрод – это система состоящая из двух и более ионо- и электронопроводящих фаз, на
- 17. Обратимые и необратимые электроды На обратимых электродах при изменении направления тока протекает та же реакция, но
- 18. Индикаторные и электроды сравнения По принципу применения электроды делят на индикаторные и электроды сравнения Индикаторными называют
- 19. Окислительно-восстановительные электроды (Электроды нулевого рода) Редокс-электроды – электроды, в которых процессы получения и отдачи электронов происходят
- 20. Электроды первого рода Электроды 1-го рода – металл в контакте с раствором своей соли Восстановленной формой
- 21. Электроды второго рода Электроды 2-го рода – металл, покрытый слоем его труднорастворимой соли, и погружённый в
- 22. Хлорсеребряный электрод Представляет собой серебряную проволоку, покрытую слоем АgСl, опущенную в насыщенный раствор КСl, находящийся в
- 23. Каломельный электрод Представляет собой смесь Нg и Нg2Сl2, помещенную в сосуд, в дно которого впаяна платина,
- 24. Ионометрия (потенциометрия) Потенциометрия — электрохимический метод исследования и анализа в-в, основанный на измерении электродного потенциала Е
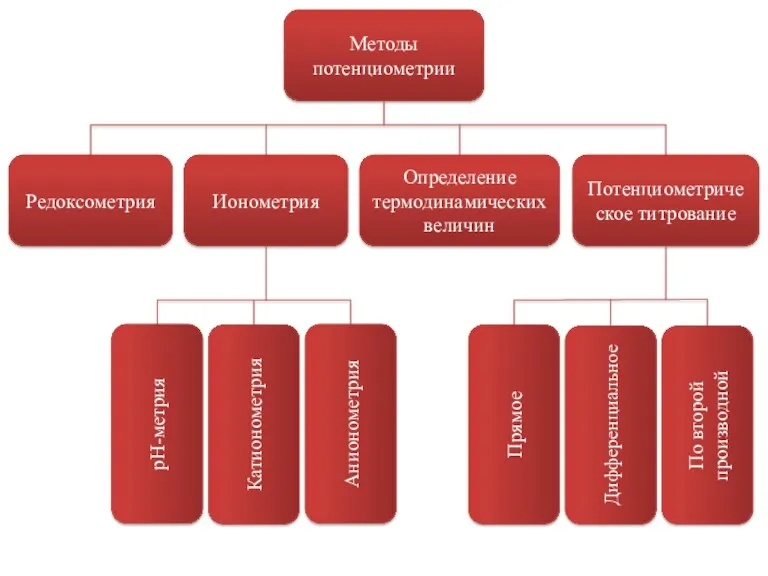
- 25. Методы потенциометрии Редоксометрия Ионометрия Определение термодинамических величин Потенциометрическое титрование Прямое Дифференциальное По второй производной pH-метрия Катионометрия
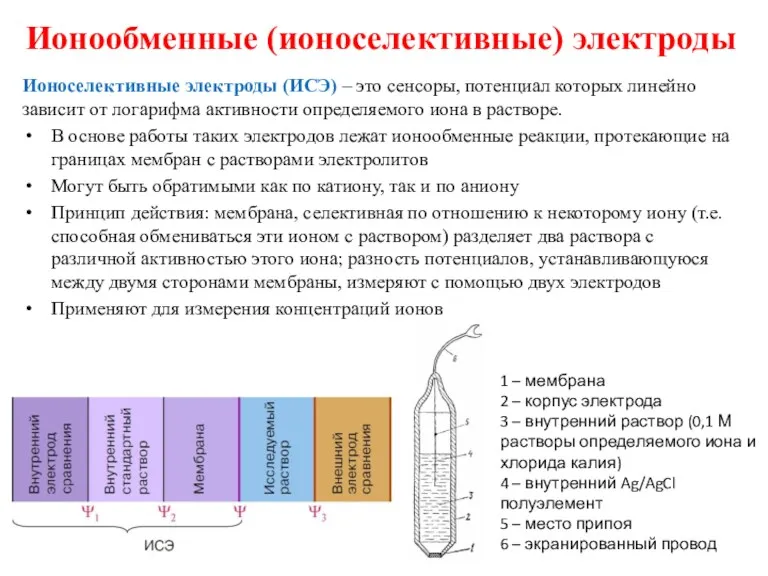
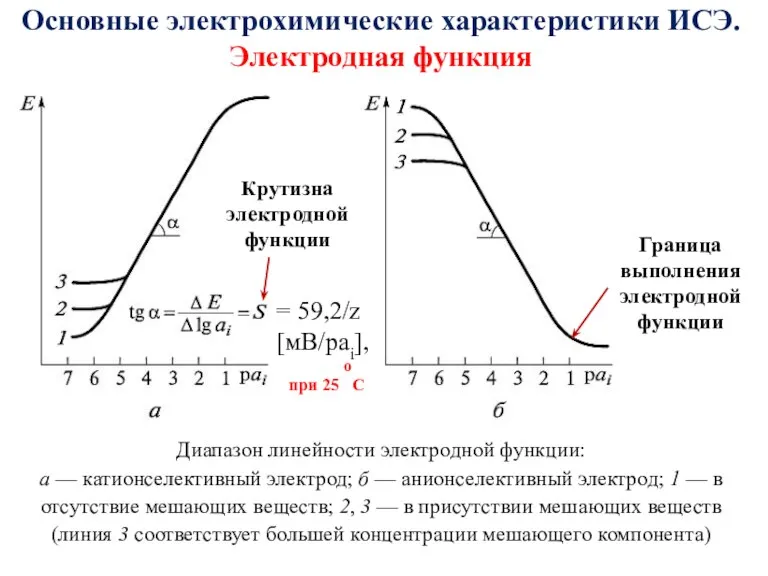
- 26. Ионообменные (ионоселективные) электроды Ионоселективные электроды (ИСЭ) – это сенсоры, потенциал которых линейно зависит от логарифма активности
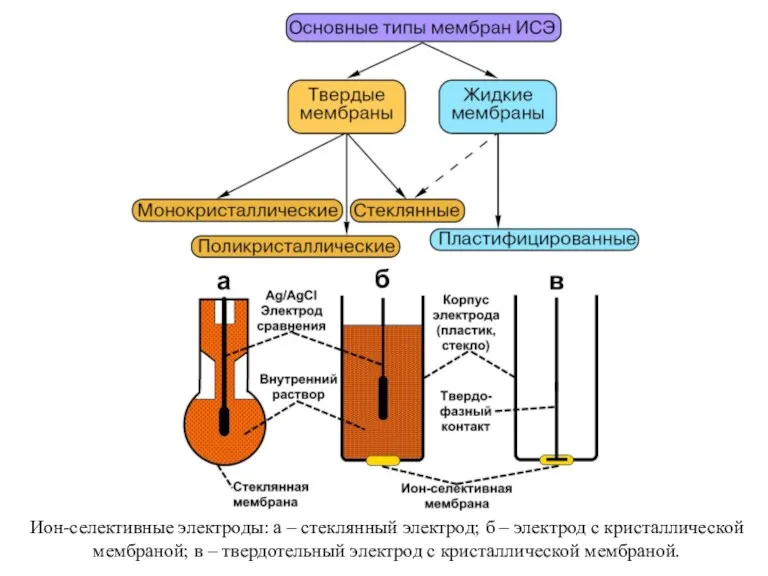
- 27. Ион-селективные электроды: а – стеклянный электрод; б – электрод с кристаллической мембраной; в – твердотельный электрод
- 28. Фриц Габер (1868-1934) СТЕКЛЯННЫЙ ЭЛЕКТРОД
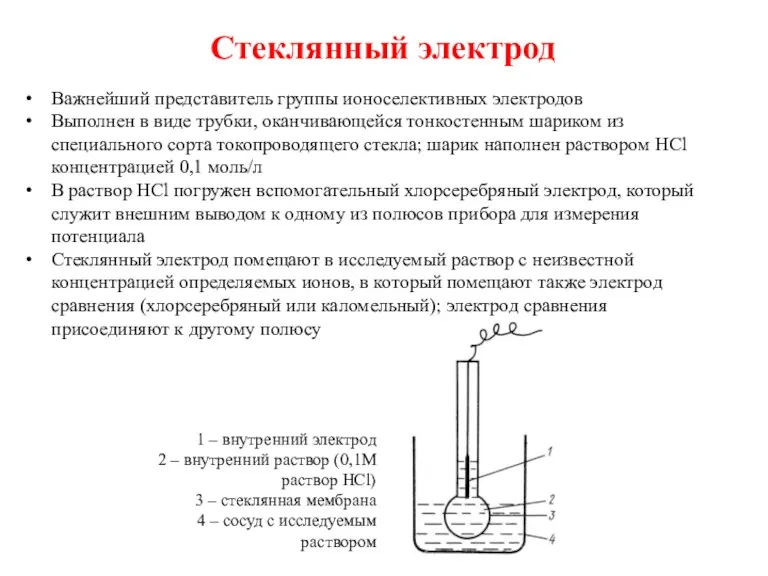
- 29. Стеклянный электрод Важнейший представитель группы ионоселективных электродов Выполнен в виде трубки, оканчивающейся тонкостенным шариком из специального
- 30. Гальванический элемент, в котором один из электродов стеклянный, включает два электрода сравнения (внутренний и внешний) Ag
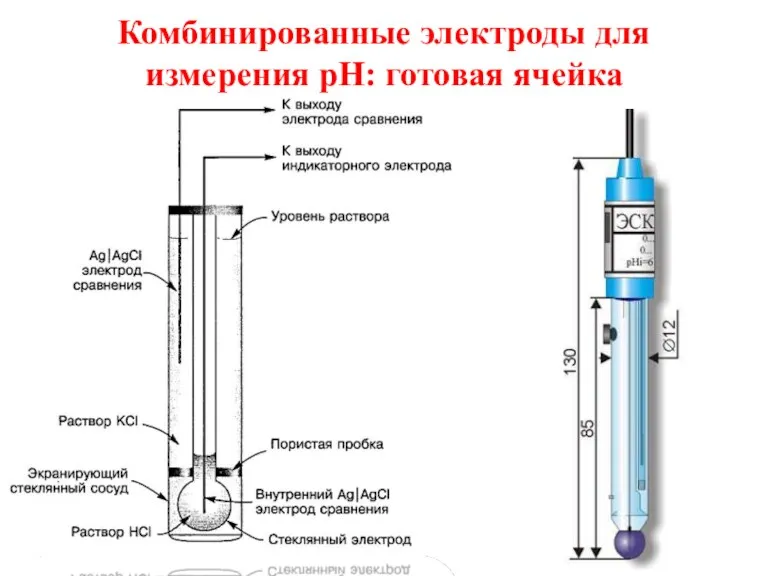
- 31. Комбинированные электроды для измерения pH: готовая ячейка
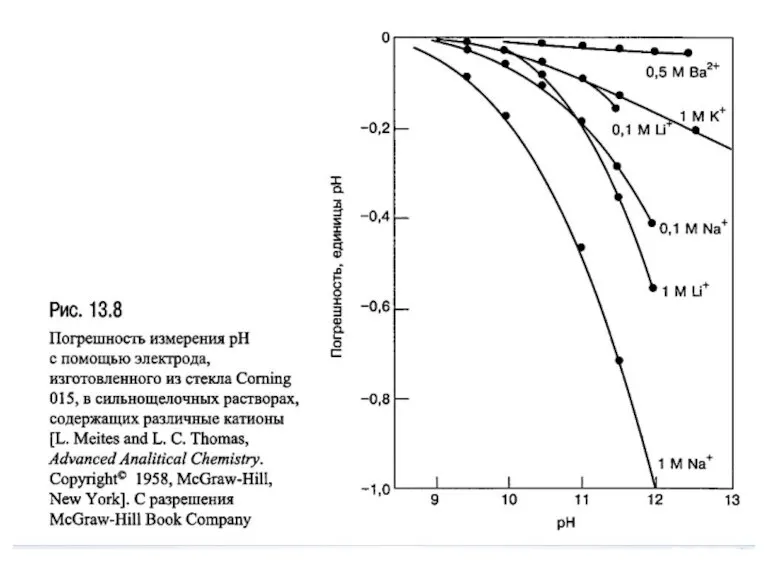
- 32. Щелочная и кислотная погрешность При измерении pH с помощью стеклянного электрода возникает два типа погрешностей (отклонение
- 34. Калибровка электродов Стандартный потенциал для каждого электрода имеет свою величину. Со временем эта величина меняется Электроды
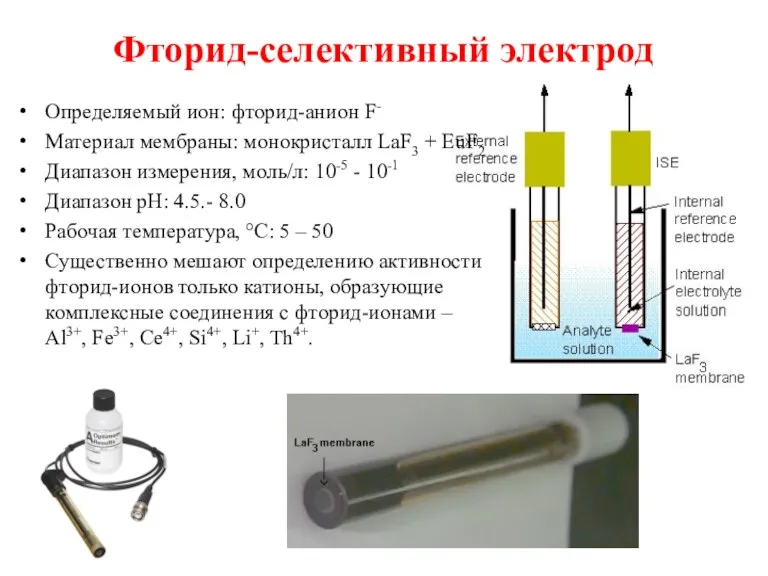
- 35. Фторид-селективный электрод Определяемый ион: фторид-анион F- Материал мембраны: монокристалл LaF3 + EuF2 Диапазон измерения, моль/л: 10-5
- 36. Буферный раствор общей ионной силы (БРОИС, англ. TISAB) Для обеспечения постоянства ионной силы (а также величины
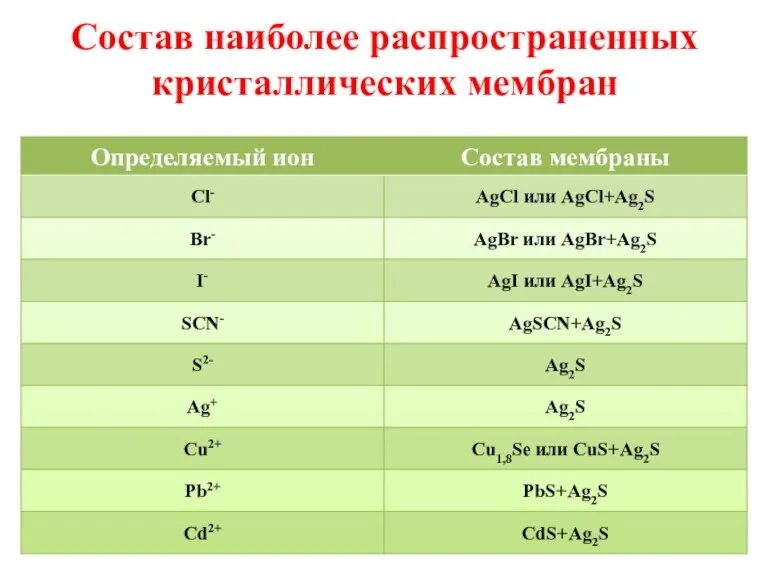
- 37. Электроды с (поли)кристаллическими мембранами Практическое значение имеет ионселективный электрод с мембраной из сульфида серебра, пригодный для
- 38. Состав наиболее распространенных кристаллических мембран
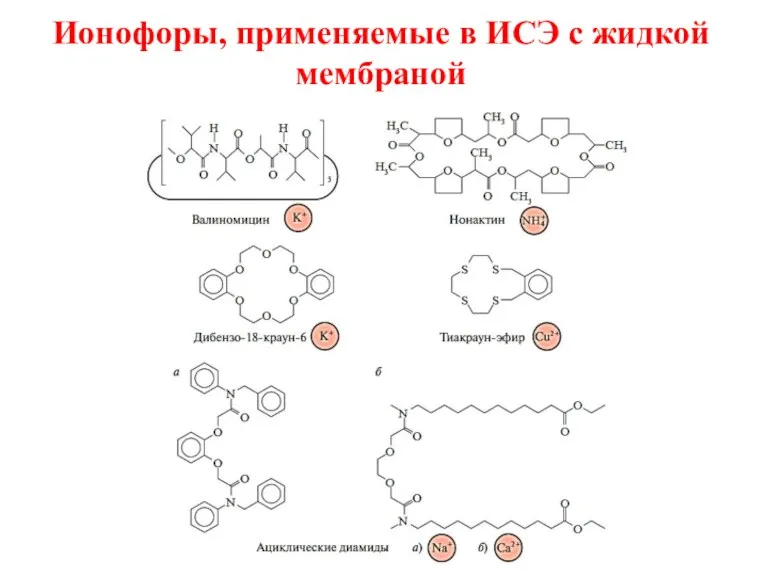
- 39. Жидкостные ионоселективные электроды Конструкция электродов с жидкими мембранами аналогична конструкции твердых мембранных электродов, только вместо твердой
- 40. Ионофоры, применяемые в ИСЭ с жидкой мембраной
- 41. Уравнение Никольского-Эйзенмана Мембрана ионоселективного электрода контактирует с растворами, содержащими определяемый ион. Активность (и концентрация) этого иона
- 42. Диапазон линейности электродной функции: а — катионселективный электрод; б — анионселективный электрод; 1 — в отсутствие
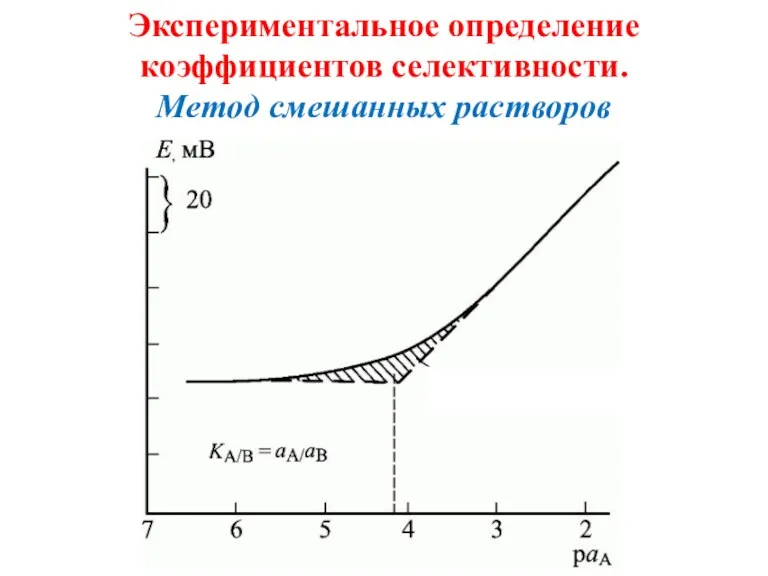
- 43. Потенциометрические коэффициенты селективности Коэффициенты селективности ионоселективных электродов Кi/j, где I и j соответствующие ионы отражают относительное
- 44. Экспериментальное определение коэффициентов селективности. Метод смешанных растворов
- 45. Экспериментальное определение коэффициентов селективности. Метод биионных растворов Метод 1а
- 46. Время отклика. Чувствительность ИСЭ Время отклика — это время достижения стационарного потенциала от момента погружения электрода
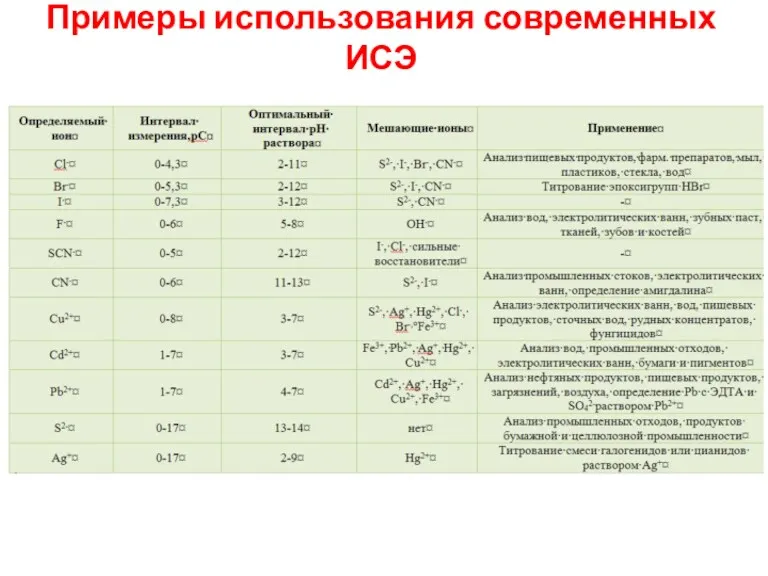
- 47. Примеры использования современных ИСЭ
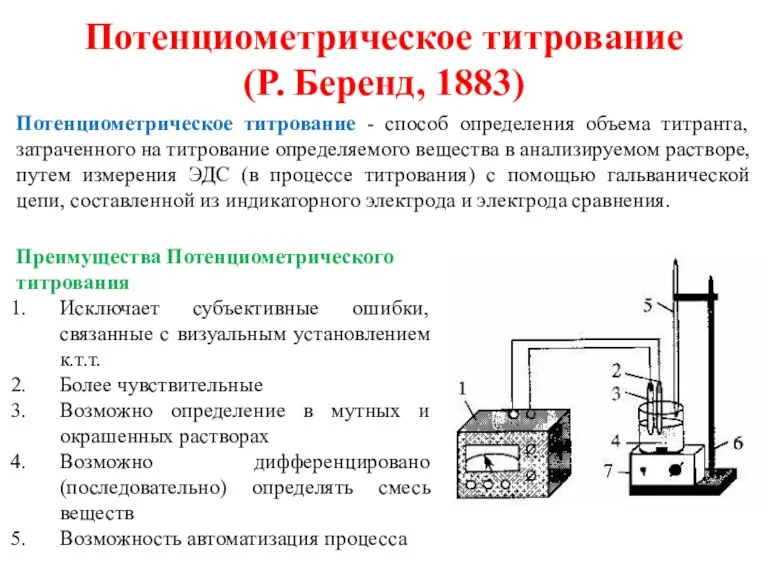
- 48. Потенциометрическое титрование (Р. Беренд, 1883) Потенциометрическое титрование - способ определения объема титранта, затраченного на титрование определяемого
- 50. Варианты потенциометрического титрования
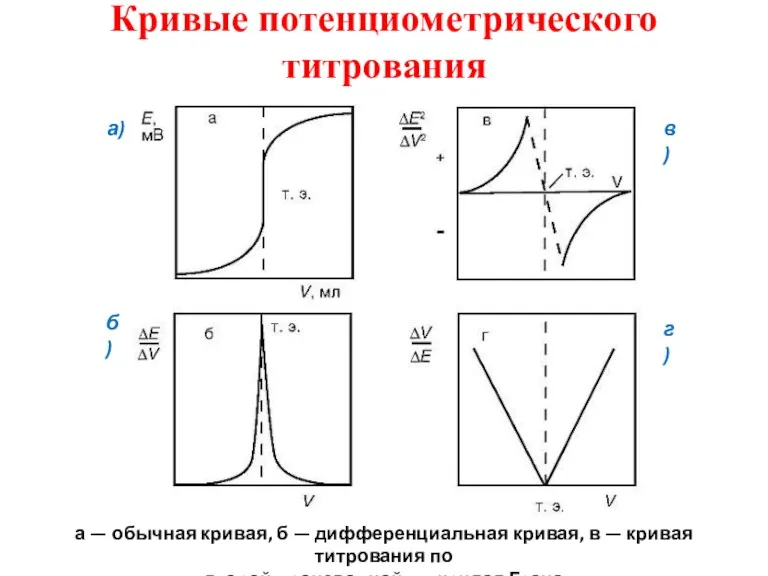
- 51. Кривые потенциометрического титрования а — обычная кривая, б — дифференциальная кривая, в — кривая титрования по
- 52. Применение потенциометрического титрования Метод является универсальным, его можно применять для индикации конца титрования во всех типах
- 53. Спасибо за внимание
- 55. Скачать презентацию

































 Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Жиры
Жиры Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Кислоты, содержащие серу (S)
Кислоты, содержащие серу (S) Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях ОВР в органической химии
ОВР в органической химии Классификация и свойства оксидов
Классификация и свойства оксидов Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Классификация химических реакций
Классификация химических реакций Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс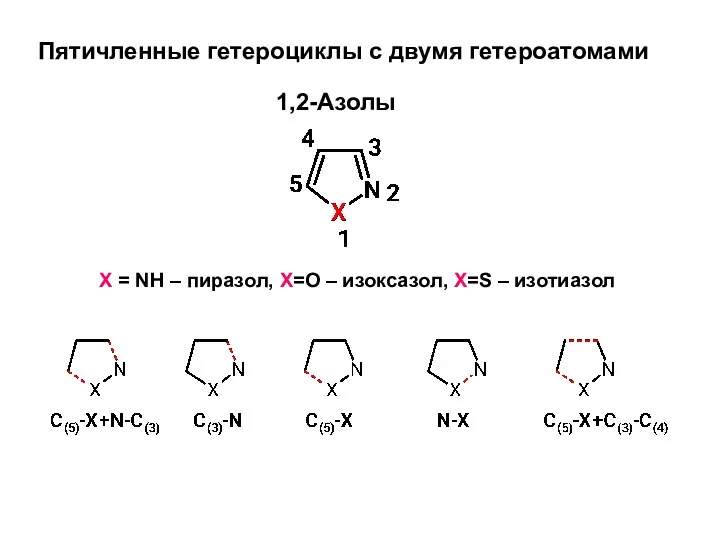 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Physiology lab
Physiology lab Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Периодическая система химических элементов. Знаки химических элементов
Периодическая система химических элементов. Знаки химических элементов Природный газ
Природный газ Застосування арт-терапевтичних технік на уроках хімії
Застосування арт-терапевтичних технік на уроках хімії Нефть и ее роль в мировой экономике
Нефть и ее роль в мировой экономике Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Швидкість хімічної реакції
Швидкість хімічної реакції Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Новые катализаторы
Новые катализаторы Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Металлы. Общая характеристика
Металлы. Общая характеристика Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса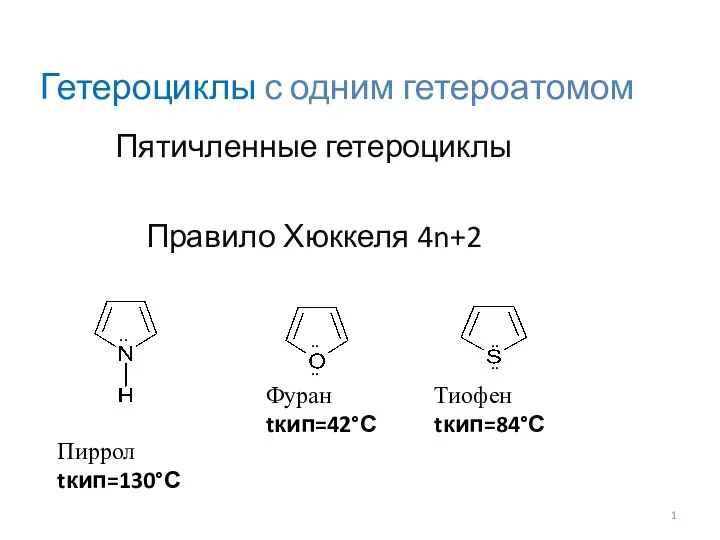 Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Химиялық тепе-теңдік
Химиялық тепе-теңдік