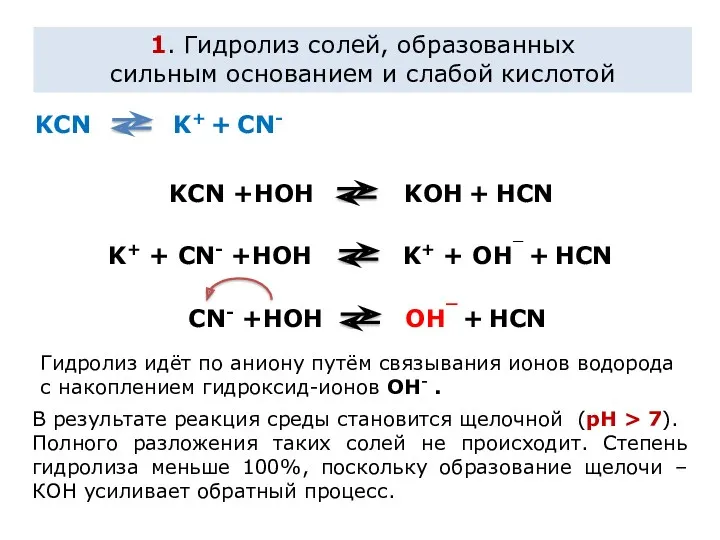
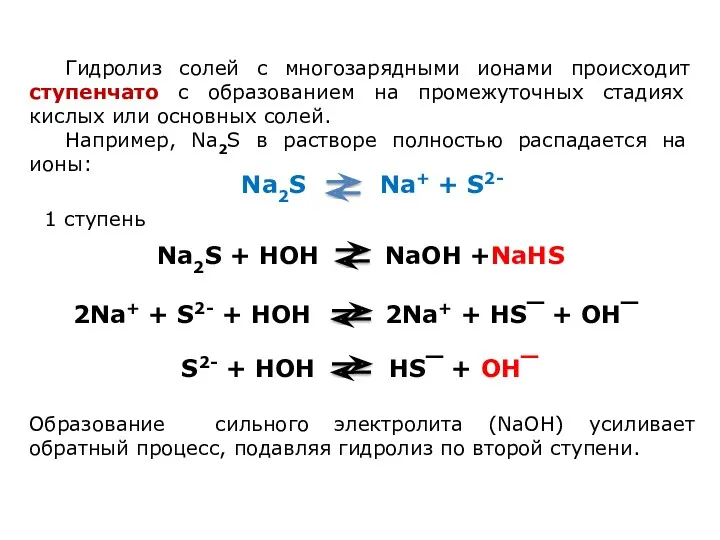
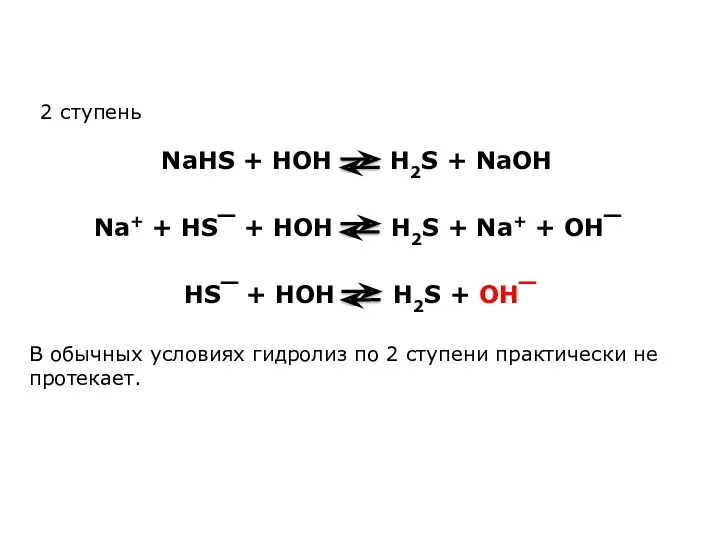
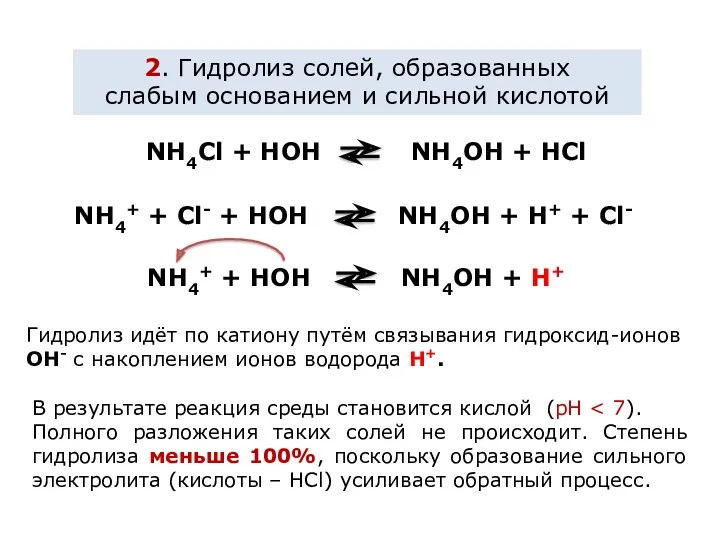
Влияние на равновесие при гидролизе солей.
Гидролиз солей - процесс обратимый и
протекает с поглощением тепла (эндотермически). При постоянных условиях наступает состояние равновесия, влияние на него подчиняется принципу Ле Шателье:
Если на систему, находящуюся в состоянии равновесия, оказано внешнее воздействие, то равновесие сместится таким образом, чтобы уменьшить оказанное воздействие.
Влияние температуры на степень гидролиза. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз - с поглощением теплоты. Выход эндотермических реакций с ростом температуры увеличивается, поэтому степень гидролиза растет с повышением температуры.
Кс = ехр[-∆H°(Т)/(RT) + ∆S/R].
Из данного выражения видно, что влияние температуры на равновесие определяется как абсолютным значением, так и знаком ∆H°(Т).





 Альдегиды и кетоны. Лекция 10
Альдегиды и кетоны. Лекция 10 Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях Химические свойства алканов
Химические свойства алканов Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Электронное строение атома
Электронное строение атома Белки. Строение
Белки. Строение Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя
химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Катионы І - ІІІ аналитических групп
Катионы І - ІІІ аналитических групп Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Минералы и горные породы
Минералы и горные породы Общая характеристика неметаллов
Общая характеристика неметаллов Методика обучения и воспитания на уроках химии
Методика обучения и воспитания на уроках химии Многоатомные и одноатомные спирты
Многоатомные и одноатомные спирты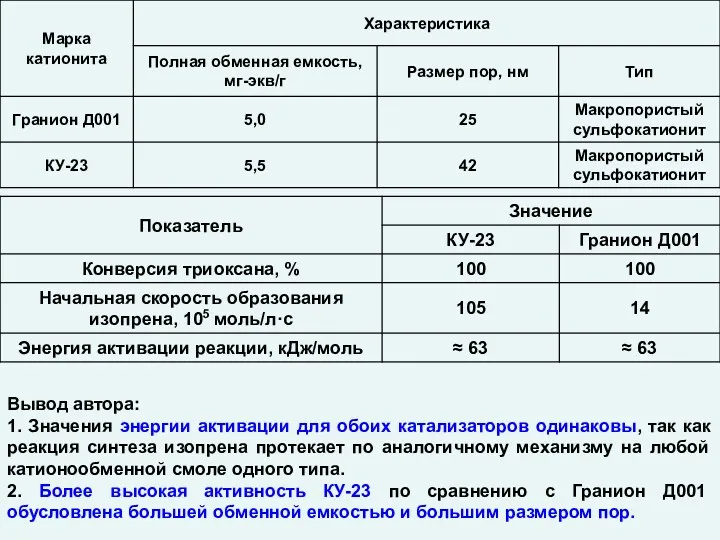 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Основы термодинамики
Основы термодинамики Химическая связь. 8 класс
Химическая связь. 8 класс Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс) Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Химические формулы. Относительная молекулярная масса вещества
Химические формулы. Относительная молекулярная масса вещества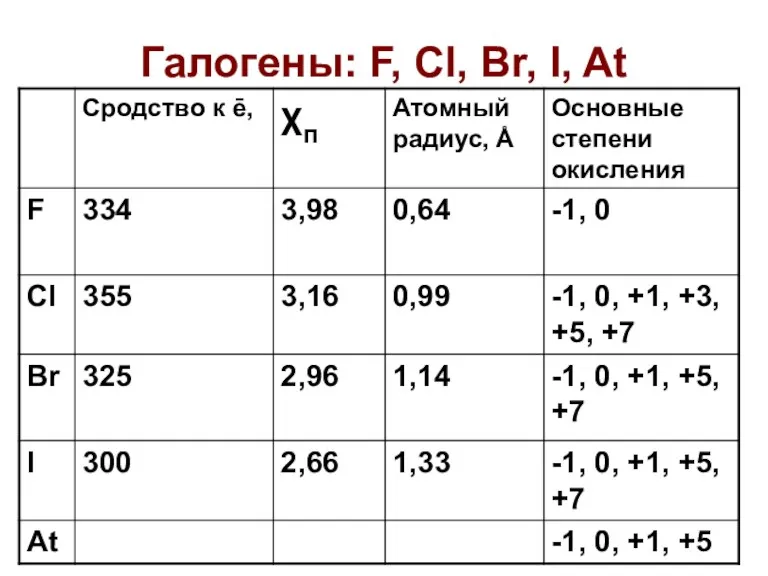 Галогены: F, Cl, Br, I, At
Галогены: F, Cl, Br, I, At Оксиды. Физические свойства
Оксиды. Физические свойства Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Химические свойства алканов
Химические свойства алканов Гипергенез и почвообразование
Гипергенез и почвообразование