Содержание
- 2. * Содержание: 1. Химический элемент. 2. Тренировочный материал для изучения знаков химических элементов. 3. Чтение химических
- 3. * Содержание: 12. Степень окисления. 13. Классификация неорганических веществ. 14. Кристаллические решетки. 15. Чистые вещества и
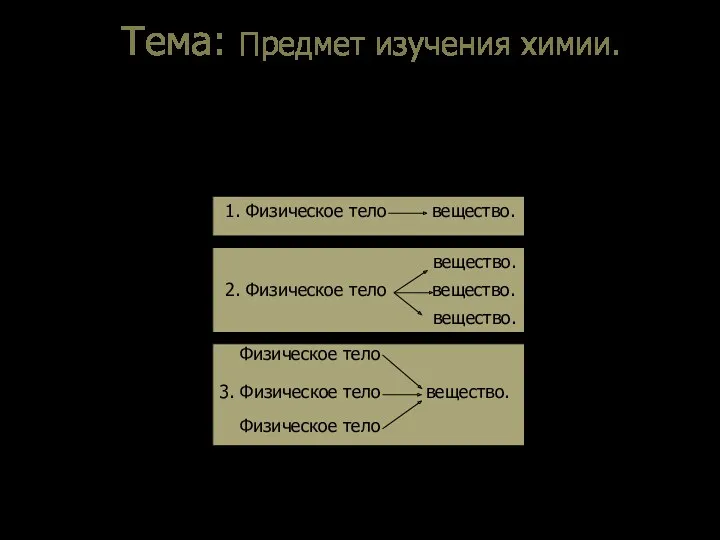
- 4. Тема: Предмет изучения химии. I. Науки. Науки делятся на: - гуманитарные - математические - естественные –
- 5. Тема: Предмет изучения химии. II. Вещества – это то, из чего состоят физические тела. * Примеры:
- 6. Тема: Предмет изучения химии. III. Свойства – это признаки по которым вещества схожи или отличаются друг
- 7. Тема: Предмет изучения химии. IV. Химия – наука о веществах, их свойствах и превращениях. * Домашнее
- 8. Тема: Превращения веществ. Роль химии в жизни человека. I. Физические и химические явления. * Явления –
- 9. Тема: Превращения веществ. Роль химии в жизни человека. II. Признаки химических явлений (реакций). * - Изменение
- 10. Тема: Превращения веществ. Роль химии в жизни человека. III. Роль химии в жизни человека. * -
- 11. Тема: Превращения веществ. Роль химии в жизни человека. Домашнее задание: выучить определения. & 2 Стр.12-18 *
- 12. Физические и химические явления
- 15. Физическое явление – это изменение состояния вещества или его формы Изменение формы гвоздя при ударе молотком
- 16. ФИЗИЧЕСКИЕ ЯВЛЕНИЯ это изменение состояния вещества формы вещества
- 18. Химическое явление – это процесс, в результате которого из одних веществ образуются другие начальное вещество -
- 19. ХИМИЧЕСКИЕ ЯВЛЕНИЯ это образование одного или нескольких новых веществ
- 20. Химические явления называются также химическими реакциями
- 21. ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ Выделение или поглощение энергии Изменение цвета Появление запаха Выделение газа Выпадение осадка
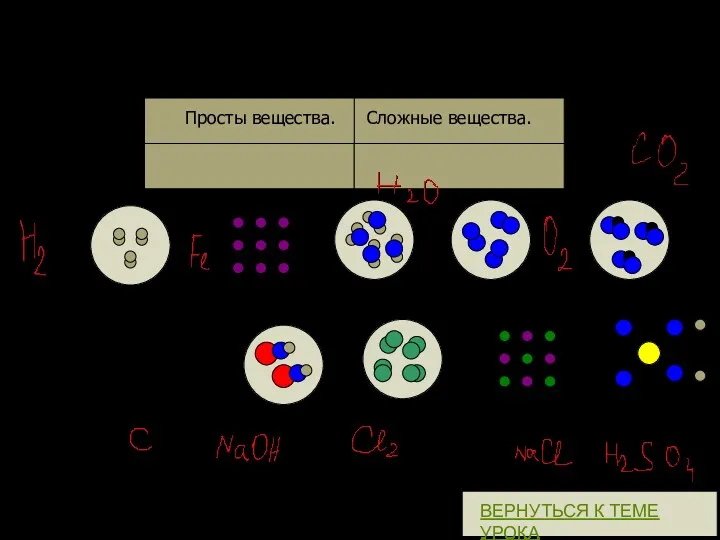
- 22. 1. Расположите вещества в два столбика. Просты вещества. Сложные вещества. Водород Железо Вода Кислород Углекислый газ
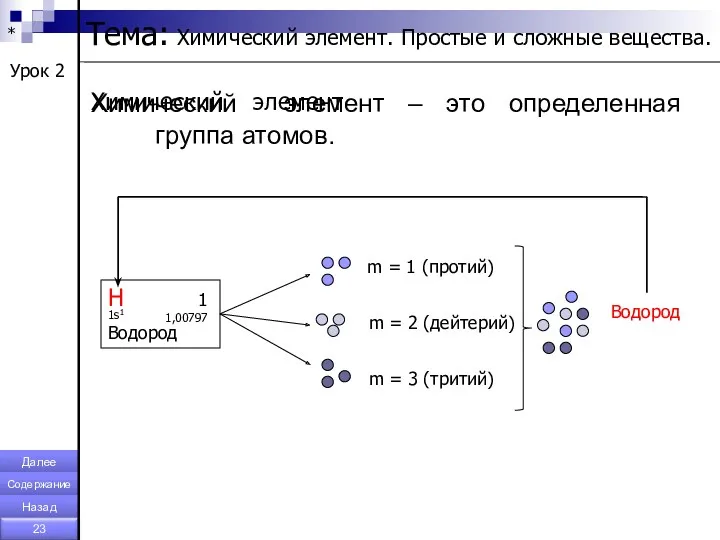
- 23. * Химический элемент – это определенная группа атомов. m = 1 (протий) m = 2 (дейтерий)
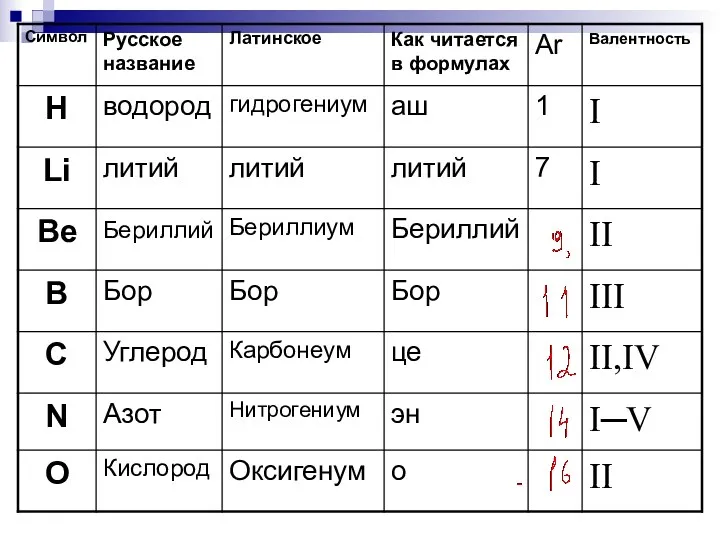
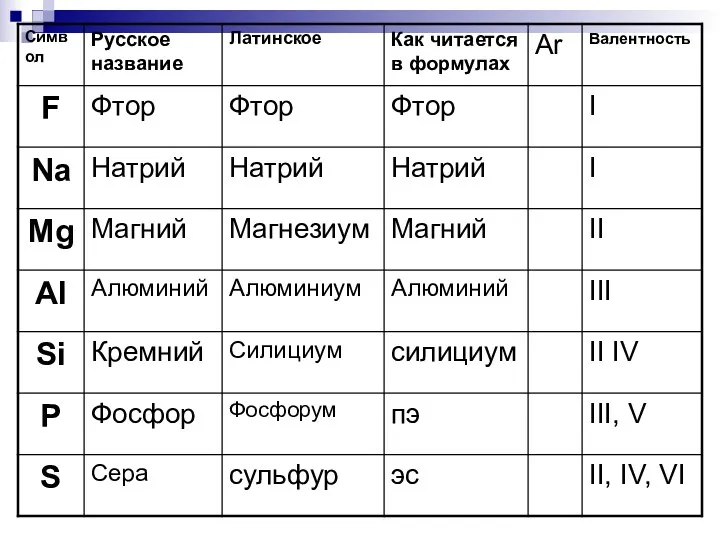
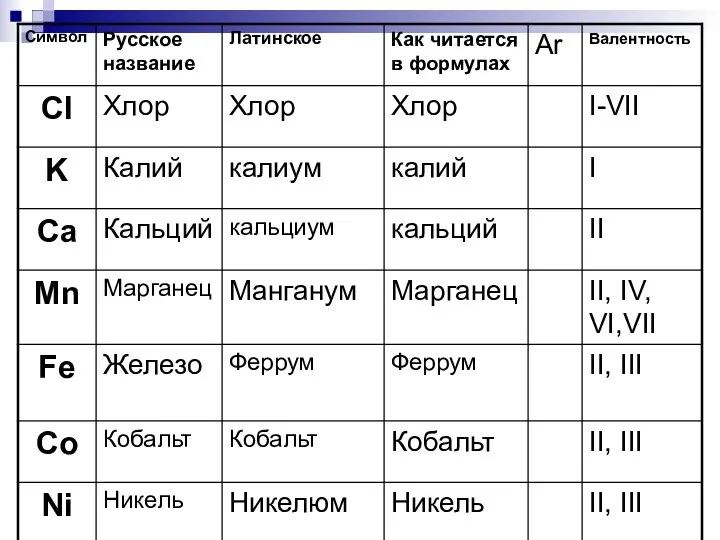
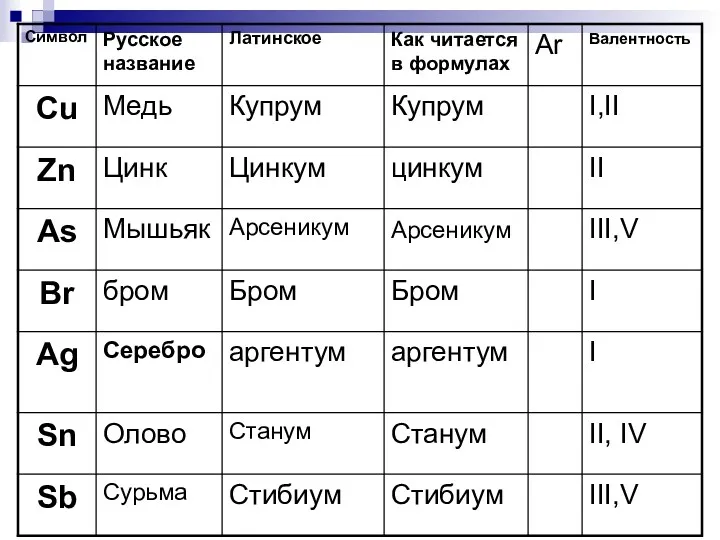
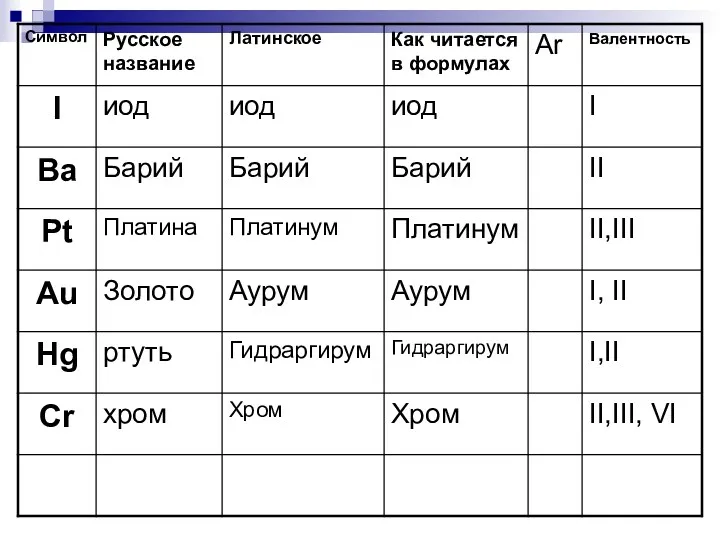
- 24. Символы
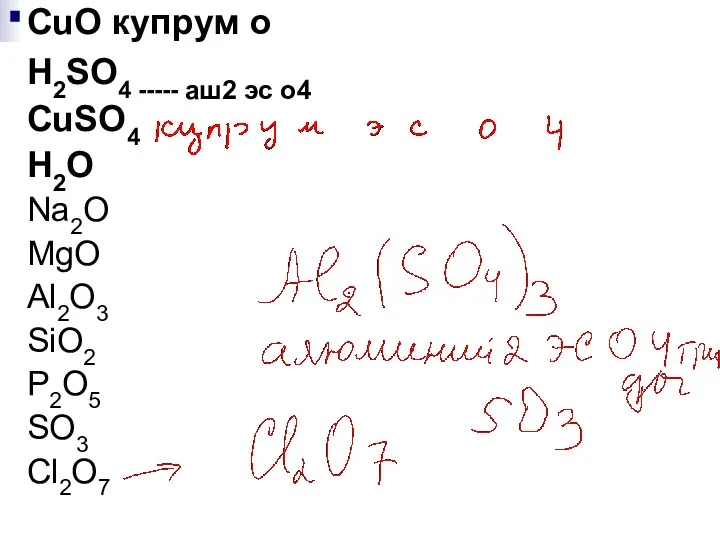
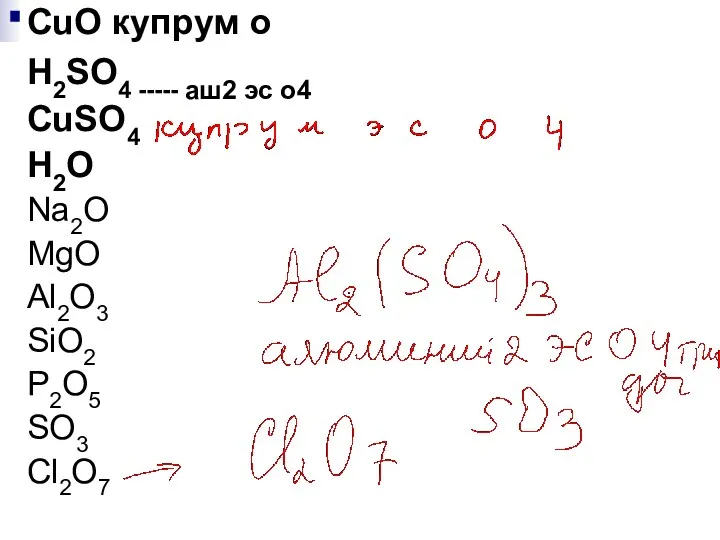
- 30. CuO купрум о H2SO4 ----- аш2 эс о4 CuSО4 H2O Na2O MgO Al2O3 SiO2 P2O5 SO3
- 33. CuO купрум о H2SO4 ----- аш2 эс о4 CuSО4 H2O Na2O MgO Al2O3 SiO2 P2O5 SO3
- 35. Тема: Химический элемент. Простые и сложные вещества. I. Строение вещества. Схема: Атом Молекула Вещество Физическое тело
- 36. Тема: Химический элемент. Простые и сложные вещества. II. Химический элемент – это определенная группа атомов. *
- 37. Тема: Химический элемент. Простые и сложные вещества. III. Простые вещества – это вещества состоящие из атомов
- 38. Тема: Химический элемент. Простые и сложные вещества. Домашняя задание: выучить определения. & 1 Стр.6-8 Упр.6 Стр.
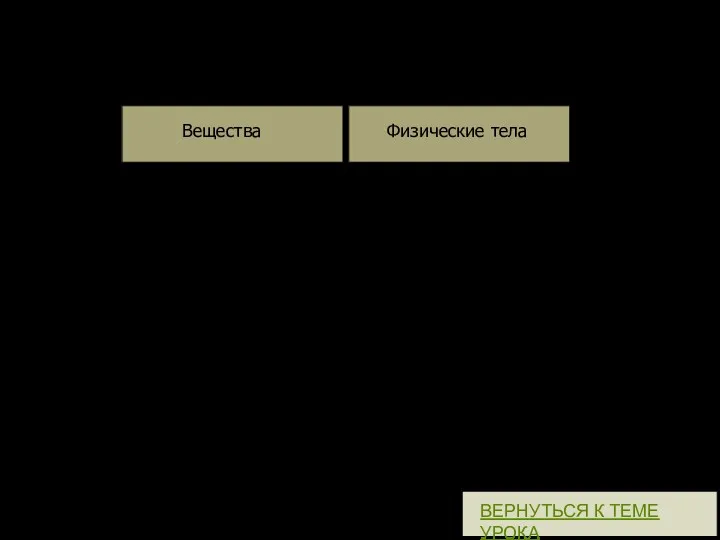
- 39. Расположите слова в два столбика. Вещества Физические тела Монета, пластмасса, медь, напильник, стакан, золото, карандаш, кислород,
- 40. * Урок 5-6 Тема: Строение периодической системы. Знаки химических элементов. Тренировочный материал к изучению знаков химических
- 41. Химический тренажер Химические элементы – металлы Химические элементы – неметаллы Упражнение
- 42. Выучи химические элементы - металлы Ag Mg Na Сu Al алюминий натрий магний медь серебро кальций
- 43. Выучи химические элементы - металлы Ag Mg Na Сu Al алюминий натрий магний медь серебро кальций
- 44. Проверь себя Ag Mg Na Сu Al алюминий К Са
- 45. Ag Mg Na Сu Al натрий К Са Проверь себя
- 46. Ag Сu Al магний Na Mg К Са Проверь себя
- 47. Mg Сu Al серебро Na Ag К Са Проверь себя
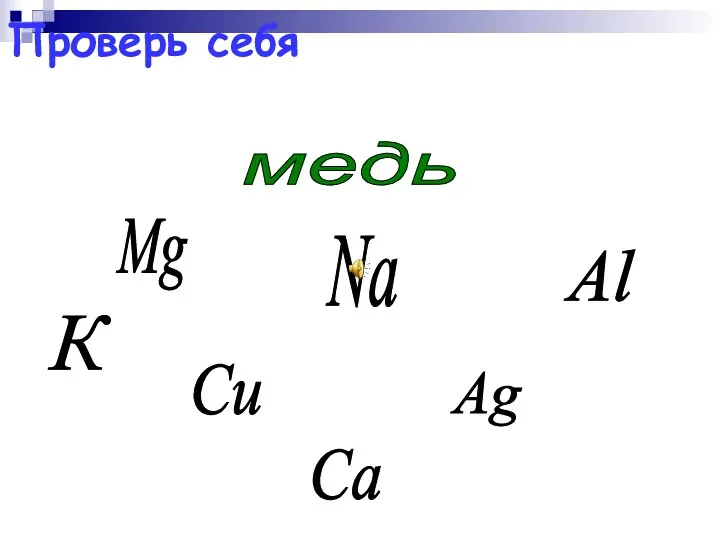
- 48. Mg Ag Al медь Na Сu К Са Проверь себя
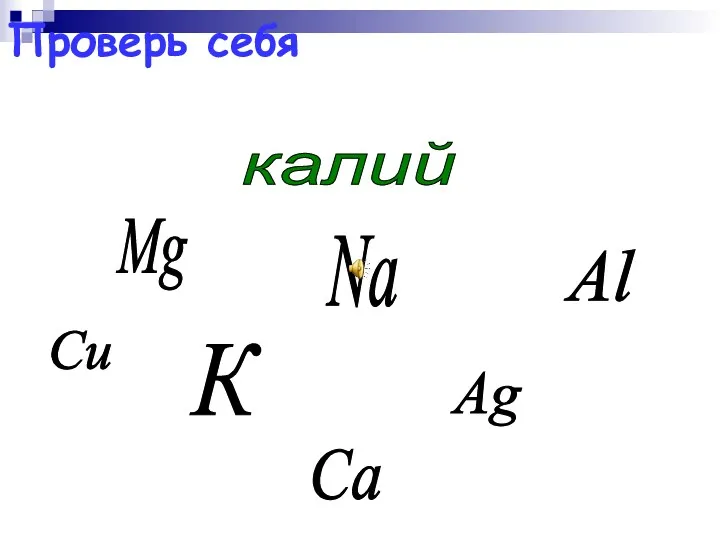
- 49. Mg Ag Al калий Na К Сu Са Проверь себя
- 50. Mg Ag Al кальций Na Са Сu К Проверь себя
- 51. Выучи химические элементы - неметаллы O N S Cl H водород сера азот хлор кислород углерод
- 52. Выучи химические элементы - неметаллы O N S Cl H водород сера азот хлор кислород углерод
- 53. Проверь себя фосфор
- 54. Проверь себя сера
- 55. Проверь себя хлор
- 56. Проверь себя водород
- 57. Проверь себя кислород
- 58. Проверь себя азот
- 59. Проверь себя углерод
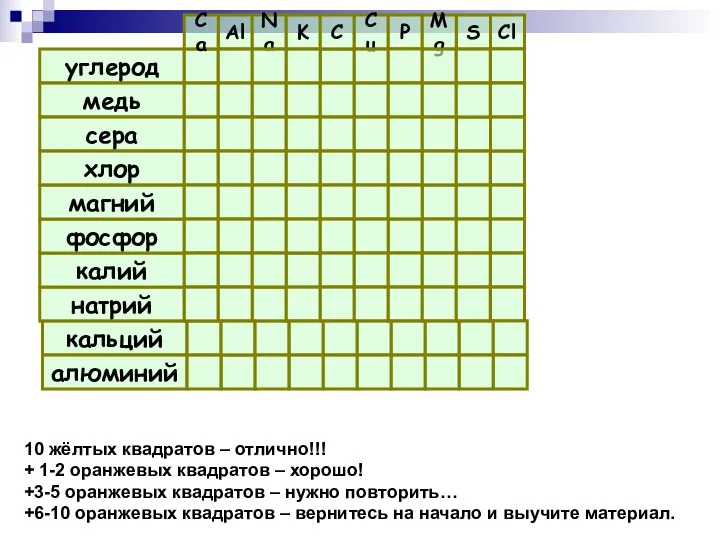
- 60. углерод медь сера хлор магний фосфор калий натрий кальций алюминий Al Na K C Cu P
- 61. * Тема: Химические формулы. Урок 7 Чтение химических формул. Примеры: NH3 – молекула эн аш три
- 62. CuO купрум о H2SO4 ----- аш2 эс о4 CuSО4 H2O Na2O MgO Al2O3 SiO2 P2O5 SO3
- 65. CuO купрум о H2SO4 ----- аш2 эс о4 CuSО4 H2O Na2O MgO Al2O3 SiO2 P2O5 SO3
- 67. * Урок 11 Составление химических формул по валентности. Правило нахождения валентности: - У металла валентность ставится
- 68. Классификация химических реакций
- 69. Химические реакции – химические процессы, в результате которых из одних веществ образуются другие отличающиеся от них
- 70. Химические реакции в неорганической химии
- 71. Химические реакции в неорганической химии
- 72. Химические реакции в неорганической химии 2. По числу и составу реагирующих веществ: 2.2. Реакции, идущие с
- 73. Химические реакции в неорганической химии 2. По числу и составу реагирующих веществ: 2. Реакции разложения –
- 74. Химические реакции в неорганической химии 2. По числу и составу реагирующих веществ: 3. Реакции замещения –
- 75. 4. Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями
- 76. Химические реакции в неорганической химии 3. По тепловому эффекту: 3.1. Экзотермические реакции: Экзотермические реакции – это
- 77. 2.1. Реакции, идущие без изменения состава веществ В неорганической химии к таким реакциям можно отнести процессы
- 78. Химические реакции в неорганической химии 1. По изменению степеней окисления химических элементов: Окислительно-восстановительные реакции: Окислительно-восстановительные реакции
- 79. Химические реакции в неорганической химии 1. По изменению степеней окисления химических элементов, образующих вещества: Окислительно-восстановительные реакции:
- 80. Химические реакции в неорганической химии 4. Обратимость процесса: 4.1. Необратимые реакции: Необратимые реакции протекают в данных
- 81. Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по
- 82. Химические реакции в неорганической химии 6. Наличие поверхности раздела фаз 6.1. Гетерогенные реакции: Гетерогенные реакции –
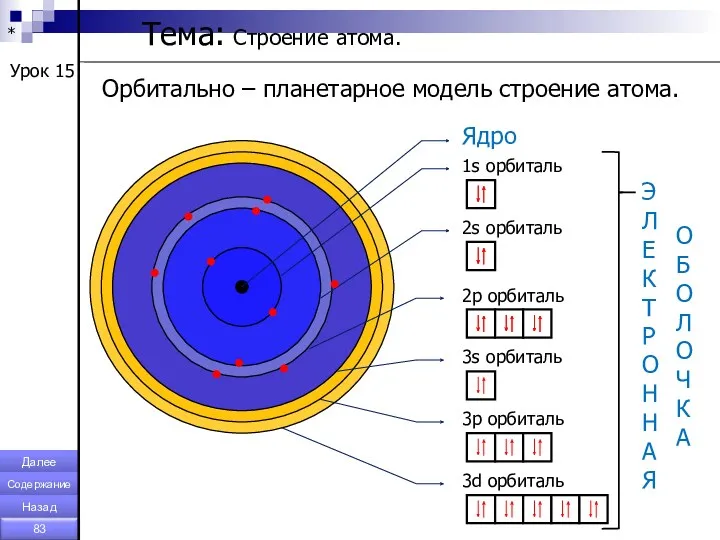
- 83. * Урок 15 Орбитально – планетарное модель строение атома. Тема: Строение атома. Ядро 1s орбиталь 2s
- 84. * Урок 17 Тема: Строение электронных оболочек атомов. Электронная оболочка – это совокупность электронов, двигающихся вокруг
- 85. * Урок 17 Тема: Строение электронных оболочек атомов. Электронная оболочка – это совокупность электронов, двигающихся вокруг
- 86. * Урок 18 Тема: Строение электронных оболочек атомов. - Энергетический уровень состоит из орбиталей. 2 8
- 87. Заполни электронные уровни элементов Для того чтобы заполнить уровни элементов необходимо щелкнуть мышкой по числу электронов,
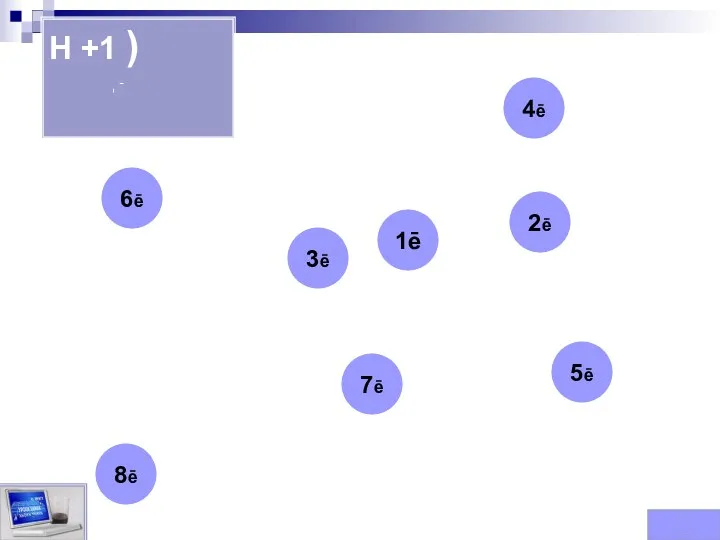
- 88. H +1 ) 1ē 1ē 2ē 3ē 4ē 5ē 6ē 7ē 8ē ⮊
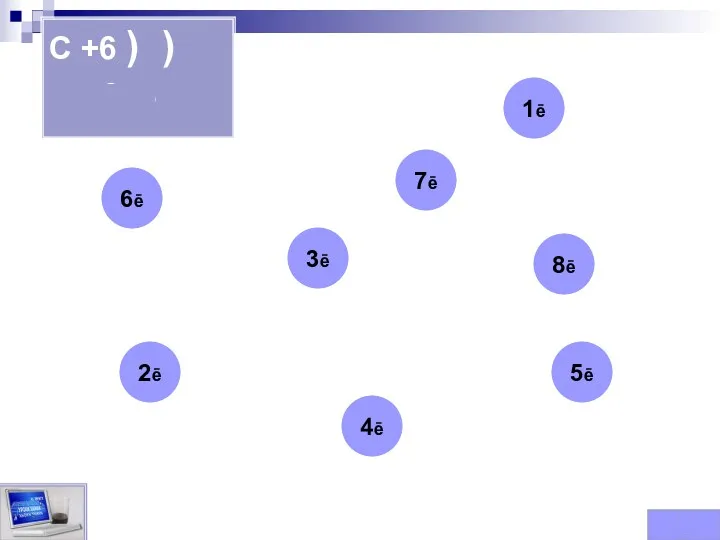
- 89. C +6 ) ) 2ē 4ē 4ē 2ē 3ē 1ē 5ē 6ē 7ē 8ē ⮊
- 90. Al+13 ) ) ) 2ē 8ē 3ē 2ē 1ē 3ē 4ē 5ē 6ē 7ē 8ē ⮊
- 91. Cl+17 ) ) ) 2ē 8ē 7ē 2ē 1ē 7ē 4ē 5ē 6ē 3ē 8ē ⮊
- 92. N+7 ) ) 2ē 5ē 2ē 1ē 3ē 4ē 8ē 6ē 7ē 5ē ⮊
- 93. S+16 ) ) ) 2ē 8ē 6ē 2ē 1ē 6ē 4ē 5ē 3ē 7ē 8ē ⮊
- 94. выход Спасибо за игру!
- 95. Формулировки периодического закона Свойства веществ находятся в периодической зависимости от величин атомных весов Свойства веществ находятся
- 96. Группа - вертикальные столбцы элементов сходные по своим химическим и физическим свойствам Основная подгруппа – в
- 97. Периоды – горизонтальные ряды элементов, которые начинаются щелочным металлом и заканчиваются инертным газом ( исключение 1
- 99. * Тема: Периодическое изменение свойств элементов и простых веществ. Проверка знаний Повторение I. В периодах слева
- 100. * Тема: Периодическое изменение свойств элементов и простых веществ. II. В группах сверху вниз: - число
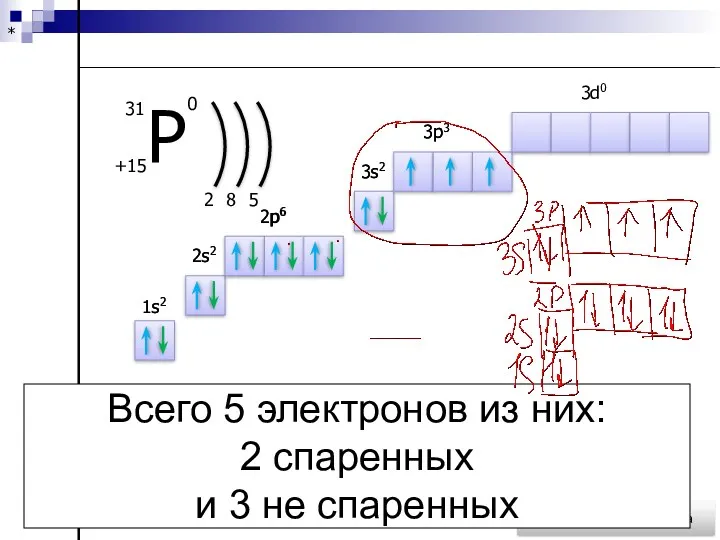
- 101. План характеристики элемента 1.Символ элемента Р 2.Порядковый номер 15 3.Атомная масса 31 4.Состав атома 15 31Р
- 102. * Вернуться к теме урока 2 8 5 1s2 1s2 2s2 2s2 2p6 2p6 3s2 3s2
- 103. 8.Металл, неметалл 9.Высший оксид P2O5 10.Для неметалла летучее водородное соединениеPH3
- 104. * Проверка знаний. Составить строение электронной оболочки элемента: Si
- 105. Тренажер по: Нахождению элемента в таблице Д.И.Менделеева Построению формул веществ По определению относительной атомной массы веществ.
- 106. По таблице Д.И.Менделеева найти элемент, расположенный в третьем периоде пятой группе главной подгруппе. © Осиевская И.А.
- 107. По таблице Д.И.Менделеева найти элемент, расположенный в четвёртом периоде второй группе побочной подгруппе. © Осиевская И.А.
- 108. По таблице Д.И.Менделеева найти элемент, расположенный в пятом периоде восьмой группе главной подгруппе. © Осиевская И.А.
- 109. Запишите в виде формул: Пять молекул вещества, состоящего из двух атомов элемента четвёртого периода, седьмой группы,
- 110. Запишите в виде формул: Три молекулы вещества, состоящего из одного атома элемента второго периода, пятой группы,
- 111. Запишите в виде формул: Две молекулы вещества, состоящего из двух атомов элемента третьего периода, первой группы,
- 112. Представьте расчеты относительной атомной массы вещества по образцу Для записи ответа Для записи решения 1 4
- 113. Определите молекулярную массу веществ и проверьте себя. Mr(HNO3) = 1 + 14 + 16 · 3
- 114. © Осиевская И.А. «Уроки химии с ИКТ» Если вы успешно отработали на тренажере, то можно приступать
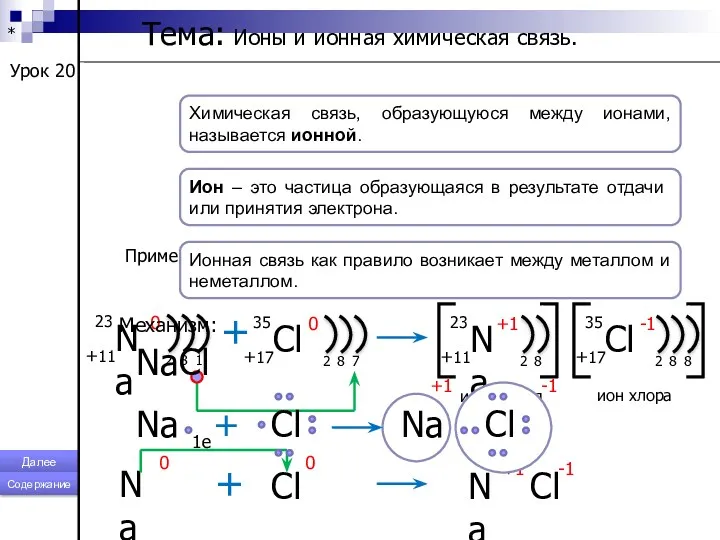
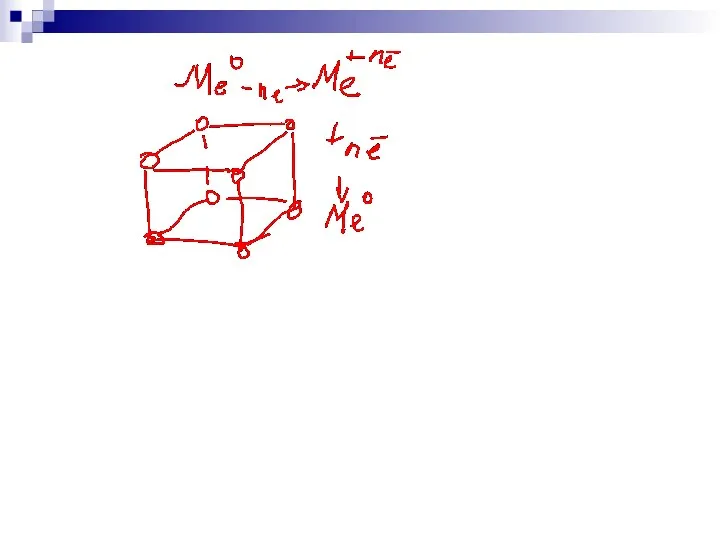
- 115. * Урок 20 Тема: Ионы и ионная химическая связь. Химическая связь, образующуюся между ионами, называется ионной.
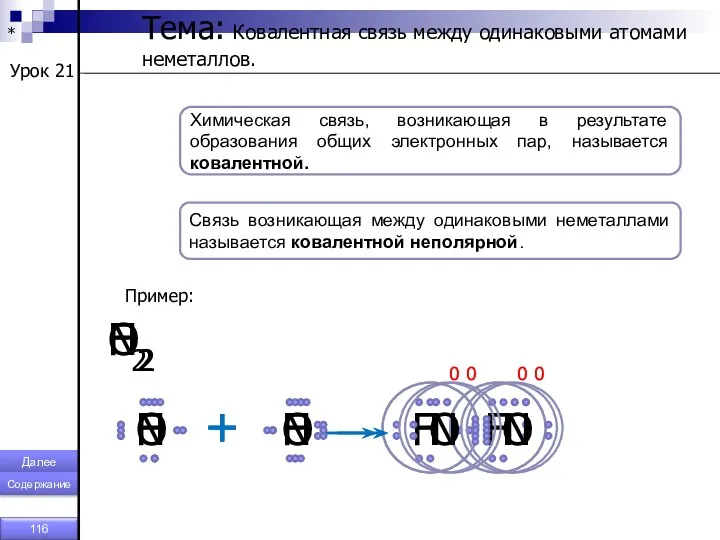
- 116. * Урок 21 Тема: Ковалентная связь между одинаковыми атомами неметаллов. Химическая связь, возникающая в результате образования
- 117. * Тема: Ковалентная полярная химическая связь. Химическая связь, возникающая в результате образования общих электронных пар, называется
- 118. Выберите формулы веществ с ковалентной полярной связью. Для удаления данного окна – щелкните по нему. Позвони
- 119. Br2 1 NaOH 3 H2O 2 N2 4 H2S 5 NH3 6 O2 7 HCl 8
- 120. http://img-fotki.yandex.ru/get/4411/47407354.287/0_8ef8c_20dd0fea_orig.png Иллюстрация: телефон http://www.altaikdm.ru/uploads/%D0%B7%D0%B5%D0%BB%D0%B5%D0%BD%D1%8B%D0%B9%20%D1%82%D0%B5%D0%BB%D0%B5%D1%84%D0%BE%D0%BD.jpg Иллюстрация: телефонная трубка http://mirhim.ucoz.ru
- 121. Г.О. Аствацатуров, г. Армавир Для работы презентации при открытии выберите в диалоговом окне – «Не отключать
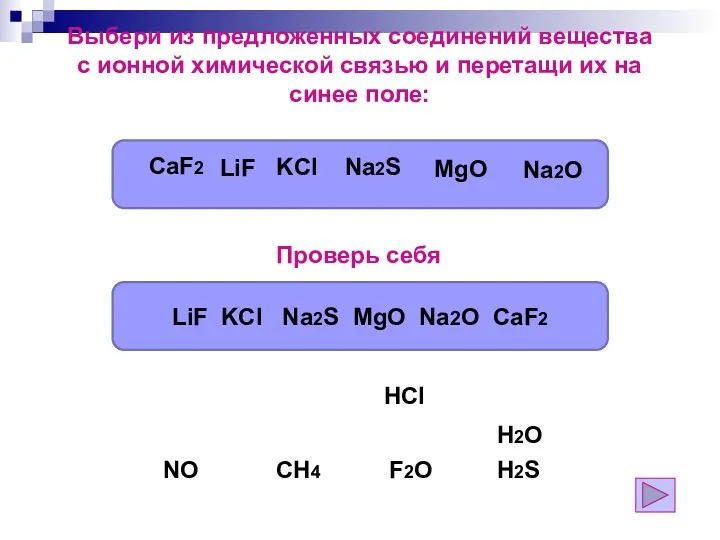
- 122. Выбери из предложенных соединений вещества с ионной химической связью и перетащи их на синее поле: HCl
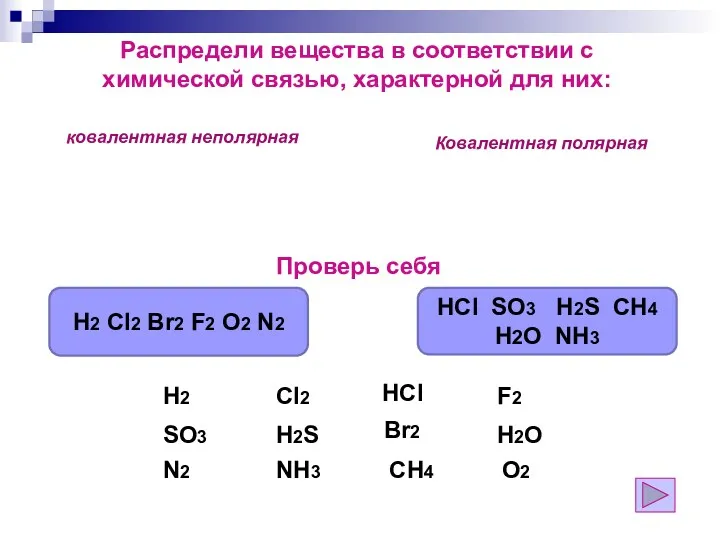
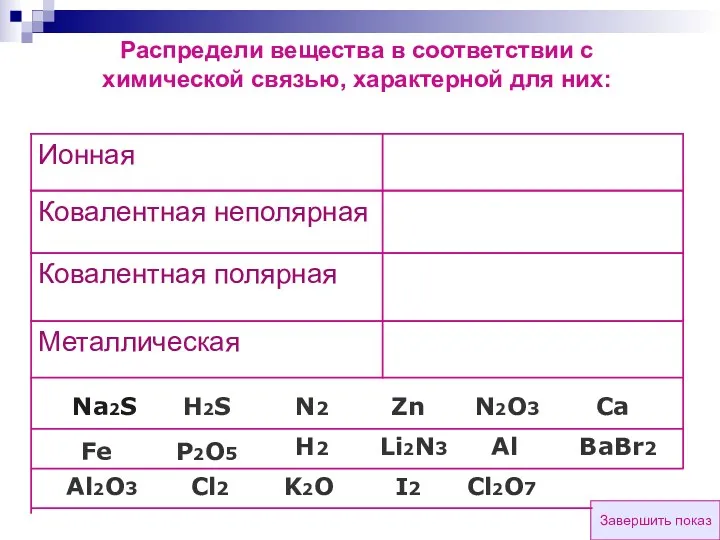
- 123. Распредели вещества в соответствии с химической связью, характерной для них: O2 Br2 F2 Cl2 SO3 H2O
- 124. Завершить показ BaBr2 Cl2 Al Na2S Распредели вещества в соответствии с химической связью, характерной для них:
- 128. * Тема: Молярный объем газов. Урок 31 Молярный объем (Vm) (л/моль). Vm – буквенное обозначение молярного
- 129. * Тема: Степень окисления. Урок 34 Степень окисления – это заряд приобретаемый элементом в соединении, в
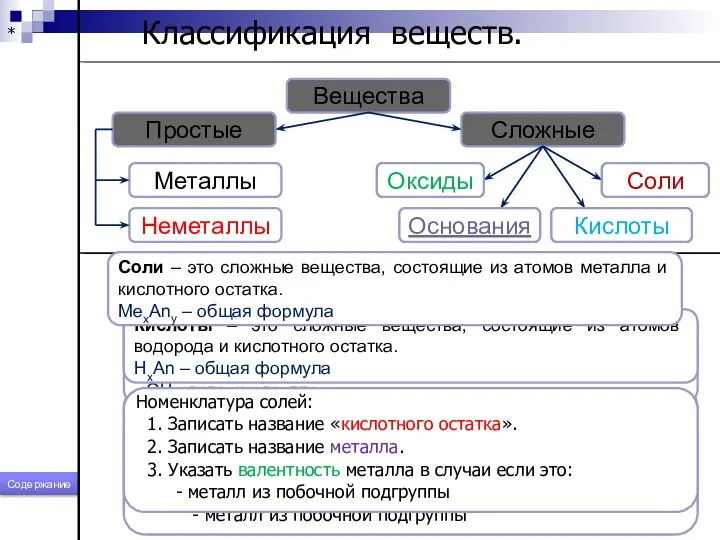
- 130. * Классификация веществ. Вещества Простые Сложные Оксиды Основания Соли Кислоты Металлы Неметаллы Оксиды Оксиды – это
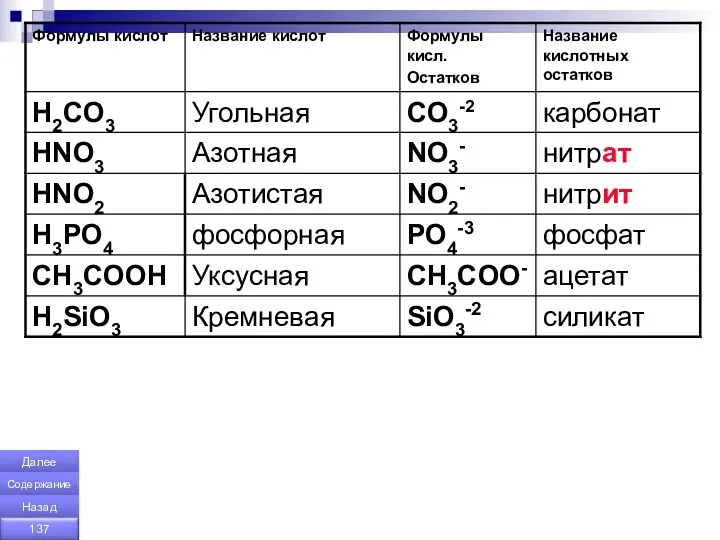
- 131. Кислоты Пильникова Н.Н. Содержание Назад
- 132. Сложные вещества, содержащие в своём составе кислотные остатки к которым присоединены атомы водорода способные замещаться на
- 133. Число атомов водорода способных замещаться с металлами в молекуле определяет основность кислоты. По количеству атомов водорода
- 134. Кислоты также делятся на Органические- кислоты образуемые живыми организмами. К ним относятся например этиловая и лимонная
- 135. По растворению в воде кислоты делятся на: растворимые(HCl) Нерастворимые(H2SiO3) В обычных условиях кислоты могут быть твёрдыми(H3PO4)
- 136. Далее Назад
- 137. Далее Содержание Назад
- 139. 1.Кислоты взаимодействуют с щелочами( а также с нерастворимыми основаниями, если получающая соль растворима в воде) с
- 140. 2.Кислоты реагируют с основными и амфотерными оксидами с образованием солей и воды: CuO+H2SO4=CuSО4+H2O Оксид меди +
- 141. 3. Кислоты взаимодействуют с металлами, стоящими в ряду напряжений до водорода. При этом металл вытесняет водород
- 142. Кислоты кислородсодержащие реагируют с металлами после водорода, без вытеснения водорода Cu+4HNO3→Cu(NO3)2+2H2O +2NO2 ↑ Медь +азотная кислота
- 143. 5. Кислоты реагируют с солями а)новая соль выпадает в осадок BaCl2+H2SO4=BaSO4↓+2HCL Хлорид бария + серная кислота
- 144. Б) образуется газообразное вещество 2HСl + Na2CO3 → H2O + CO2 ↑+ 2NaСl соляная кислота +
- 145. * Химические свойства кислот I. Если образуется осадок. BaCl2 + Na2SO4 ? BaSO4 + NaCl Ba2+
- 146. Кислородосодержащие кислоты получают в ходе реакции соответствующего оксида с водой: P2O5+H2O=2H3PO4 Путём вытеснения из соли более
- 147. оксиды Пильникова Н.Н. Содержание
- 148. Повторим Оксиды – это сложные вещества, состоящие из двух элементов, один из которых – кислород. Примеры
- 149. Названия оксидов Na2O - оксид натрия MgO – оксид магния Al2O3 – оксид алюминия SiO2 –
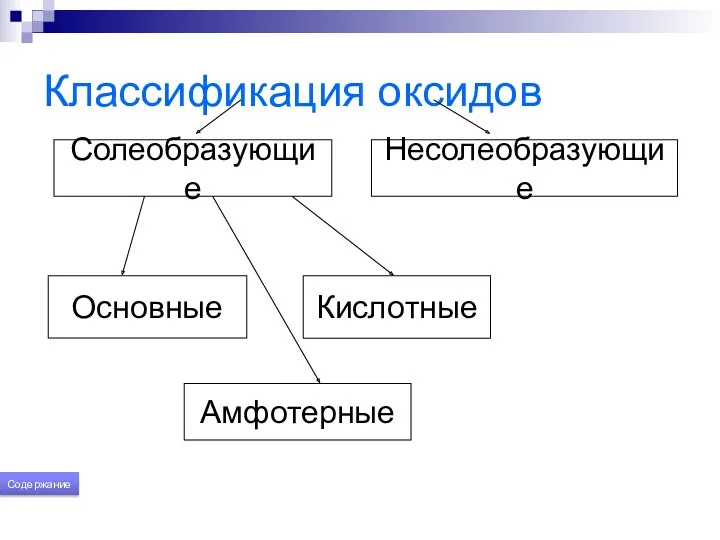
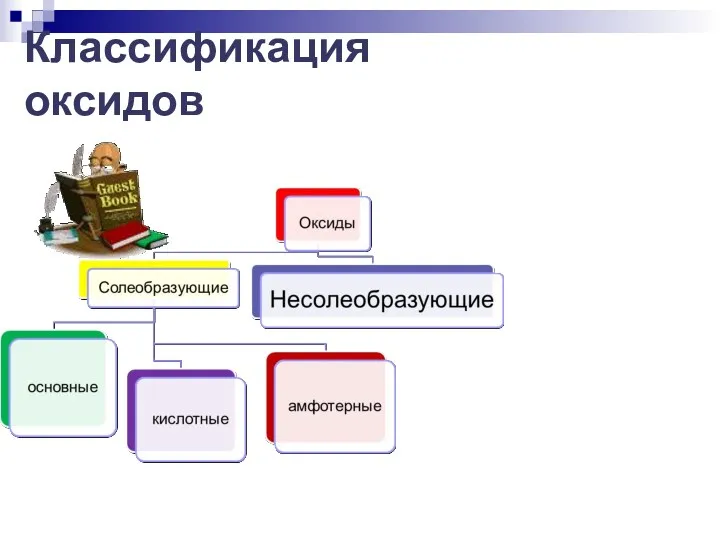
- 150. Классификация оксидов Солеобразующие Несолеобразующие Основные Кислотные Амфотерные Содержание
- 151. Получение оксидов В результате реакции горения: а) 2Са + О2 → 2СаО б) 4Li + O2
- 152. Физические свойства оксидов Цвет: разный; Агрегатное состояние: есть твёрдые, жидкие и газообразные Далее Содержание Назад
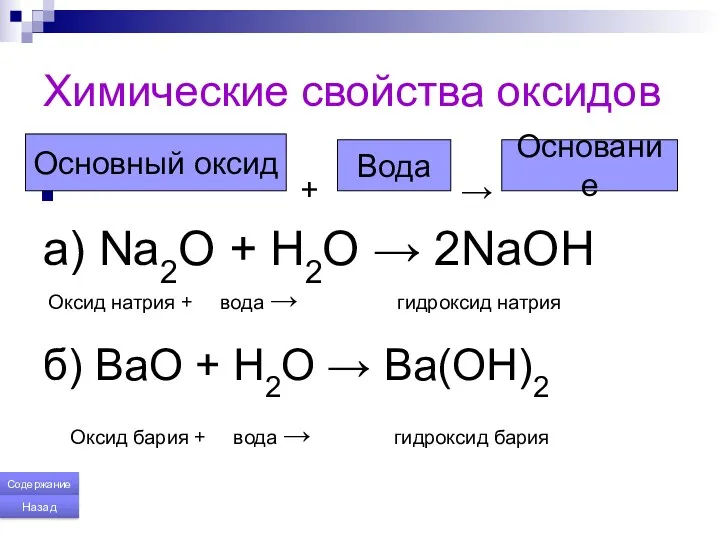
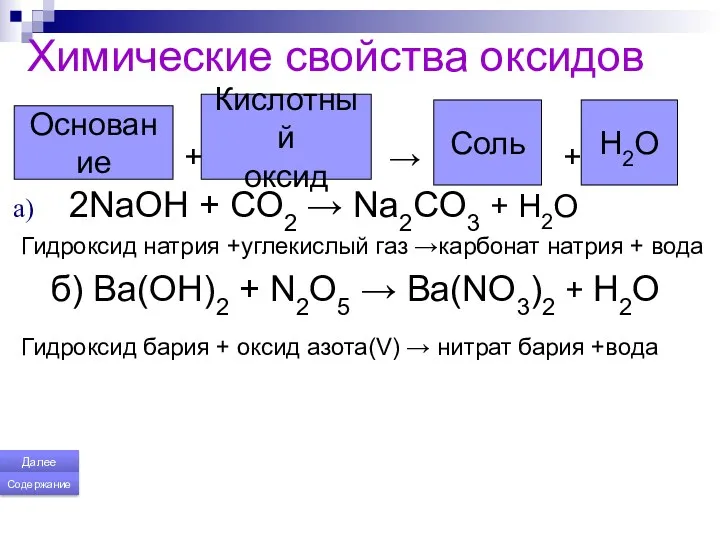
- 153. Химические свойства оксидов + → а) Na2O + H2O → 2NaOH Оксид натрия + вода →
- 154. Химические свойства оксидов + → + a) Ag2O + 2HNO3 → 2AgNO3 + H2O Оксид серебра
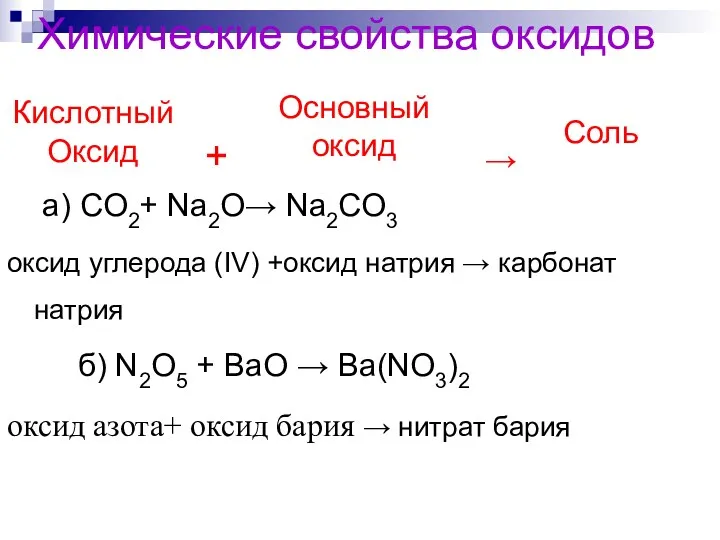
- 155. Химические свойства оксидов + → а) Na2O + CO2 → Na2CO3 оксид натрия +оксид углерода (ΙV)→
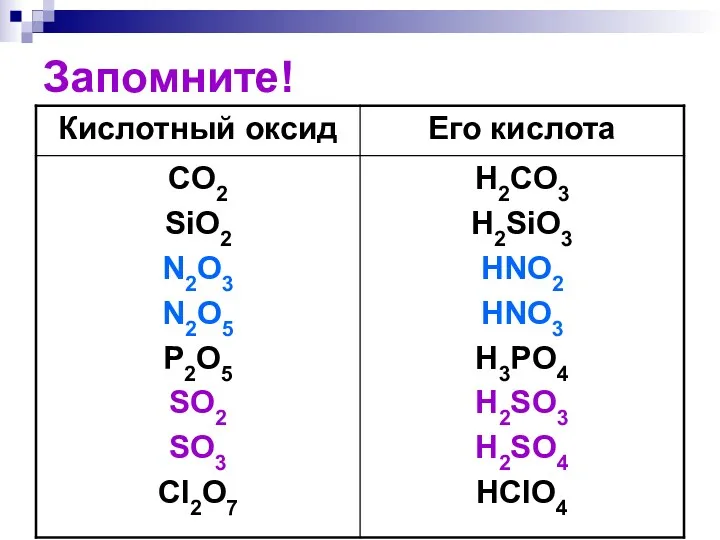
- 156. Запомните!
- 157. Химические свойства оксидов + → а) СO2 + H2O → Н2СO3 Углекислый газ + вода →
- 158. Химические свойства оксидов + → + 2NaOH + CO2 → Na2CO3 + H2O Гидроксид натрия +углекислый
- 159. Химические свойства оксидов + → а) CO2+ Na2O→ Na2CO3 оксид углерода (ΙV) +оксид натрия → карбонат
- 160. Соли Пильникова Н.Н. Далее Содержание Назад
- 163. Повторим С точки зрения теории электролитической диссоциации… Соли – это электролиты, диссоциирующие на катионы металла и
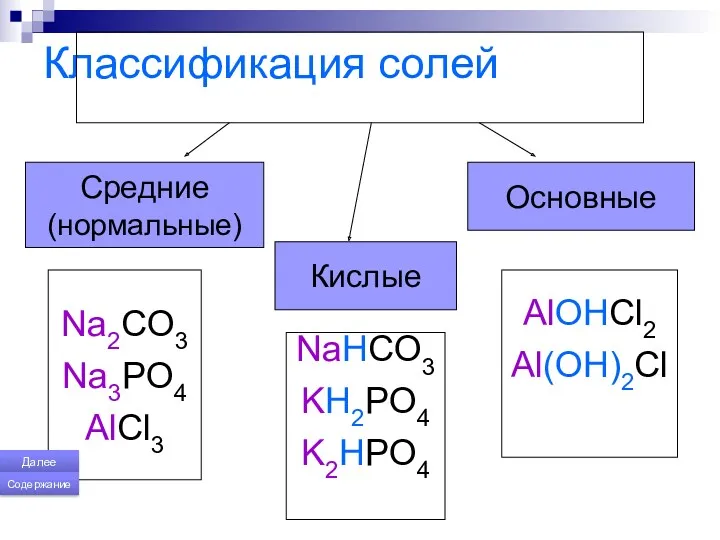
- 164. Классификация солей Средние (нормальные) Основные Na2CO3 Na3PO4 AlCl3 Кислые NaHCO3 KH2PO4 K2HPO4 AlOHCl2 Al(OH)2Cl Далее Содержание
- 165. Физические свойства солей Цвет: разный; Агрегатное состояние: твёрдые; По растворимости в воде есть растворимые, малорастворимые и
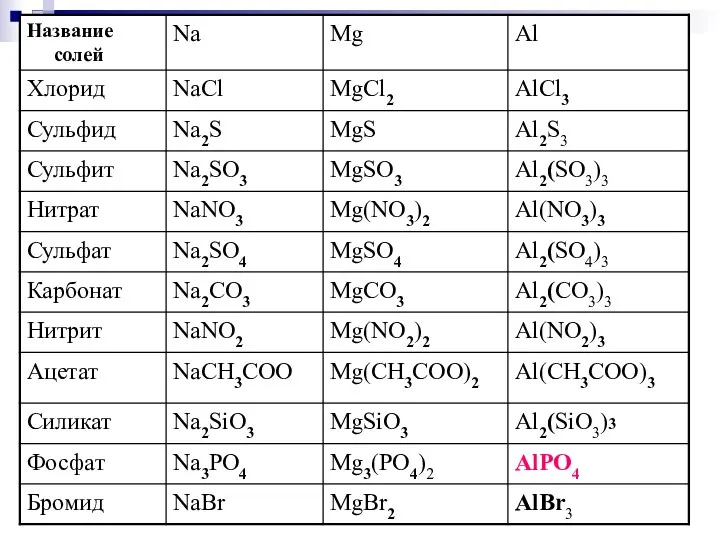
- 166. Названия солей Na2S – сульфид натрия Na2SO3 – сульфит натрия Na2SО4 – сульфат натрия Fe(NO3)2 –
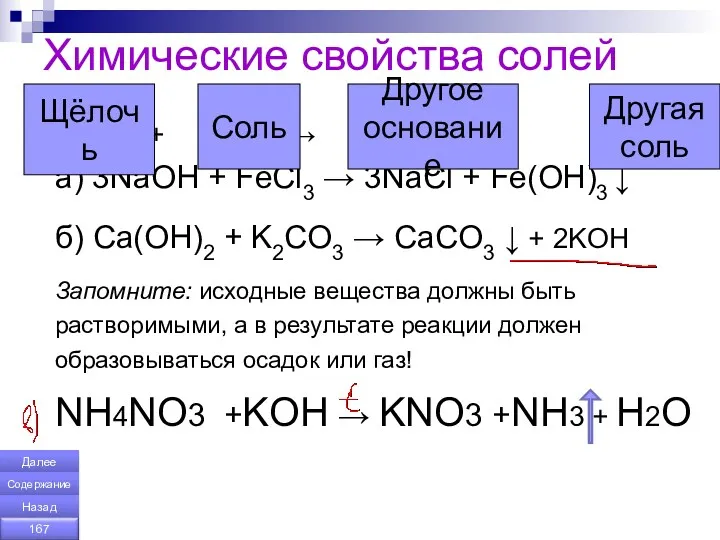
- 167. Химические свойства солей + → + a) 3NaOH + FeCl3 → 3NaCl + Fe(OH)3 ↓ б)
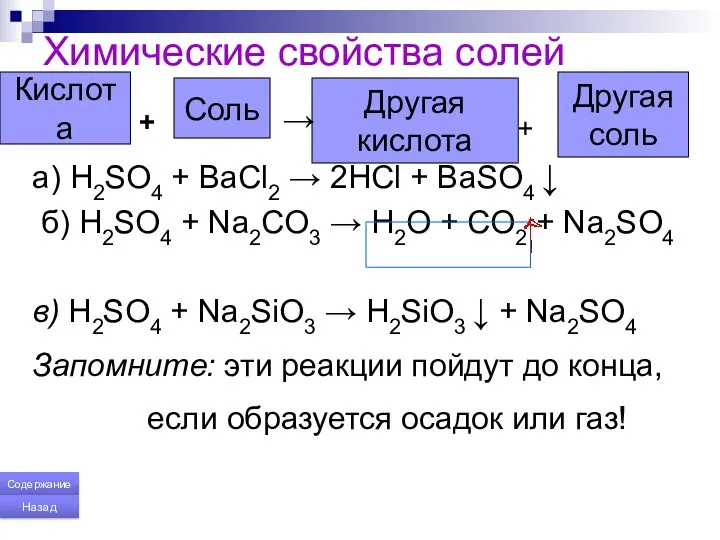
- 168. Химические свойства солей a) H2SO4 + BaCl2 → 2HCl + BaSO4 ↓ б) H2SO4 + Na2CO3
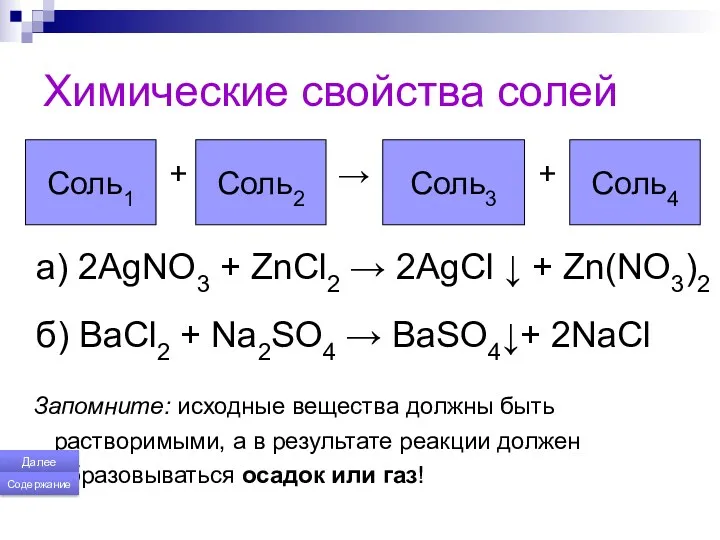
- 169. Химические свойства солей + → + a) 2AgNO3 + ZnCl2 → 2AgCl ↓ + Zn(NO3)2 б)
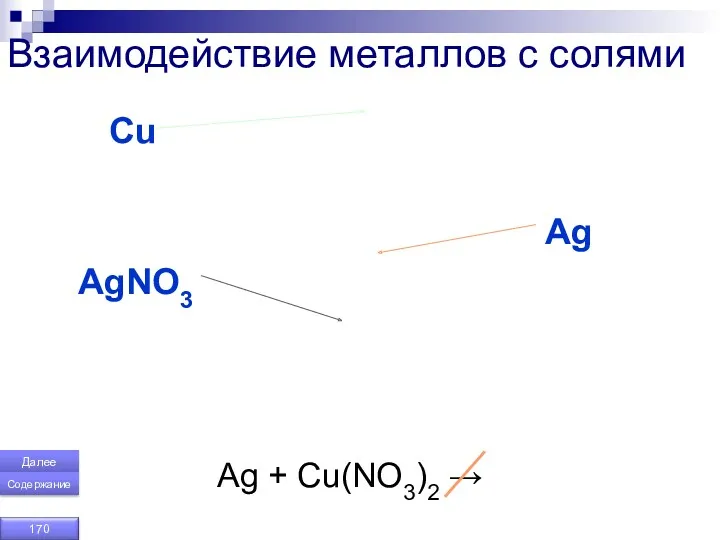
- 170. Взаимодействие металлов с солями Сu Ag AgNO3 Ag + Cu(NO3)2 → Далее Содержание
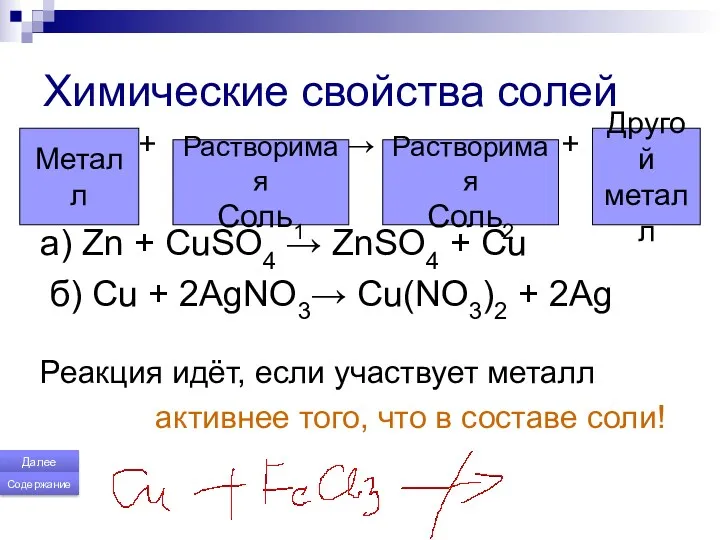
- 171. Химические свойства солей + → + a) Zn + CuSO4 → ZnSO4 + Cu б) Cu
- 172. Основания. Далее Содержание
- 173. Понятие об основаниях. Основания с точки зрения ТЭД – это электролиты, которые в водных растворах диссоциируют
- 174. Классификация оснований. 1. По растворимости в воде:
- 175. Классификация оснований. 2. По степени ЭД:
- 176. Классификация оснований. 3. По кислотности:
- 177. Физические свойства. Все основания, кроме NH3·H2O – твёрдые вещества, имеющие различную окраску. Мягкие на ощупь, изменяют
- 178. Химические свойства. 1. Основание + кислота → соль + вода (реакция обмена) нейтрализации 2NaOH + H2SO4
- 179. Химические свойства. 2. Основание + кислотный оксид → → соль + вода (реакция обмена) Р2О5 +
- 180. Химические свойства. 3. Щёлочь + соль → новое основание + + новая соль (реакция обмена) 2КОН
- 181. Химические свойства. 4. Нерастворимое основание → → оксид металла + вода (при t°С) (реакция разложения) 2Fe(OH)3
- 182. Особые свойства оснований. 1. Качественная реакция на Са(ОН)2 – помутнение известковой воды: Са(ОН)2 + СО2 →
- 183. Выполните задания. Дайте характеристику кремниевой кислоты по всем изученным признакам. Напишите уравнения реакций: Азотная кислота +
- 184. Закрепление. 1. Составьте молекулярные уравнения реакций: Аl+3 + 3OH- → Al(OH)3↓ 2. Напишите уравнения реакций, характеризующие
- 185. Домашнее задание. § 39, упр. 3, 5
- 186. Оксиды Урок по химии 11 класс Автор: учитель химии и биологии МОУ « Средняя школа №5»
- 187. Что такое оксиды? Оксиды- бинарные соединения с кислородом в степени окисления (-2). Общая формула оксидов: ЭmOn
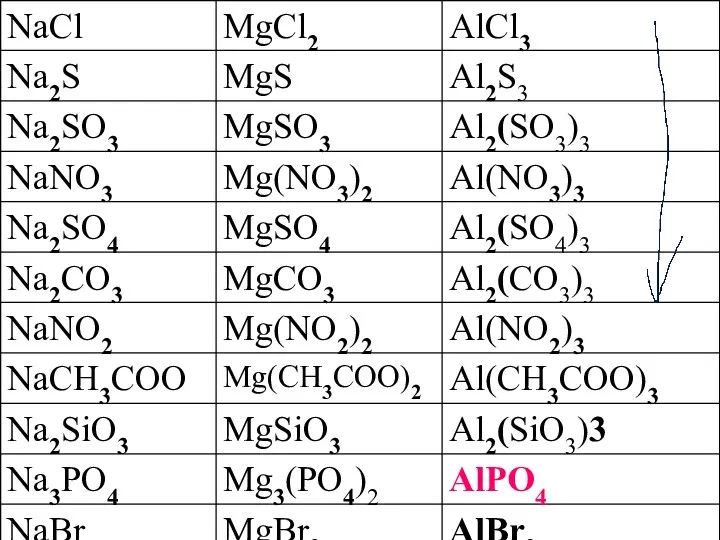
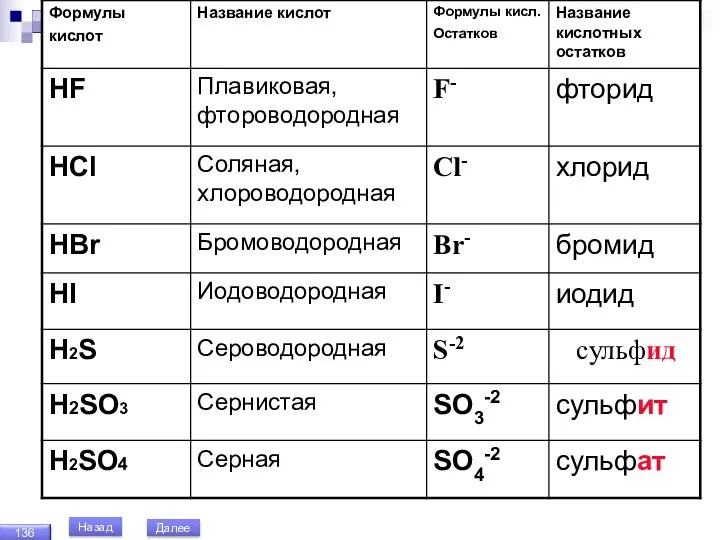
- 188. Классификация оксидов
- 189. Несолеобразующие оксиды Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют
- 190. Основные оксиды Это оксиды, которым в качестве гидроксидов соответствуют основания. Например: CuO → Cu(OH)2 Основные оксиды
- 191. Солеобразующие оксиды Солеобразующими называют такие оксиды, которые в результате химических реакций способны образовывать соли. Солеобразующие оксиды,
- 192. Несолеобразующие оксиды Несолеобразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и
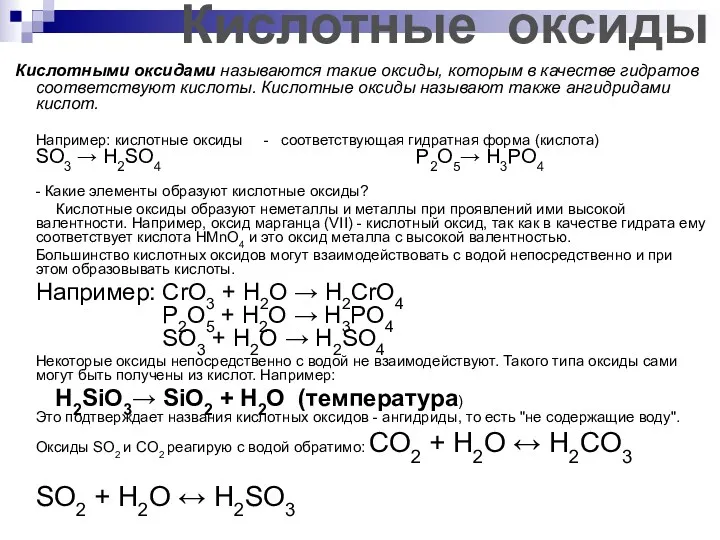
- 193. Кислотными оксидами называются такие оксиды, которым в качестве гидратов соответствуют кислоты. Кислотные оксиды называют также ангидридами
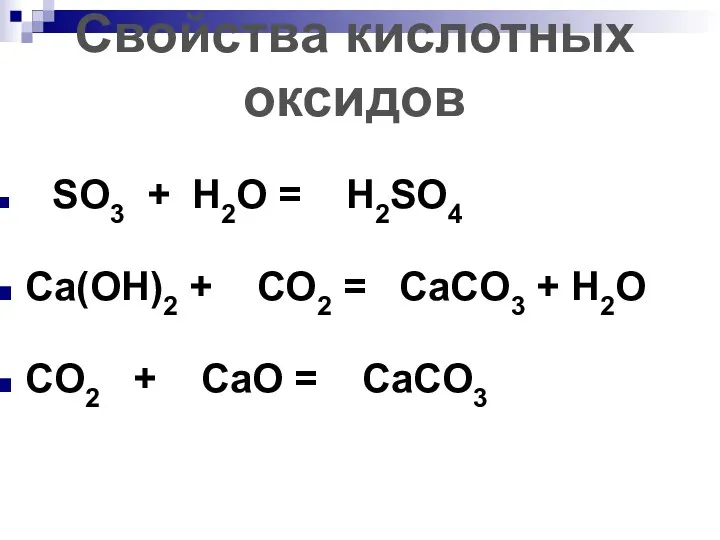
- 194. Химические свойства кислотных оксидов. С основаниями, образуя соль и воду: CO2 + 2KOH = K2CO3 +
- 195. SO3 + H2O = H2SO4 Ca(OH)2 + CO2 = CaCO3 + H2O CO2 + CaO =
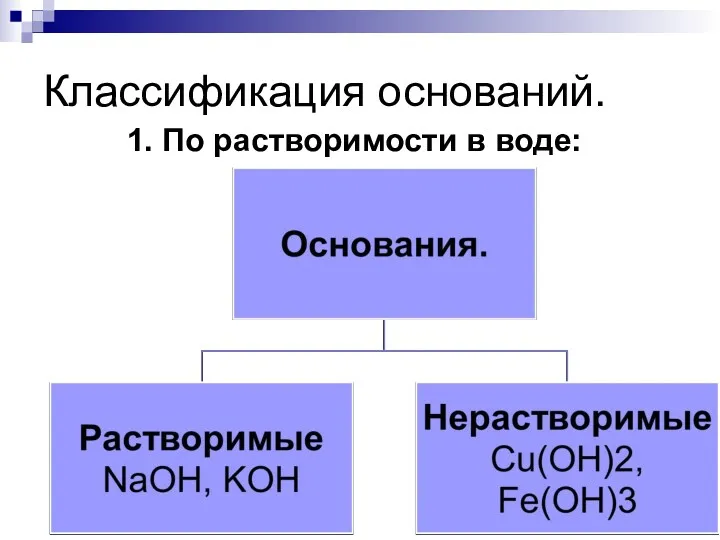
- 196. Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий проявляют свойства как основных (в кислой
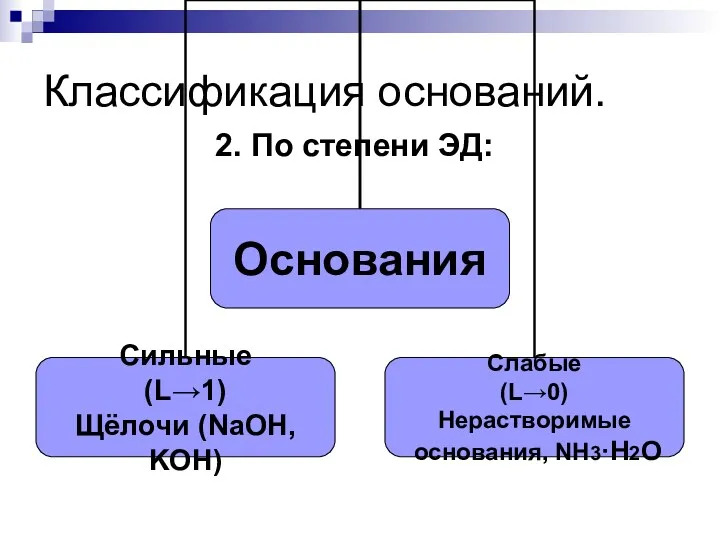
- 197. АМФОТЕРНЫЕ ОКСИДЫ. Это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот. Например: BeO
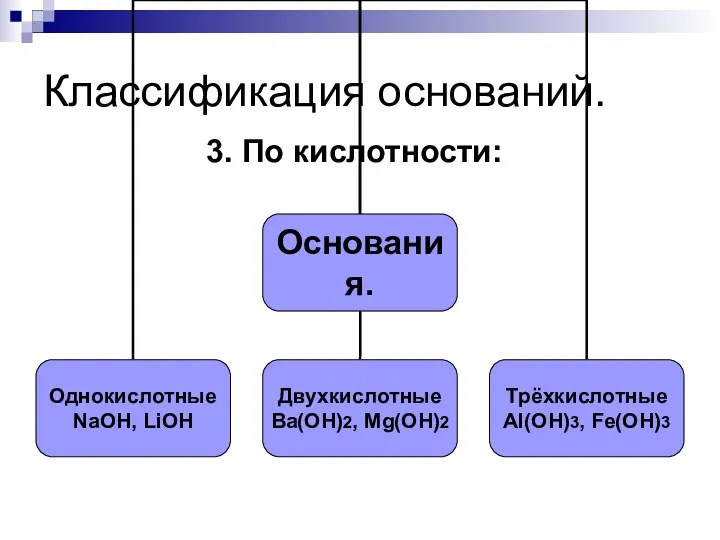
- 198. Химические свойства амфотерных оксидов. В качестве основных оксидов. С кислотами, образуя соль и воду: ZnO +
- 199. ZnO + 2HCl = ZnCl2 + H2O ZnO + 2NaOH = Na2ZnO2+ H2O Свойства амфотерных оксидов
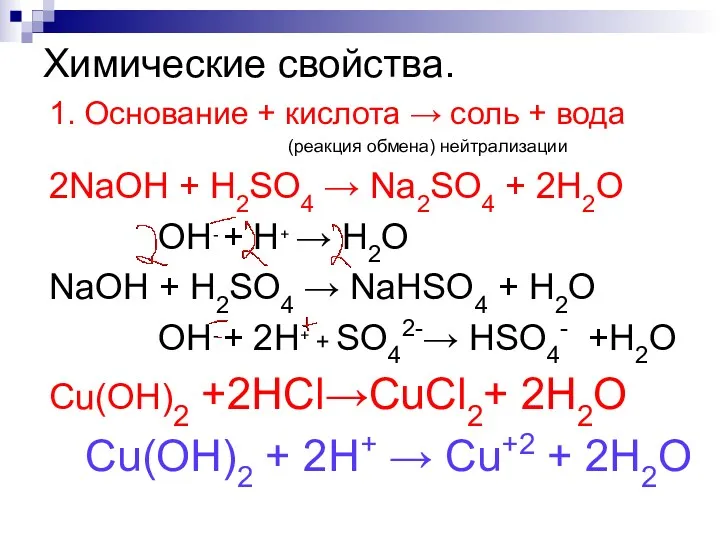
- 200. Основные оксиды Основными оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения воды) соответствуют основания.
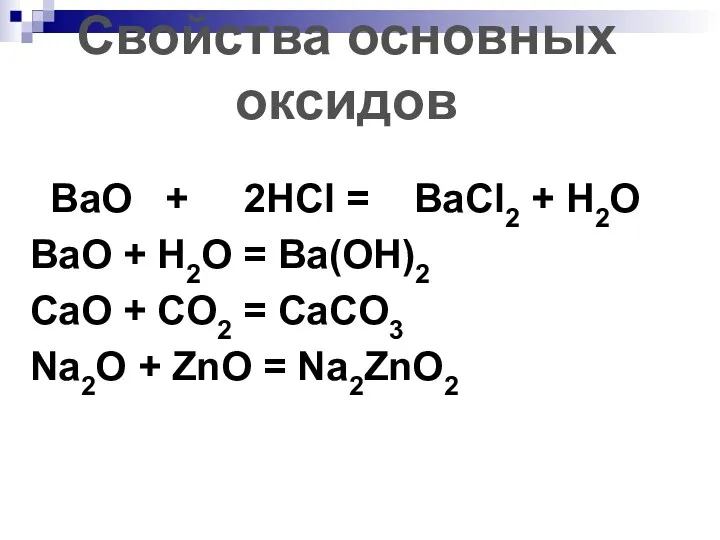
- 201. Химические свойства основных оксидов. Взаимодействие с кислотами, с образованием соли и воды: MgO + 2HCl =
- 202. BaO + 2HCl = BaCl2 + H2O BaO + H2O = Ba(OH)2 CaO + CO2 =
- 203. Вывод. С повышением степени окисления атомов элемента, образующего оксиды, увеличиваются кислотные свойства его оксидов и гидроксидов.
- 204. Способы получения оксидов. Взаимодействие простых веществ с кислородом: 2Mg + O2 = 2Mg O 2. Горение
- 205. Генетический ряд металла Li → Li2O → LiOH → Li2SO4 Металл Основный оксид Основание Соль
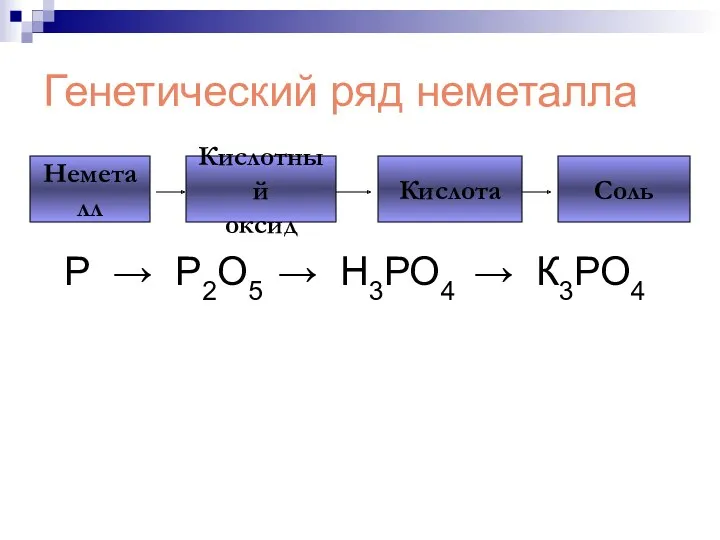
- 206. Генетический ряд неметалла Р → Р2О5 → Н3РО4 → К3РО4 Неметалл Кислотный оксид Кислота Соль
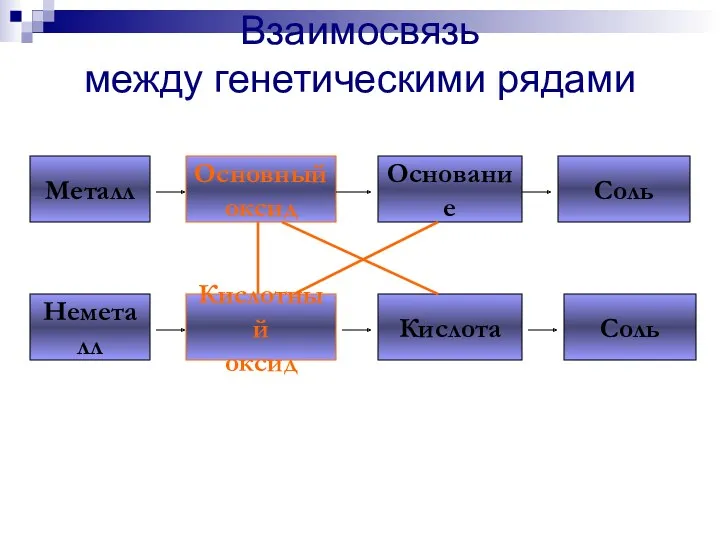
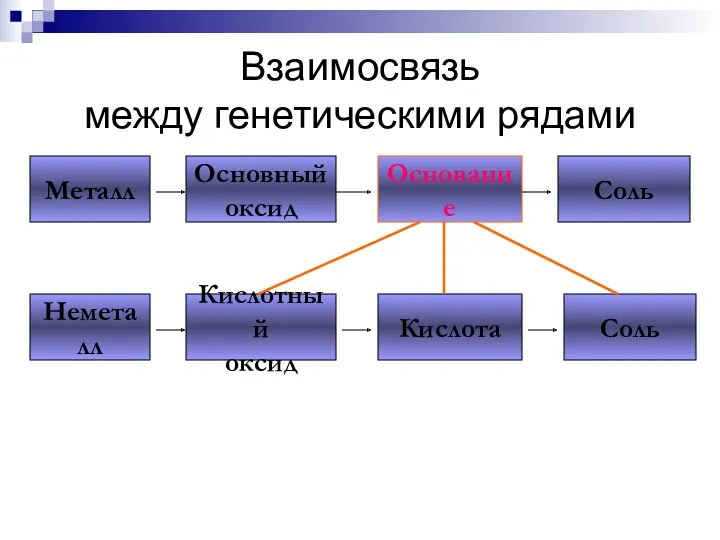
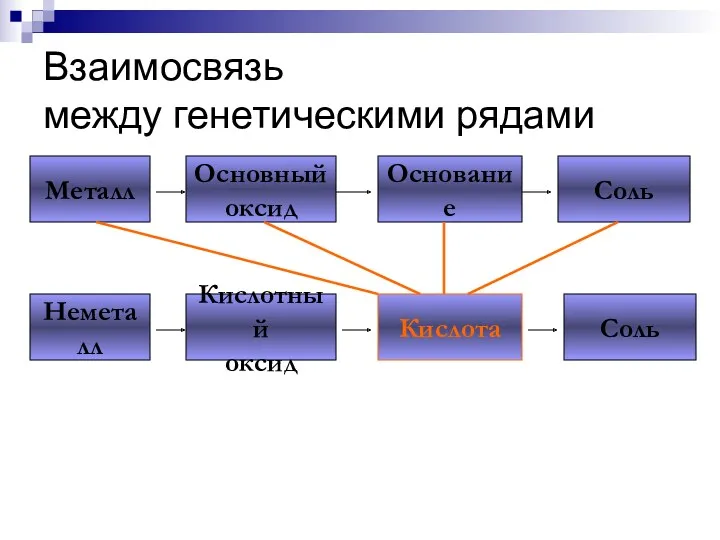
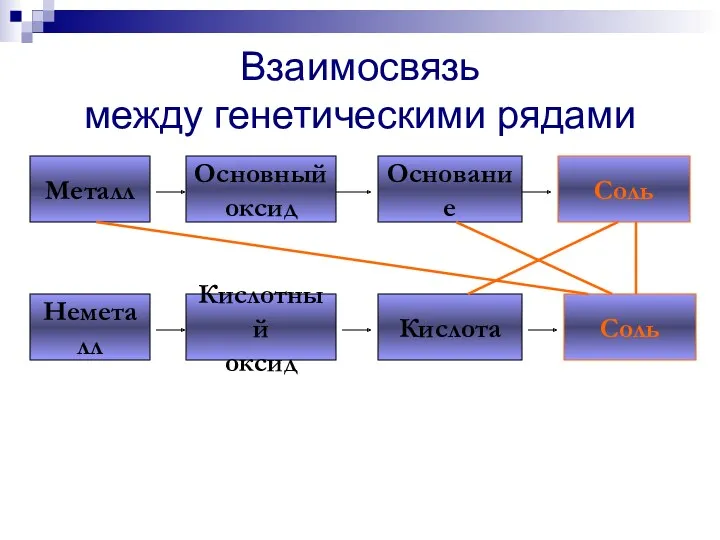
- 207. Взаимосвязь между генетическими рядами Металл Основный оксид Основание Соль Неметалл Кислотный оксид Кислота Соль
- 208. Взаимосвязь между генетическими рядами Металл Основный оксид Основание Соль Неметалл Кислотный оксид Кислота Соль
- 209. Взаимосвязь между генетическими рядами Металл Основный оксид Основание Соль Неметалл Кислотный оксид Кислота Соль
- 210. Взаимосвязь между генетическими рядами Металл Основный оксид Основание Соль Неметалл Кислотный оксид Кислота Соль
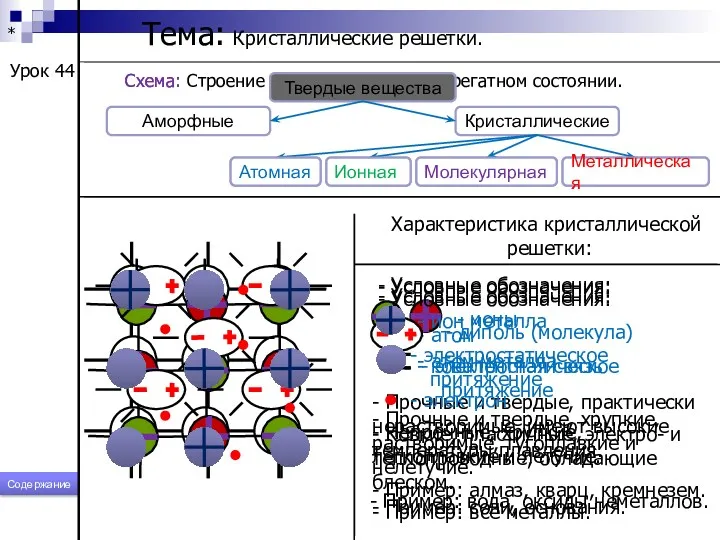
- 211. * Тема: Кристаллические решетки. Урок 44 Схема: Строение веществ в твердом агрегатном состоянии. Твердые вещества Аморфные
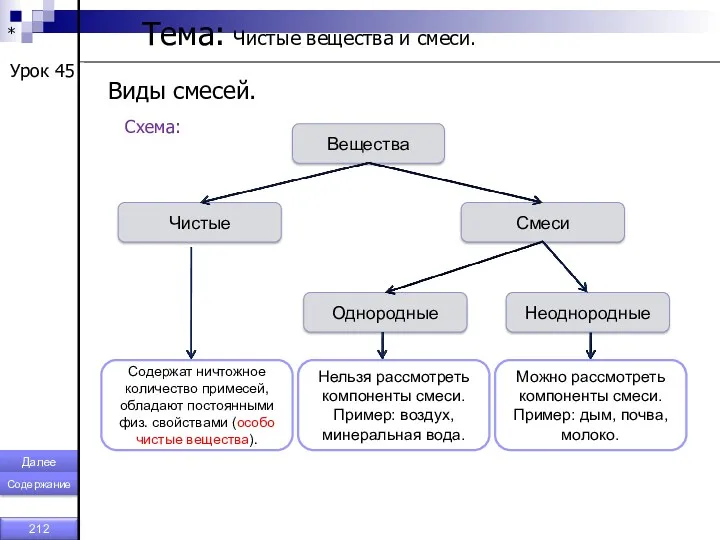
- 212. * Тема: Чистые вещества и смеси. Урок 45 Виды смесей. Схема: Вещества Чистые Смеси Однородные Неоднородные
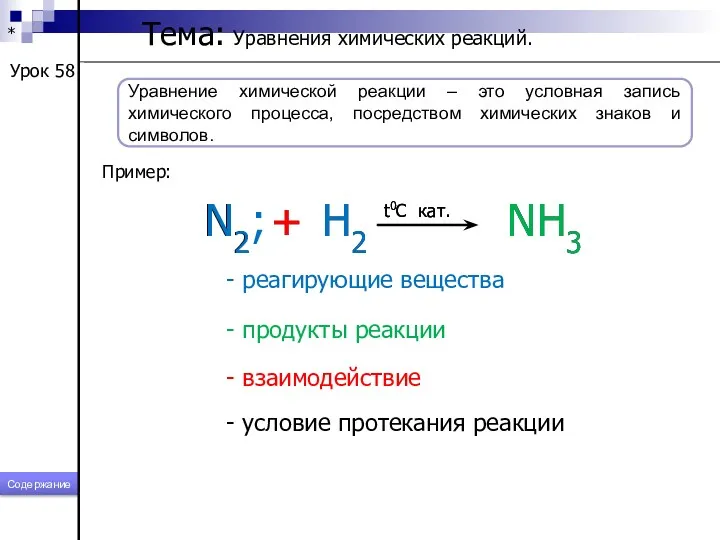
- 213. * Уравнение химической реакции – это условная запись химического процесса, посредством химических знаков и символов. Пример:
- 214. * СОСТАВЛЕНИЕ УРАВНЕНИЙ ХИМИЧЕСКИХ РЕАКЦИЙ Пример: Составить уравнение реакции взаимодействия фосфора и кислорода. 1. В левой
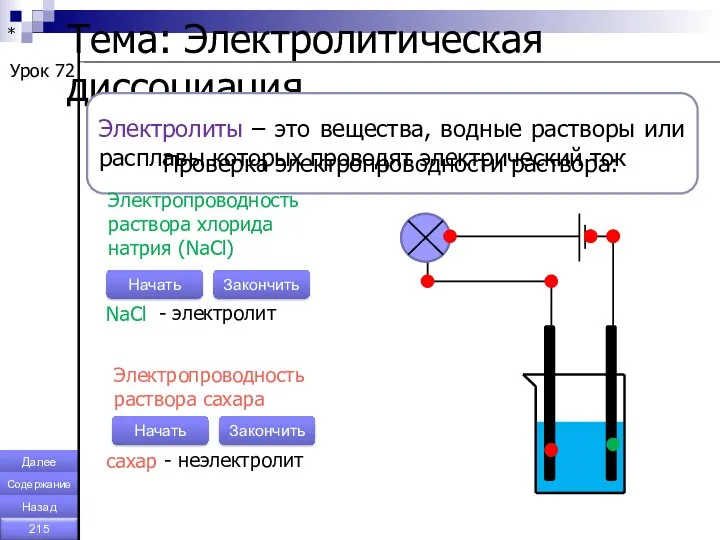
- 215. * Тема: Электролитическая диссоциация. Урок 72 Электролиты – это вещества, водные растворы или расплавы которых проводят
- 216. * Тема: Реакции ионного обмена. Пример: Взаимодействие хлорида бария с сульфатом натрия. BaCl2 + Na2SO4 ?
- 217. * Тема: Условия протекания реакций ионного обмена. I. Если образуется осадок. BaCl2 + Na2SO4 ? BaSO4
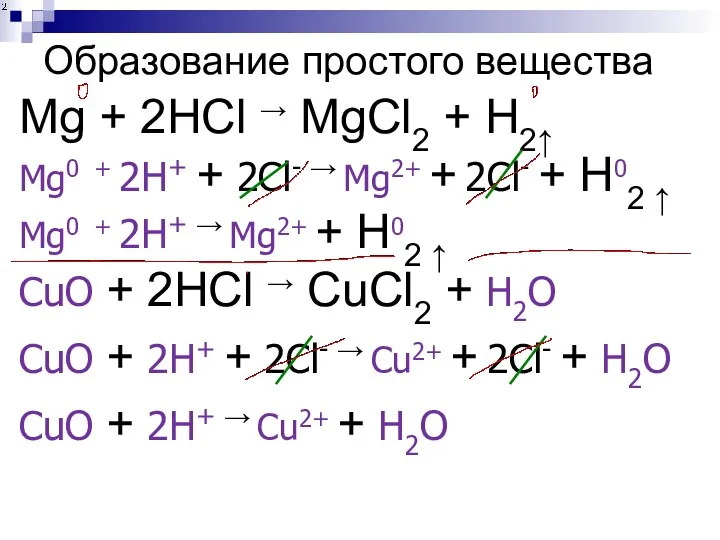
- 218. Образование простого вещества Mg + 2HCl → MgCl2 + H2↑ Mg0 + 2H+ + 2Cl- →
- 219. В помидорах содержится салициловая кислота Уксус получаемый из винограда содержит слабую кислоту называемую этиловой. В пчелином
- 220. Кокосовое масло содержит жирную кислоту, называемую лауриловая кислота. Муравей при укусе впрыскивает порцию метиловой кислоты относящийся
- 221. Кислотность почвы– свойство почвы, обусловленное наличием водных ионов в почвенном растворе и обменных ионов водорода и
- 222. Это одно из наиболее важных соединений фосфора(v). Представляет собой бесцветные кристаллы, легкоплавкие, расплывающиеся на воздухе, смешивающиеся
- 223. Кислотные дожди(кислые дожди), атмосферные осадки(в т.ч. снег),подкисленные(pH ниже 5,6) из- за повышенного содержания в воздухе промышленных
- 224. * Коллекция учебных динамических слайдов по химии 8 класс. Если, разработанные мною слайды, пригодятся Вам в
- 225. 28.04.2008 aleksei.bazhenov@mail.ru Задачник Разработал: Учитель химии – биологии первой квалификационной категории Баженов Алексей Анатольевич Тюменская область.
- 226. Содержание: 1. Основные физические величины в химии. 2. Основные уравнения связи. 3. Правило пользования треугольником. 4.
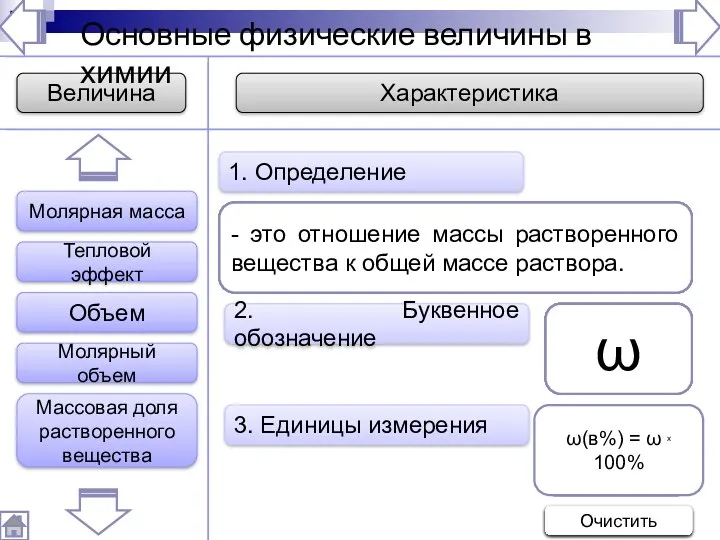
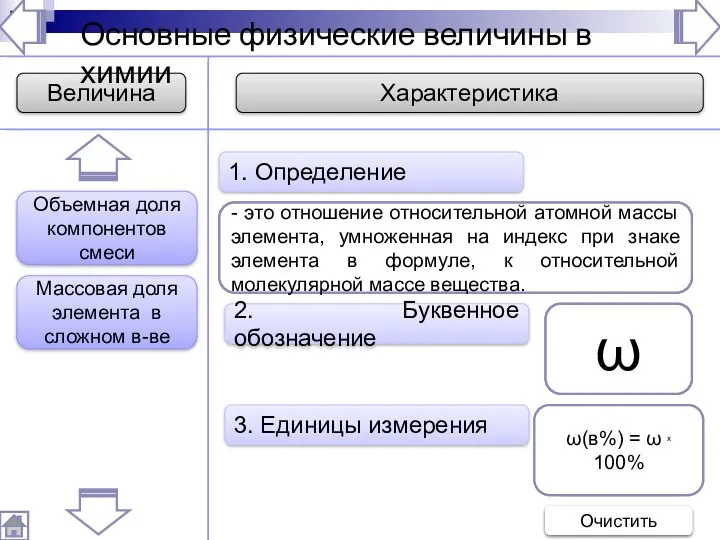
- 227. Основные физические величины в химии 2. Буквенное обозначение 3. Единицы измерения 1. Определение - это величина,
- 228. 2. Буквенное обозначение 3. Единицы измерения 1. Определение - это масса одного моля вещества. M г/моль
- 229. 2. Буквенное обозначение 3. Единицы измерения 1. Определение - это отношение объема компонента смеси к общему
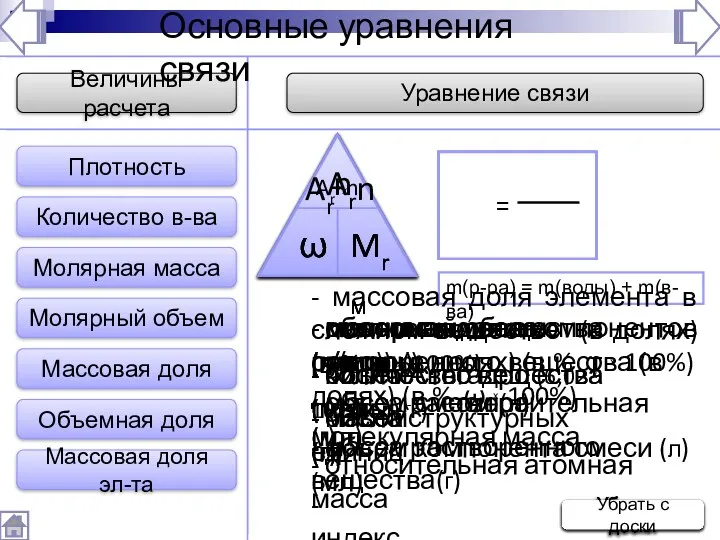
- 230. Величины расчета Уравнение связи Плотность ρ - плотность (г/мл) - объем (мл) - масса (г) V
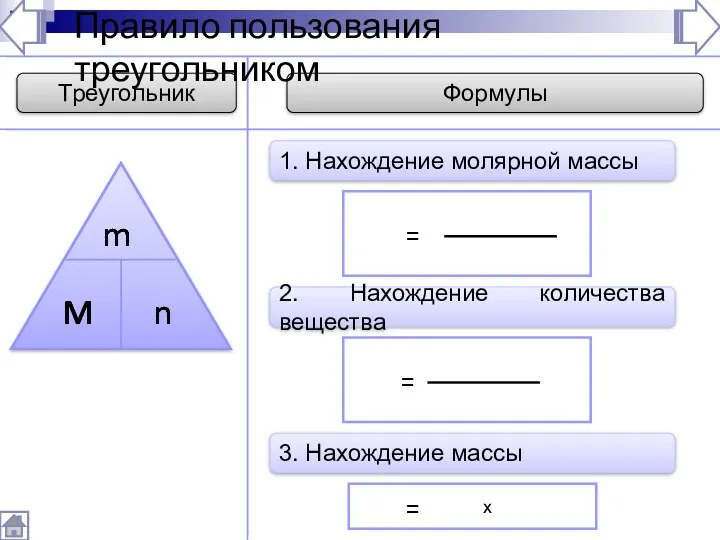
- 231. Треугольник Формулы M Правило пользования треугольником = 1. Нахождение молярной массы m n 2. Нахождение количества
- 232. Задача Найти: Решение: Рассчитайте объем водорода (н.у.), который потребуется для взаимодействия с 480 г оксида железа
- 233. Задача №1 Сборник задач и их решений. Сколько молекул содержится в 11 г углекислого газа СО2.
- 234. Сборник задач и их решений. Задача №8 Найдите массу азота, полученного из 280 л воздуха (н.у.),
- 235. Задача №1 Задачи по теме: «Количество вещества» Дано: Найти: Решение: 1 2 3 Ответ: Сколько молекул
- 236. Задача №2 Дано: Найти: Решение: 1 2 3 Ответ: Найдите массу 15 x 1023 молекул кислорода.
- 237. Задача №3 Дано: Найти: Решение: 1 2 3 Ответ: Найдите массу 33,6 л аммиака NH3 при
- 238. Задача №4 Дано: Найти: Решение: 1 2 Ответ: Найдите объем при н.у., который имеют 18 x
- 239. Задача №5 Дано: Найти: Решение: 1 2 Ответ: В 150 г воды растворили 50 г фосфорной
- 240. Задача №6 Дано: Найти: Решение: 1 2 Ответ: Сколько граммов воды и нитрата натрия нужно взять,
- 241. Задача №7 Дано: Найти: Решение: 1 Ответ: Сколько литров кислорода может быть получено из 800л жидкого
- 242. Задача №8 Дано: Найти: Решение: 1 2 3 Ответ: Найдите массу азота, полученного из 280 л
- 243. Найти: Расчеты по химическим уравнениям Дано: m(Al) =270г V(O2) - ? 1 4Al + 3O2 ?
- 244. Найти: Расчеты по химическим уравнениям Дано: mр-ра(HCl) =730г V(H2) - ? 1 Zn + 2HCl ?
- 246. Скачать презентацию












































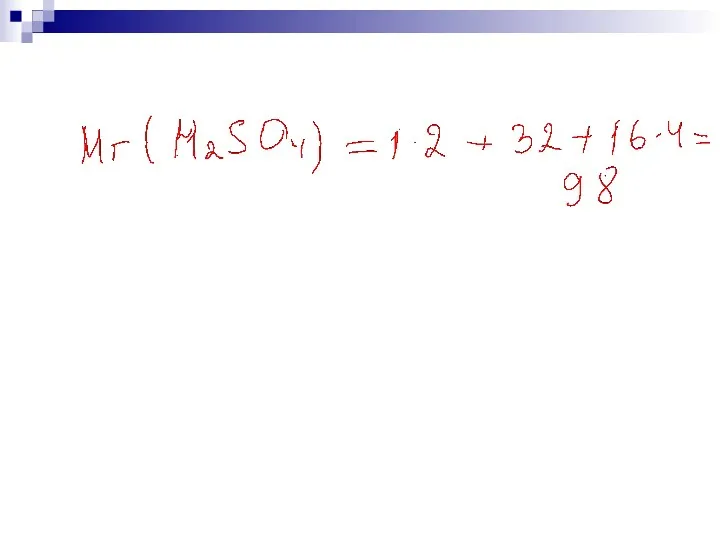


































































































































 Химические свойства алкенов
Химические свойства алкенов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Получение уксусной кислоты и опыты с ней
Получение уксусной кислоты и опыты с ней Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Классификация органических соединений
Классификация органических соединений Классы неорганических соединений. 8 класс
Классы неорганических соединений. 8 класс Знаки вторичной переработки
Знаки вторичной переработки Застосуванння електролiзу
Застосуванння електролiзу Магматические формации
Магматические формации Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Химическая связь в кластерах
Химическая связь в кластерах Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Структура стекла
Структура стекла Свойства кислот и оснований в свете теории электролитической диссоциации
Свойства кислот и оснований в свете теории электролитической диссоциации Фосфор и его основные соединения
Фосфор и его основные соединения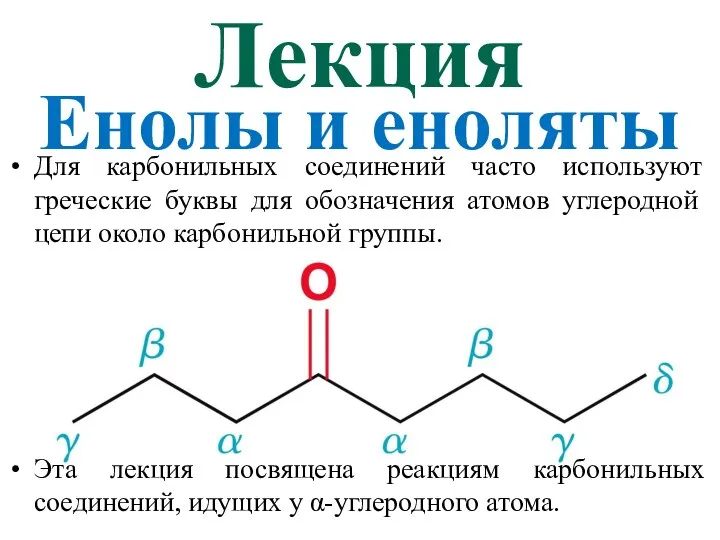 Енолы и еноляты
Енолы и еноляты Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия
Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия Белки. 9 класс
Белки. 9 класс Коррозия и защита строительных материалов
Коррозия и защита строительных материалов ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Сопряжение. Ароматичность. Электронные эффекты заместителей
Сопряжение. Ароматичность. Электронные эффекты заместителей Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Ізомери у природі
Ізомери у природі Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна