Содержание
- 3. C C H H H H H O H C2 C2 H6 H5 OH Предельные одноатомные
- 4. Гидроксильная группа является функциональной группой спиртов! Функциональная группа – группа атомов, которая обусловливает характерные химические свойства
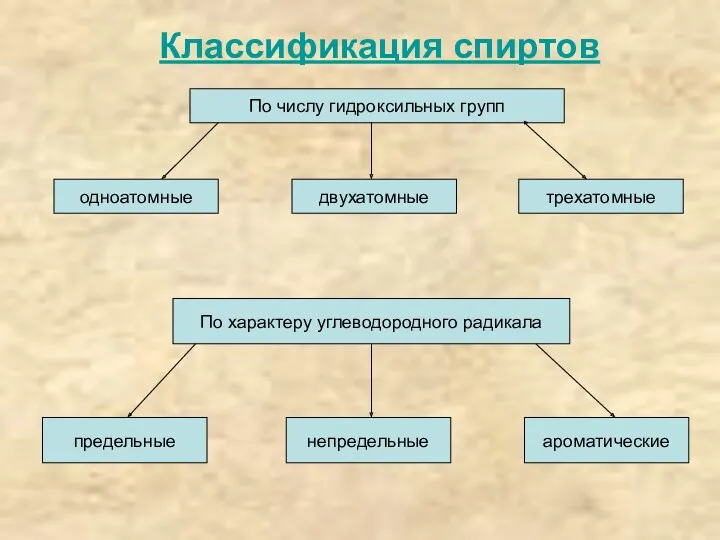
- 5. Классификация спиртов По числу гидроксильных групп одноатомные двухатомные трехатомные По характеру углеводородного радикала предельные непредельные ароматические
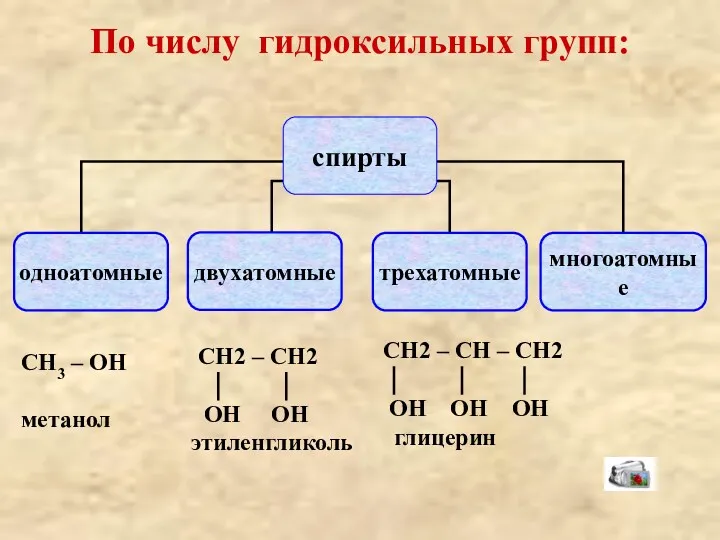
- 6. По числу гидроксильных групп: СН3 – ОН метанол СН2 – СН – СН2 ОН ОН ОН
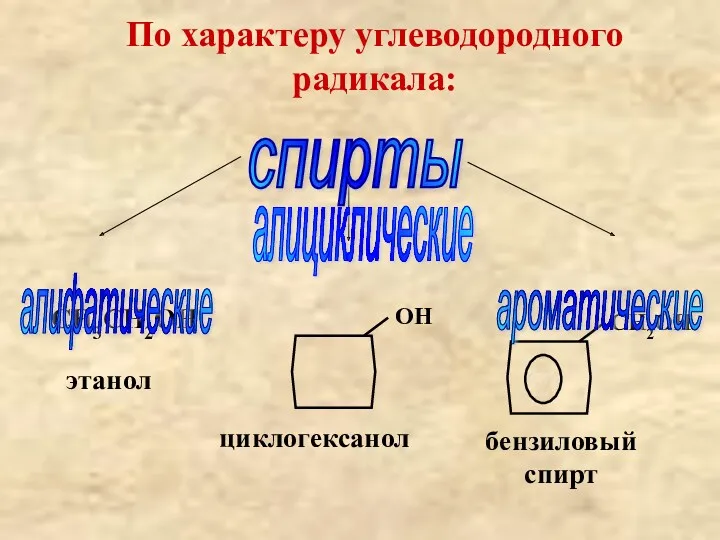
- 7. По характеру углеводородного радикала: СН3СН2ОН спирты алифатические алициклические ароматические циклогексанол бензиловый спирт этанол
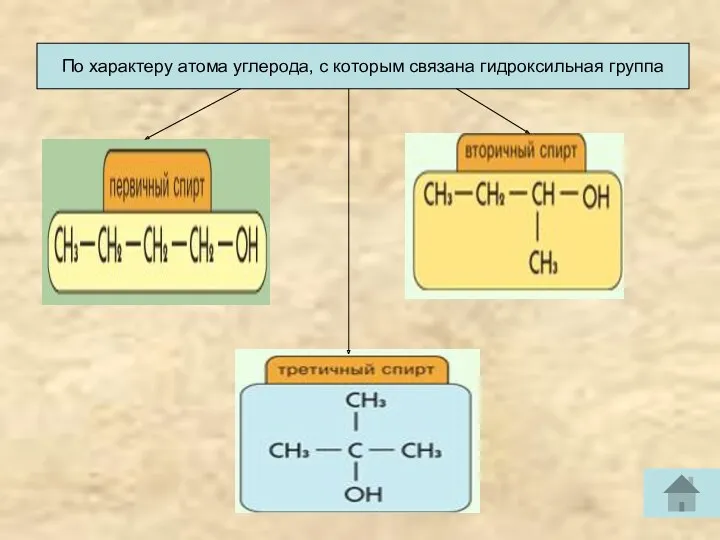
- 8. По характеру атома углерода, с которым связана гидроксильная группа
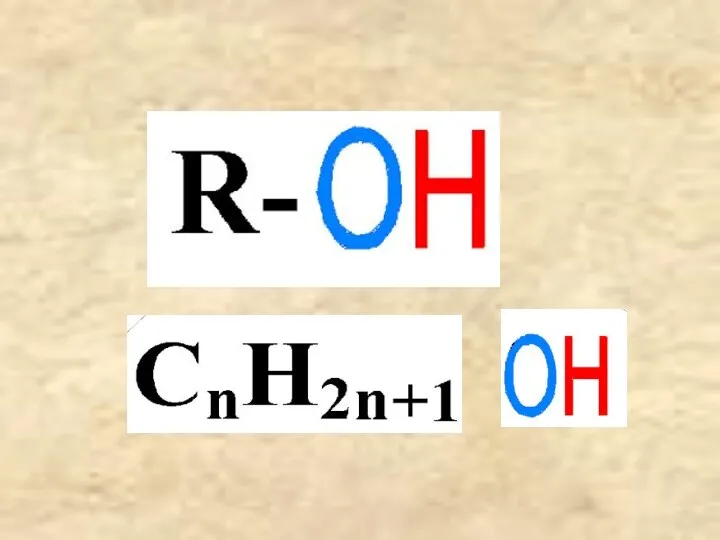
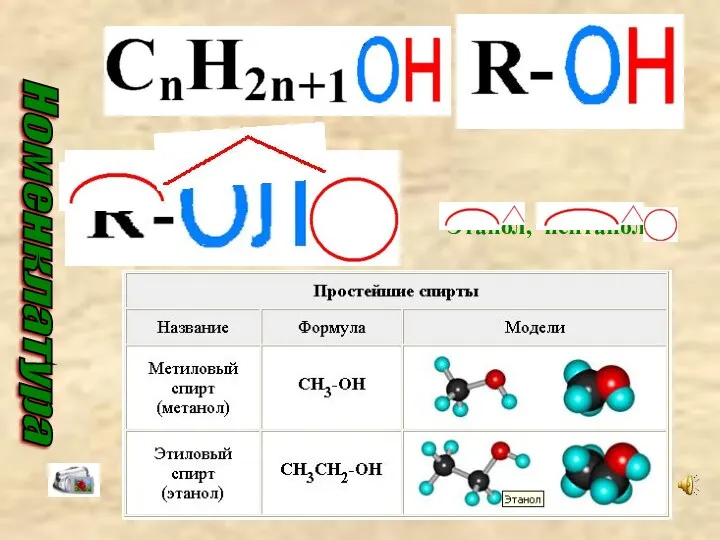
- 9. 4. Гомологический ряд спиртов Общая формула ряда: СnH2n+1OH, R – OH CH3OH C2H5OH C3H7OH C4H9OH C5H11OH
- 10. Этанол, пентанол-2 Номенклатура
- 11. 3. Номенклатура Названия спиртов образуют от соответствующих алканов добавлением суффикса – ол. Например: метан – метанол,
- 12. Назвать вещества: 1. СН3 – СН2 – СН – СН – СН – СН3 ОН СН3
- 13. Назвать вещество: 1. CH3 – CH – CH – C – CH2 – CH – CH
- 14. Составить формулу: 2-метил-3-этилпентанола-2 С – С – С – С – С 1 2 3 4
- 15. 5. Изомерия Для спиртов характерна структурная изомерия: 1. изомерия положения ОН-группы (начиная с С3); СН2 –
- 16. 2. Изомерия углеродной цепи (начиная с С4) СН3 – СН – СН2 – СН3 ОН 1
- 17. 6. Физические свойства С1 –С11 – при обычных условиях жидкости, с резким запахом, хорошо растворимы в
- 18. Физические свойства гомологического ряда
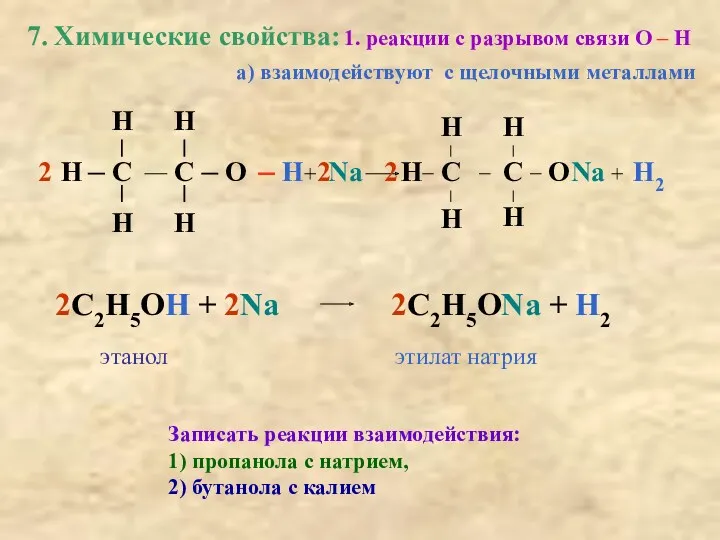
- 19. C C H H H H H O H 7. Химические свойства: + а) взаимодействуют с
- 20. 2. реакции с разрывом связи С – ОН б) взаимодействуют с галогеноводородными кислотами C2H5 OH +
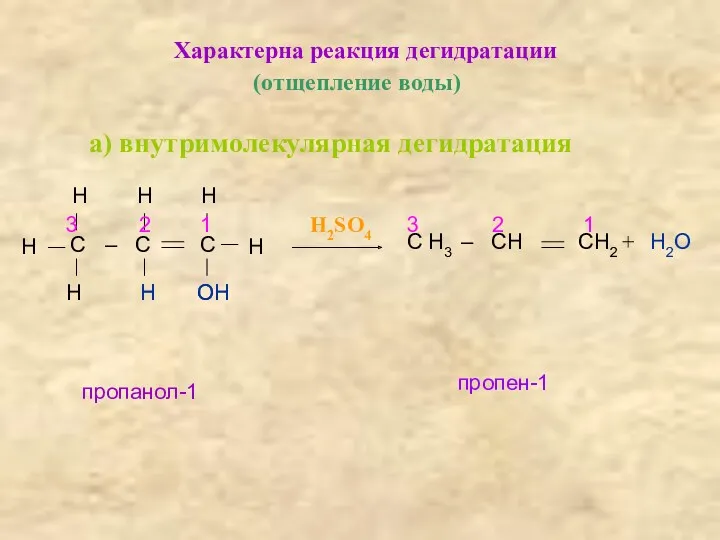
- 21. Характерна реакция дегидратации (отщепление воды) а) внутримолекулярная дегидратация С – С С Н Н Н Н
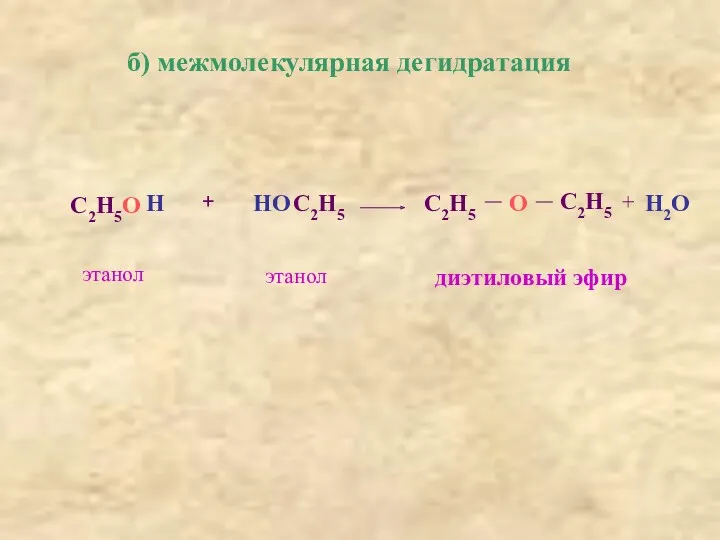
- 22. б) межмолекулярная дегидратация С2Н5О Н + НО С2Н5 С2Н5 О С2Н5 + Н2О этанол этанол диэтиловый
- 23. Характерна реакция окисления (горения) С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1374кДж
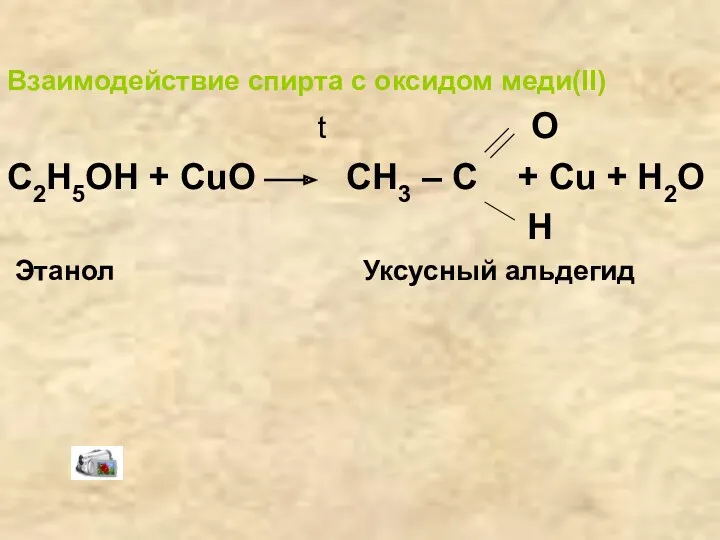
- 24. Взаимодействие спирта с оксидом меди(II) t O C2H5OH + CuO CH3 – C + Cu +
- 25. Реакция этерификации(от лат. ester – эфир) – образование сложных эфиров. O t,H2SO4 R - OH +
- 26. Получение спиртов 1. Гидратацией алкенов: СН2 = СН2 + Н2О СН3 – СН2 – ОН 2.
- 27. Получение. Общие способы: 1) Взаимодействие галогеналканов с растворами щелочей: R-Гал + NaOH R-OH + Na Гал
- 28. Получение Частные способы. Метанол получают из синтез – газа. t, P, ZnO CO + 2H2 CH3OH
- 29. 8. Применение стр.120 Метанол (метиловый спирт) CH3OH В производстве формальдегида, муравьиной кислоты; как растворитель. Этанол (этиловый
- 30. Применение
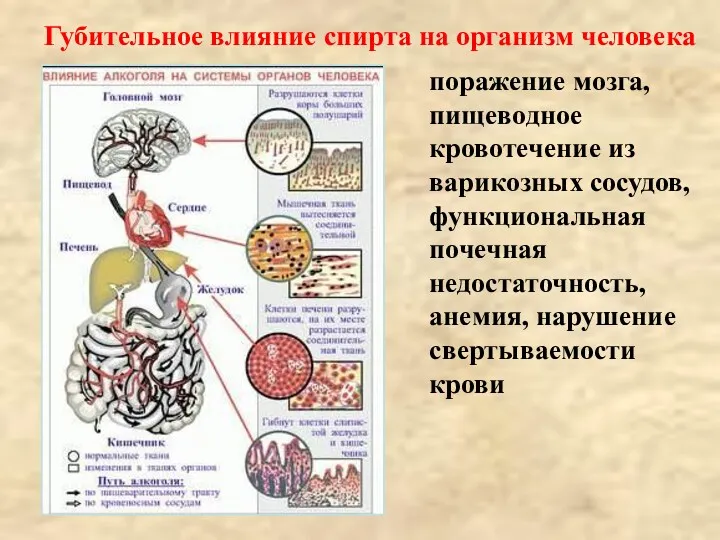
- 31. поражение мозга, пищеводное кровотечение из варикозных сосудов, функциональная почечная недостаточность, анемия, нарушение свертываемости крови Губительное влияние
- 33. Скачать презентацию



















 Фосфор и его соединения. 9 класс
Фосфор и его соединения. 9 класс Алотропні форми Карбону
Алотропні форми Карбону Дисперсные системы (продолжение)
Дисперсные системы (продолжение) Твердые вещества
Твердые вещества циклоалканы170
циклоалканы170 Химия. Химиялық термодинамика
Химия. Химиялық термодинамика Органикалық қосылыстар. Көмірсутектерден жасалған
Органикалық қосылыстар. Көмірсутектерден жасалған Амины
Амины Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Нұсқа талдау
Нұсқа талдау Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Периодический закон Д.И. Менделеева. Периодическая система химических элементов
Периодический закон Д.И. Менделеева. Периодическая система химических элементов Галогены. Свойства
Галогены. Свойства Метаболизм углеводов
Метаболизм углеводов Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Способи очищення води в побуті
Способи очищення води в побуті Чистые вещества и смеси
Чистые вещества и смеси Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Массовая доля вещества в растворе
Массовая доля вещества в растворе Методы сжигания газа. Раздел 3
Методы сжигания газа. Раздел 3 Алкалоиды: распространение в природе, получение, применение, способы синтеза
Алкалоиды: распространение в природе, получение, применение, способы синтеза Соединения химических элементов
Соединения химических элементов Ансамбль пор в реальном твердом теле
Ансамбль пор в реальном твердом теле Изотопная геохимия
Изотопная геохимия Применение гибридного биосорбента для очистки промышленных сточных вод от радиоактивных примесей
Применение гибридного биосорбента для очистки промышленных сточных вод от радиоактивных примесей Простые вещества - металлы и неметаллы
Простые вещества - металлы и неметаллы d-элементы
d-элементы λ-MnO2 as material with pseudocapacitive properties
λ-MnO2 as material with pseudocapacitive properties