Содержание
- 2. НЕМЕТАЛЛЫ - химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими
- 3. Свойства неметаллов: 1. Отсутствие металлического блеска (исключение – кремний) I - йод C - углерод S
- 4. 2. Низкая теплопроводность (газовая прослойка –наилучший теплоизолятор) Свойства неметаллов: 3. Низкая электрическая проводимость (исключение – графит)
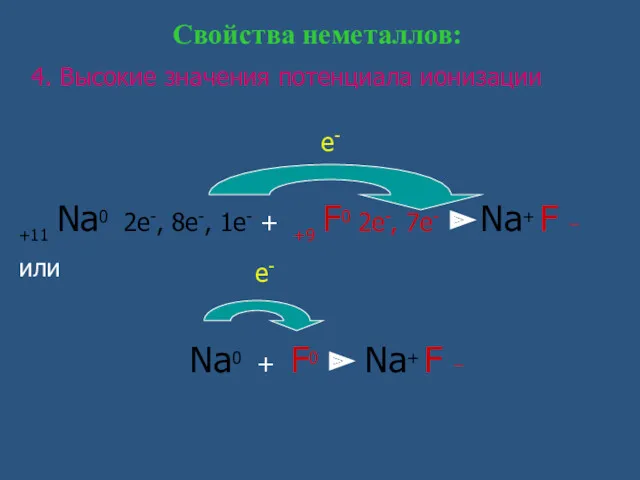
- 5. 4. Высокие значения потенциала ионизации Свойства неметаллов: +11 Na0 2e-, 8e-, 1e- + +9 F0 2e-,
- 6. 5. Хрупкость Свойства неметаллов:
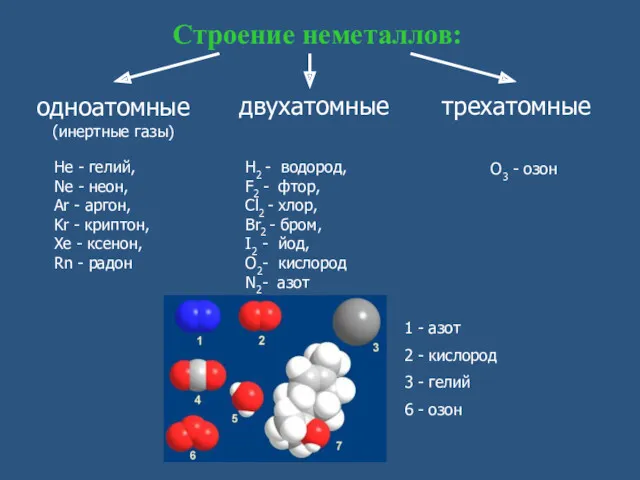
- 7. O3 - озон Строение неметаллов: одноатомные (инертные газы) двухатомные трехатомные He - гелий, Ne - неон,
- 8. Свойства неметаллов: У атомов элементов-неметаллов в периоде с увеличением порядкового номера: - заряд ядра увеличивается; -
- 9. Характерными для большинства неметаллов являются окислительные свойства: - с металлами: Ca + Cl2 = CaCl2 4Li
- 10. Менее характерны для неметаллов восстановительные свойства: - с более электротрицательными неметаллами: Si + 2F2 = SiF4
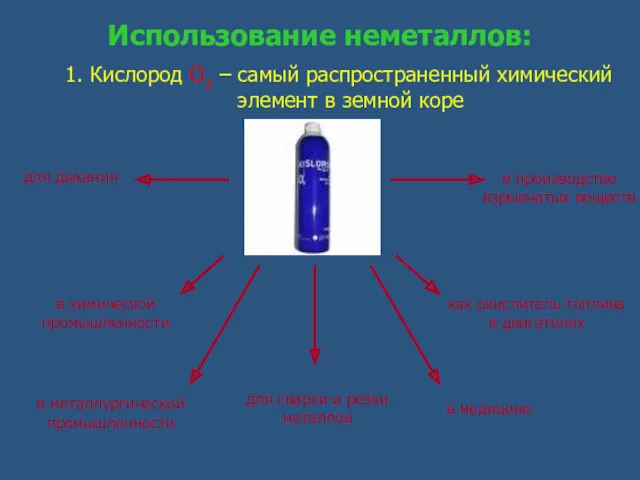
- 11. Использование неметаллов: 1. Кислород О2 – самый распространенный химический элемент в земной коре для дыхания в
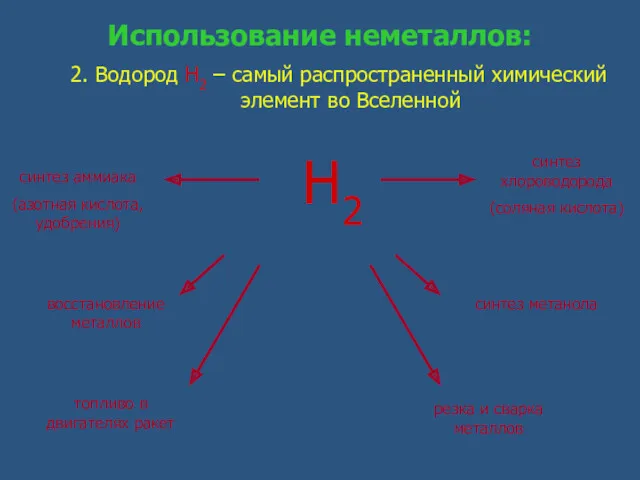
- 12. Использование неметаллов: 2. Водород Н2 – самый распространенный химический элемент во Вселенной восстановление металлов топливо в
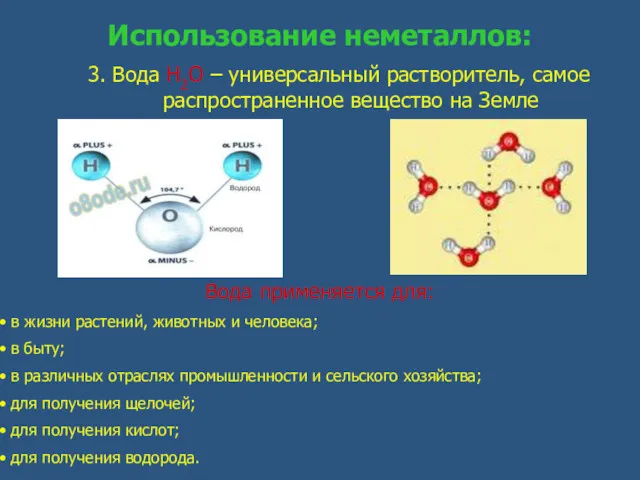
- 13. Использование неметаллов: 3. Вода Н2О – универсальный растворитель, самое распространенное вещество на Земле Вода применяется для:
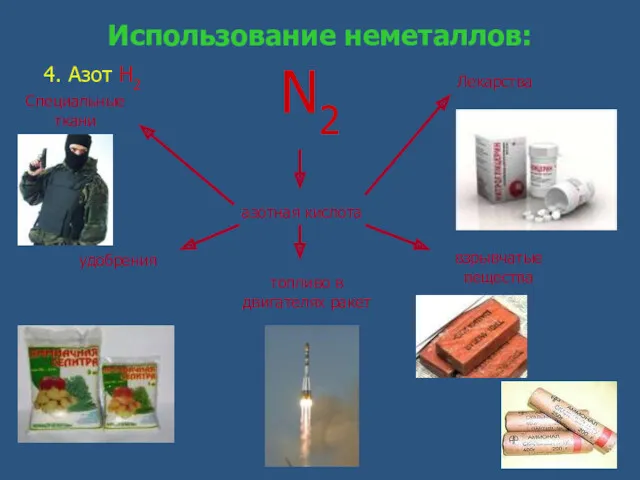
- 14. Использование неметаллов: 4. Азот Н2 топливо в двигателях ракет азотная кислота N2 удобрения взрывчатые вещества Специальные
- 15. Водородные соединения неметаллов Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметаллв е водородом,
- 17. Скачать презентацию








 Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов Фенолы. Химические свойства и способы получения
Фенолы. Химические свойства и способы получения История нефти. Свойства нефти. Классификация нефтей
История нефти. Свойства нефти. Классификация нефтей Электролитическая диссоциация
Электролитическая диссоциация Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Конструкционные функциональные волокнистые композиты. Углеродные волокна
Конструкционные функциональные волокнистые композиты. Углеродные волокна Периодический закон и периодический закон Д.И. Менделеева
Периодический закон и периодический закон Д.И. Менделеева Термодинамика химического равновесия
Термодинамика химического равновесия Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Алкены. Химия
Алкены. Химия Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение
Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Основы химической термодинамики
Основы химической термодинамики Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Циклоалкандар
Циклоалкандар Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Состав краски
Состав краски Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Титани органічної хімії
Титани органічної хімії Гидрирование пиробензина
Гидрирование пиробензина Биоорганическая химия
Биоорганическая химия The chemistri of life and the micro universe
The chemistri of life and the micro universe The halogens
The halogens Використання кислот
Використання кислот Гидролиз солей
Гидролиз солей Химическая термодинамика. Лекция 3
Химическая термодинамика. Лекция 3