Содержание
- 2. История возникновения теории электролитической диссоциации связана с именем шведского физико-химика Аррениуса. Он был разносторонним ученым: его
- 3. История открытия теории электролитической диссоциации В 1887 году шведский химик Сванте Аррениус сформулировал основные положения теории
- 4. Кто был этот ученый? Он родился в 1859 году в старинном шведском городе Упсале. В гимназии
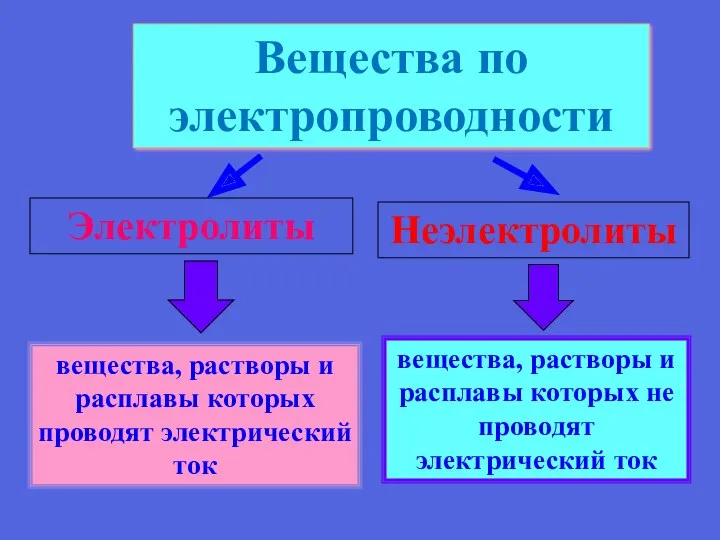
- 5. вещества, растворы и расплавы которых проводят электрический ток Вещества по электропроводности Электролиты Неэлектролиты вещества, растворы и
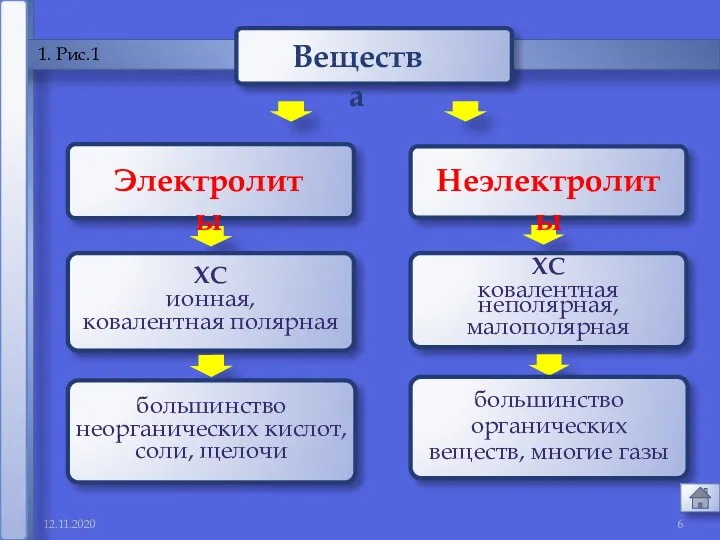
- 6. 12.11.2020 1 1. Рис.1 Электролиты Неэлектролиты
- 7. 12.11.2020 «Капля воды и камень точит» Вода – хороший растворитель, т.к. молекулы воды полярны. слабый амфотерный
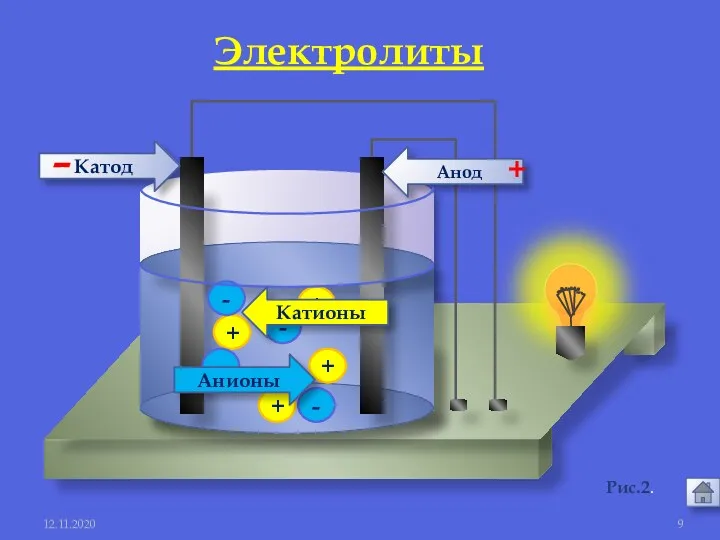
- 8. 12.11.2020 1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток. Электролиты -
- 9. + + + + - - - - Анионы Катионы Анод Катод - + 12.11.2020 Электролиты
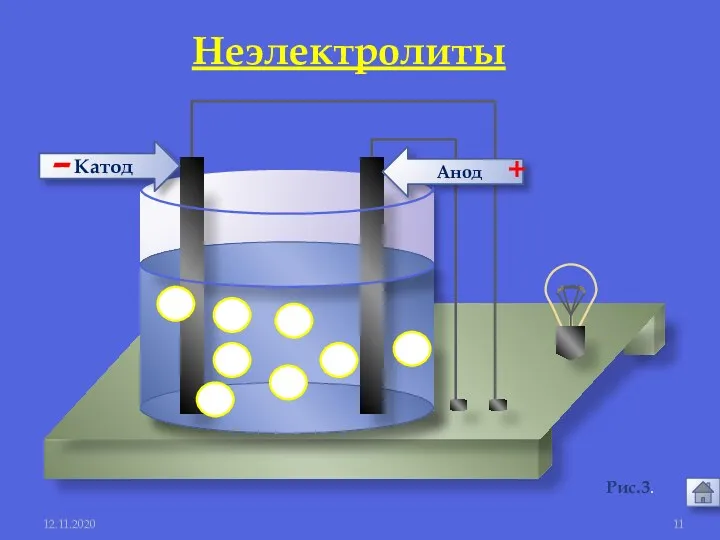
- 10. 12.11.2020 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Неэлектролиты
- 11. Анод Катод - + 12.11.2020 Рис.3. Неэлектролиты
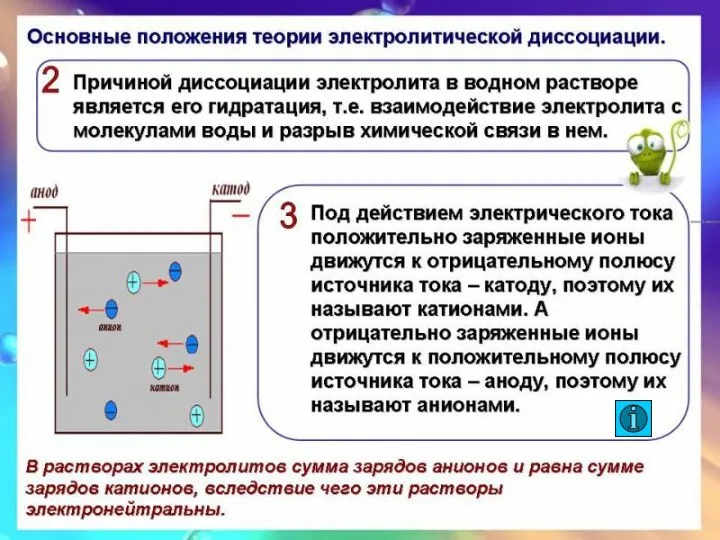
- 12. 12.11.2020 «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация процесс распада молекул
- 13. Причины электролитической диссоциации Сторонники физической теории растворов (Вант-Гофф, Аррениус и Освальд) считали, что процесс растворения -
- 14. Причины электролитической диссоциации И.А. Каблуков и В.А. Кистяковский применили химическую теорию Д.И. Менделеева и доказали что
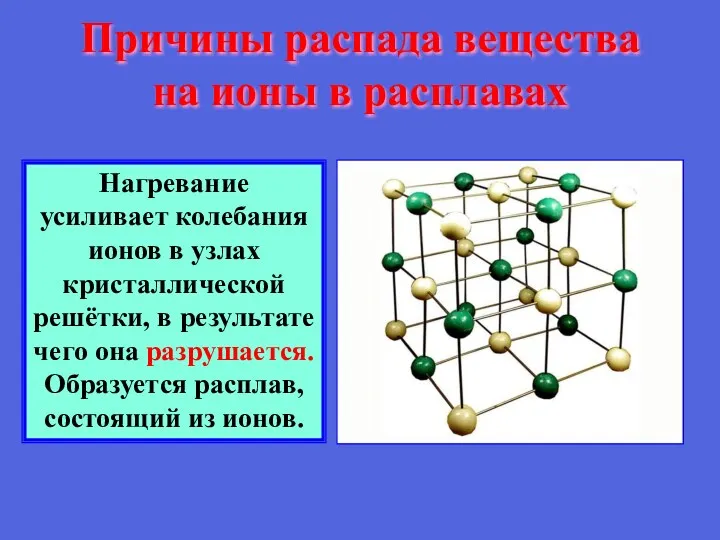
- 15. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки, в
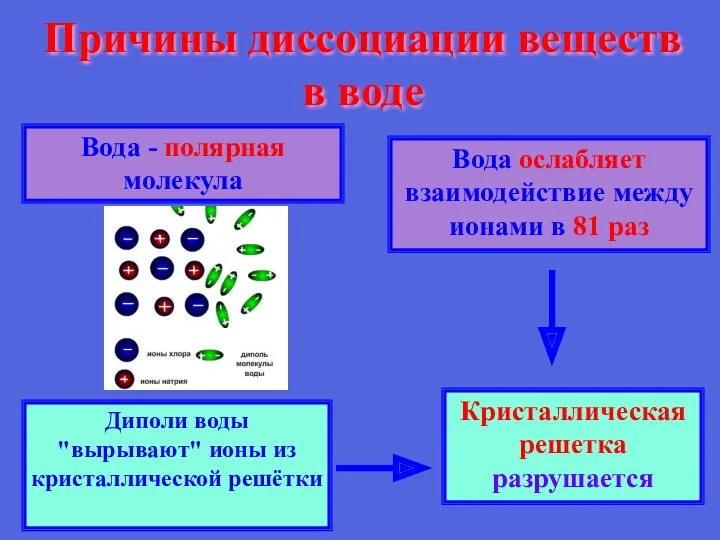
- 16. Причины диссоциации веществ в воде Вода - полярная молекула Вода ослабляет взаимодействие между ионами в 81
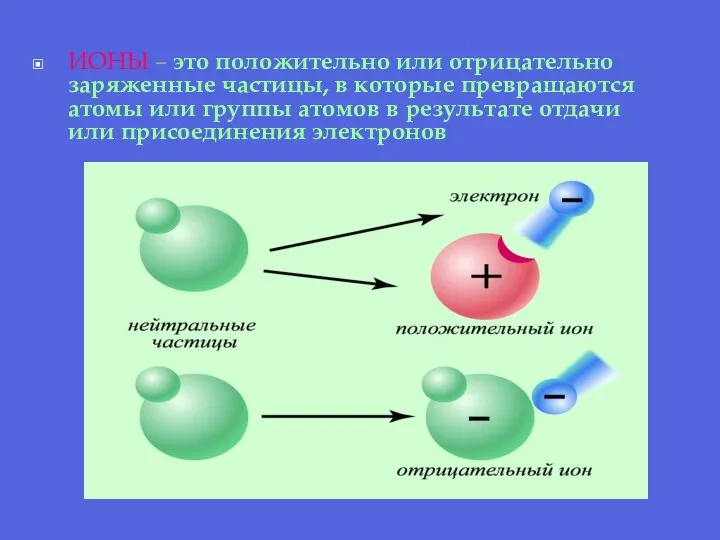
- 17. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
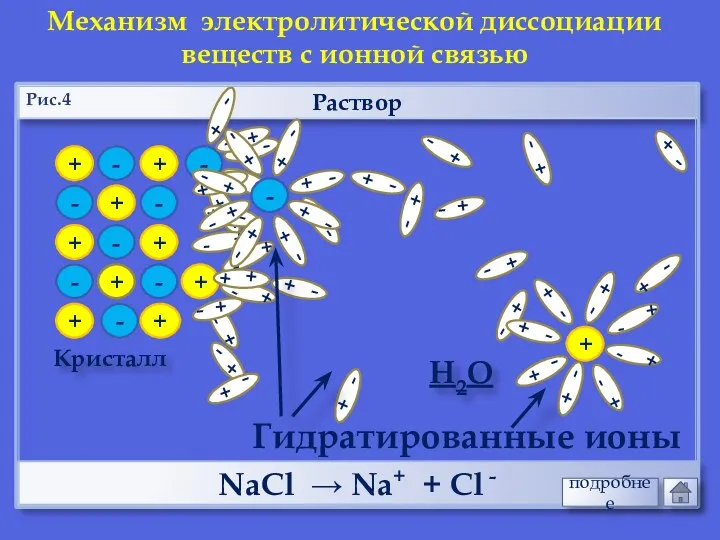
- 18. + + - - + + - - Раствор Кристалл - + + + - -
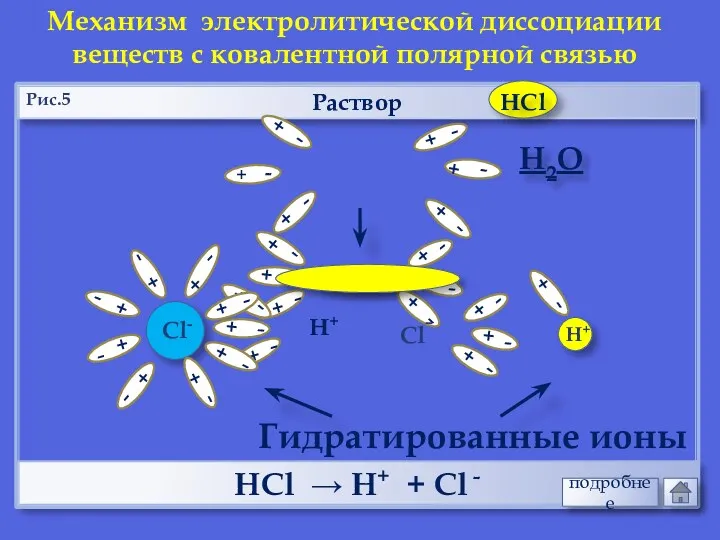
- 19. Раствор НCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связью Н2О
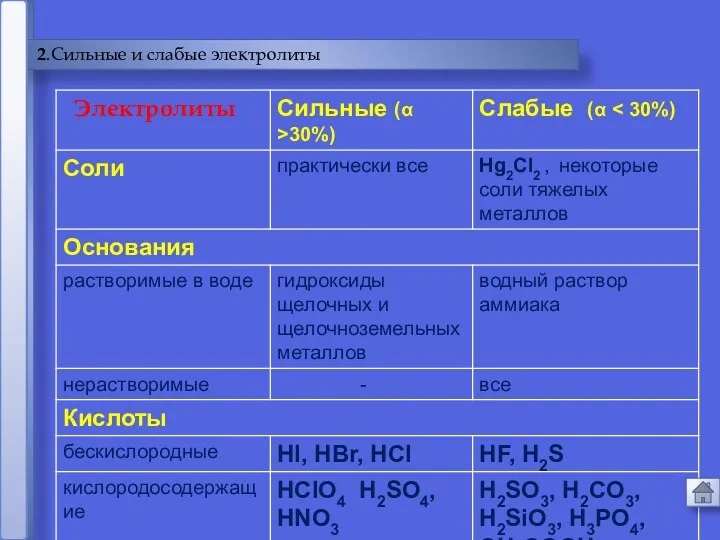
- 20. 2.Сильные и слабые электролиты HCl + + + Сильные и слабые Рис.6.
- 21. Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
- 22. 2.Сильные и слабые электролиты Электролиты
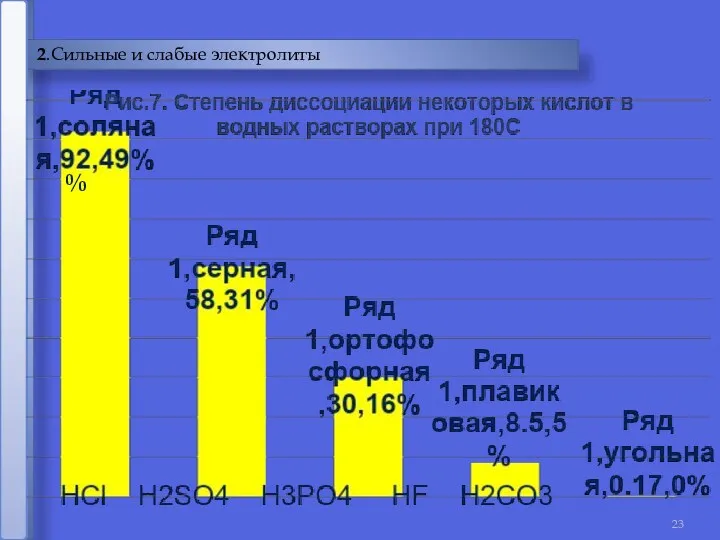
- 23. 2.Сильные и слабые электролиты %
- 26. Основные положения ТЭД 4..Электролитическая диссоциация для слабых электролитов – процесс обратимый. Обратный процесс – ассоциация. 5..Не
- 27. 12.11.2020 это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы
- 28. 12.11.2020 это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы.
- 29. 12.11.2020 это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка.
- 30. 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных
- 31. 6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека подробнее
- 32. Значение теории электролитической диссоциации ТЭД позволила объяснить свойства водных растворов электролитов и объяснила теорию кислот и
- 33. Значение теории электролитической диссоциации Обосновала механизм многих органических реакций и помогла физиологам в изучении состава и
- 34. Выводы ТЭД была предложена в 1887 году шведским ученым Сванте Августом Аррениусом. Классическая теория электролитический диссоциации
- 35. Выводы Степень диссоциации зависит от природы электролита и его концентрации. По степени диссоциации электролиты делят на
- 36. Алгоритм написания уравнений диссоциации сильных электролитов Запишите формулу электролита – сульфата алюминия Al2(SO4)3 2.Расставьте заряды ионов,
- 37. Алгоритм написания уравнений диссоциации слабых электролитов Запишите формулу электролита – гидроксида меди (II) Cu(OH)2 2.Расставьте заряды
- 38. 12.11.2020 Русецкая О.П.
- 40. Скачать презентацию

























 Фенолы+
Фенолы+ Классификация химических реакций
Классификация химических реакций Механизмы органических реакций
Механизмы органических реакций Химия в повседневной жизни человека
Химия в повседневной жизни человека Водород
Водород Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ Поширення металів у природі
Поширення металів у природі Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот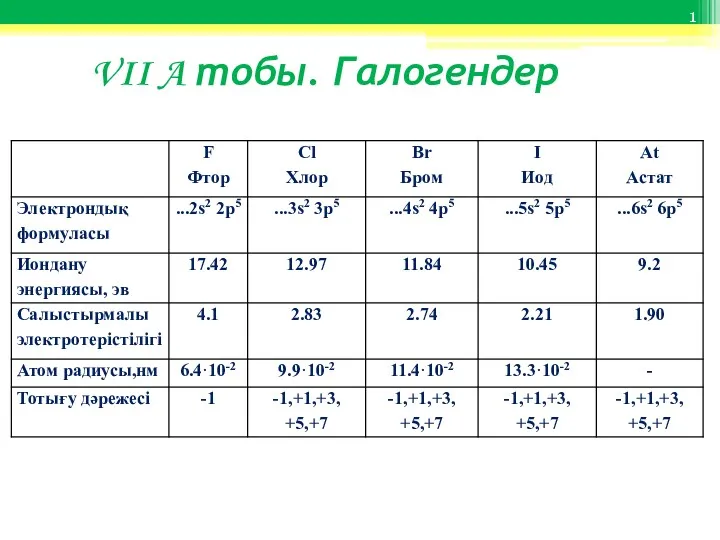 VII A тобы. Галогендер
VII A тобы. Галогендер Агрегатные состояния вещества
Агрегатные состояния вещества Технология производства бутилкаучука
Технология производства бутилкаучука Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс
Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс Разделение углеводородных газов
Разделение углеводородных газов Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Будова електронних оболонок атомів
Будова електронних оболонок атомів Свойства химических элементов и закономерность их изменения
Свойства химических элементов и закономерность их изменения Значение органической химии в жизни человека
Значение органической химии в жизни человека Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Майлардың анықтамасы
Майлардың анықтамасы Харчові добавки
Харчові добавки Реакции ионного обмена
Реакции ионного обмена Хімічні властивості оксидів
Хімічні властивості оксидів Колоїдний захист
Колоїдний захист Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды