Содержание
- 2. Цели урока: Знать строение и свойства азотной кислоты и ее солей. Уметь составлять уравнения реакций, отражающие
- 3. O H O N Структурная формула O Строение молекулы азотной кислоты:
- 4. Физические свойства Бесцветная, дымящаяся, неограниченно растворимая в воде жидкость, обладающая резким раздражающим запахом. t°пл.= -41°C; t°кип.=
- 5. Получение. Лабораторный способ: Действие конц. серной кислоты на кристаллические нитраты. KNO3 + H2SO4(конц) = KHSO4 +
- 6. Получение. Промышленный способ осуществляется в 3 этапа: 1) Окисление аммиака на платиновом катализаторе до NO 4NH3
- 7. ХИМИЧЕСКИЕ СВОЙСТВА - Общие с другими кислотами - - Специфические свойства
- 8. Общие химические свойства HNO3: Очень сильная кислота. Диссоциирует в водном растворе практически нацело. HNO3 H++NO3-
- 9. Разбавленная азотная кислота проявляет все свойства кислот: 1. взаимодействует с основными и амфотерными оксидами. 2. взаимодействует
- 10. HNO3: Реагирует с основными и амфотерными оксидами CuO + 2HNO3 = Cu(NO3)2 + H2O CuO +
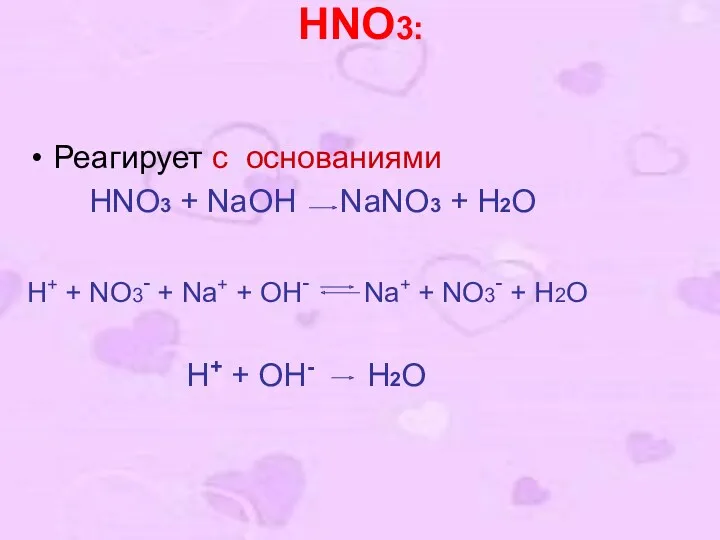
- 11. HNO3: Реагирует с основаниями HNO3 + NaOH NaNO3 + H2O H+ + NO3- + Na+ +
- 12. HNO3: вытесняет слабые кислоты из их солей 2HNO3 + Na2CO3 2NaNO3 + H2O + CO2 2H+
- 13. Азотная кислота проявляет особые свойства: Взаимодействие с металлами Взаимодействие с неметаллами Взаимодействие с органическими соединениями Разложение
- 14. Специфические свойства азотной кислоты При взаимодействии с металлами никогда не выделяется водород!! металл + HNO3 =
- 15. Азотная кислота: взаимодействие с металлами.
- 16. Реакция с металлами: Большинство металлов реагируют с азотной кислотой с выделением азота или его оксидов в
- 17. HNO3 реагирует с неметаллами: Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих
- 18. Азотная кислота 1. Разлагается на свету и при нагревании: 4HNO3 = 2H2O + 4NO2 + O2
- 19. Реакции с органическими веществами: Окрашивает белки в желтый цвет ("ксантопротеиновая реакция")
- 20. Качественная реакция на ион NO3- Вещество + медные стружки + H2SO4(к.)+ t0 NaNO3 + H2SO4(к.) =
- 21. Соли азотной кислоты называются нитратами (селитрами) NaNO3 – нитрат натрия Cu(NO3)2 – нитрат меди(II)
- 22. РАЗЛОЖЕНИЕ НИТРАТОВ при нагревании: 1) Нитраты щелочных металлов разлагаются до нитритов: 2NaNO3 = 2NaNO2 + O2
- 24. Скачать презентацию




















 Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску
Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Поліметилметакрилат
Поліметилметакрилат Elements of group 2 (IIA)
Elements of group 2 (IIA) Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Прості й складні речовини. Хімічні формули. Метали і неметали
Прості й складні речовини. Хімічні формули. Метали і неметали Хімічні формули речовин
Хімічні формули речовин Кислородные соединения азота
Кислородные соединения азота Альтернативная елочка из кристаллов
Альтернативная елочка из кристаллов Генетическая связь между основными классами неорганических соединений
Генетическая связь между основными классами неорганических соединений Моносахариды. Изомерия моносахаридов
Моносахариды. Изомерия моносахаридов Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Катионы IV, V, VI аналитических групп
Катионы IV, V, VI аналитических групп Задания С 3 для подготовки к ГИА -9 по химии
Задания С 3 для подготовки к ГИА -9 по химии Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Углеводы, липиды
Углеводы, липиды Углеводы. Урок №9. 9 класс
Углеводы. Урок №9. 9 класс Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн
Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Воздух и его состав
Воздух и его состав 20230816_himiya_spirty
20230816_himiya_spirty Алкены. Этилен, его получение
Алкены. Этилен, его получение Живая» и «мёртвая» вода
Живая» и «мёртвая» вода Химические свойства металлов
Химические свойства металлов Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева