Содержание
- 2. Хемилюминесценция при перекисном окислении липидов
- 3. Триггерная функция Fe2+ При γ = 0 При [Fe2+] > [Fe2+] *, γ γ = kp([Fe2+]*
- 4. Железо как про- и антиоксидант [Fe2+] > [Fe2+] * γ [Fe2+] γ > 0 Скорость цепного
- 5. Уравнения реакций цепного окисления липидов
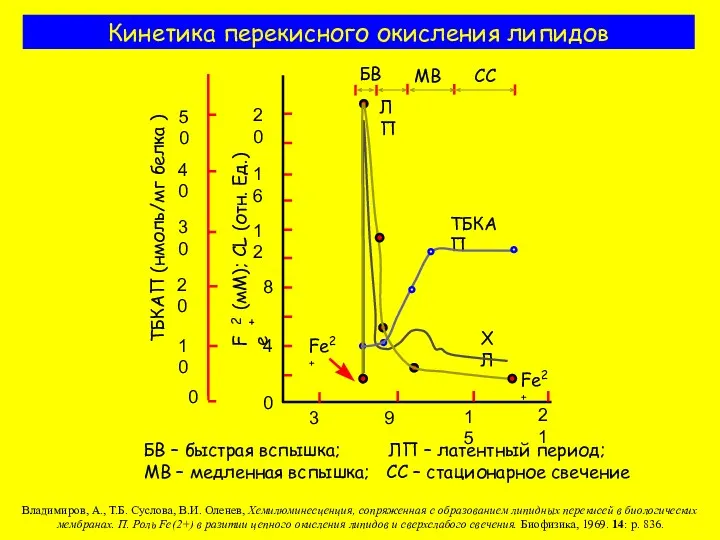
- 6. Кинетика перекисного окисления липидов БВ – быстрая вспышка; ЛП – латентный период; МВ – медленная вспышка;
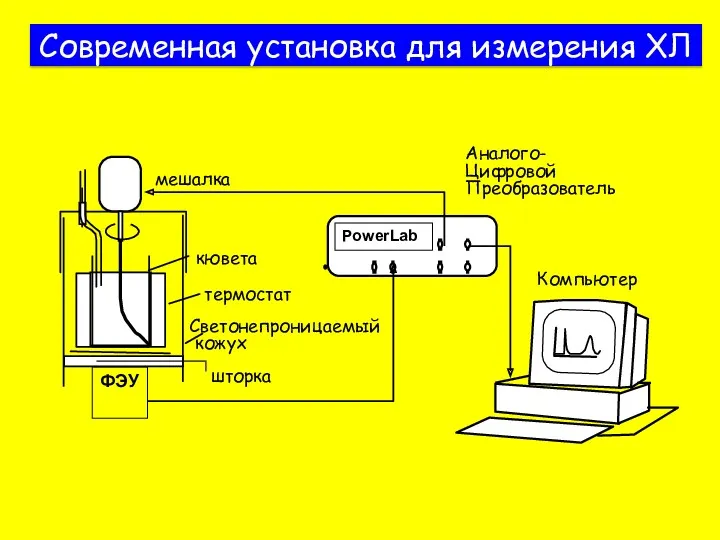
- 7. Современная установка для измерения ХЛ
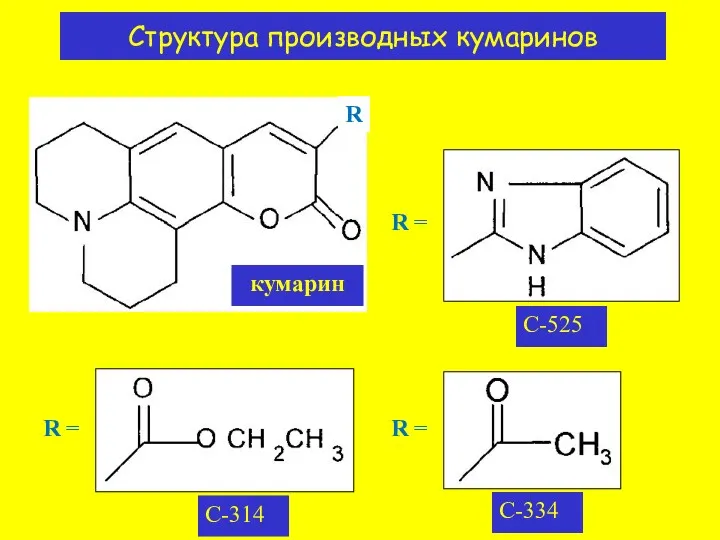
- 8. Структура производных кумаринов кумарин C-525 C-314 C-334 R = R = R = R
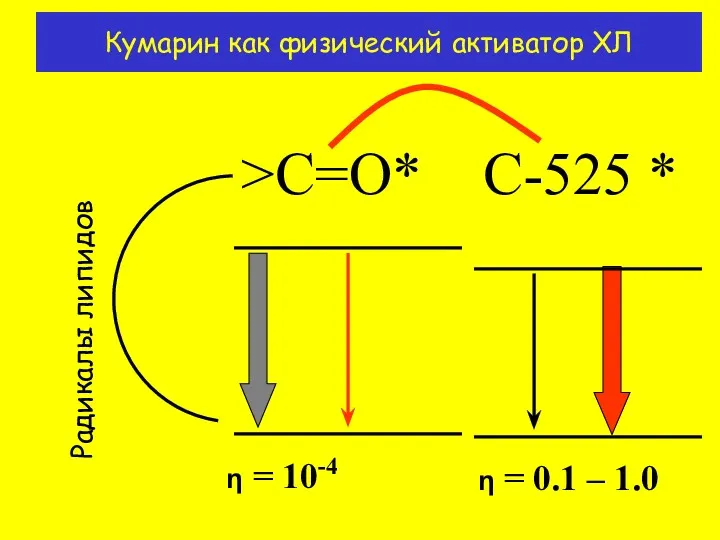
- 9. Кумарин как физический активатор ХЛ
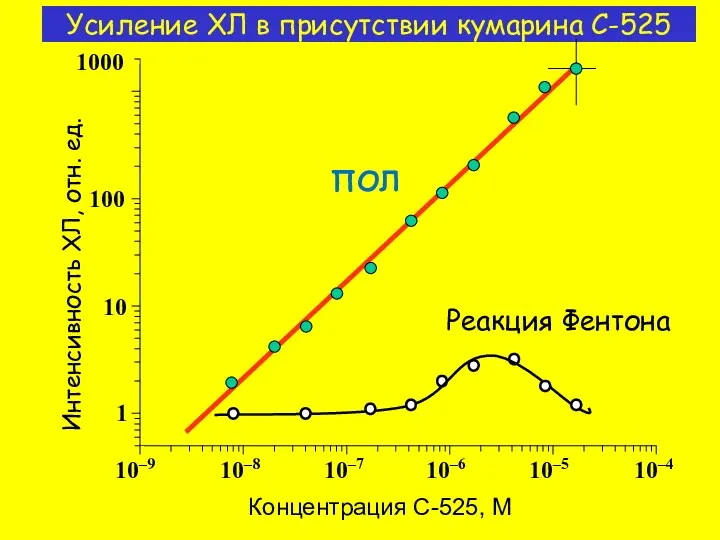
- 10. ПОЛ Реакция Фентона Концентрация C-525, M Интенсивность ХЛ, отн. ед. Усиление ХЛ в присутствии кумарина С-525
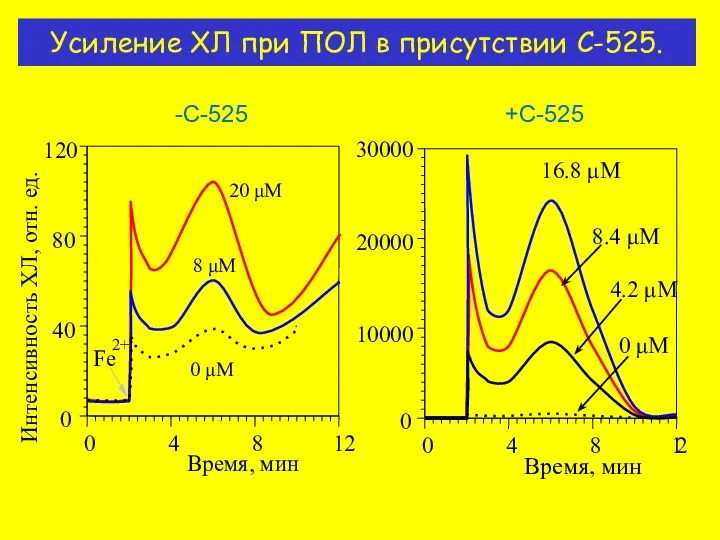
- 11. Усиление ХЛ при ПОЛ в присутствии C-525. -С-525 +С-525
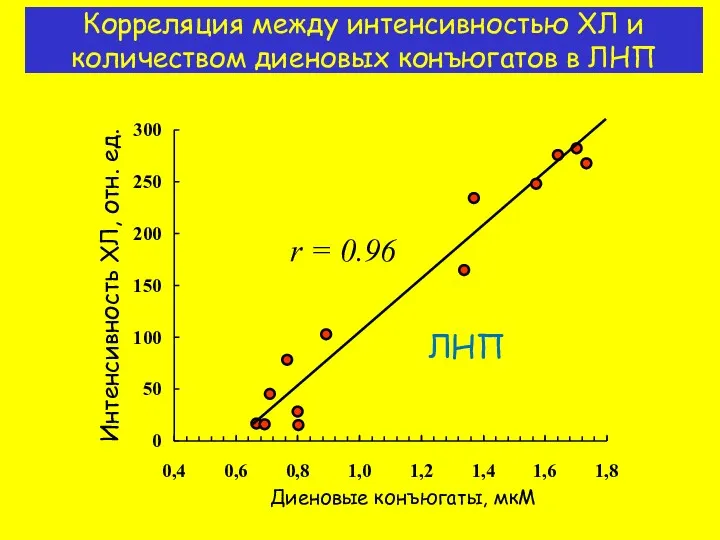
- 12. Корреляция между интенсивностью ХЛ и количеством диеновых конъюгатов в ЛНП
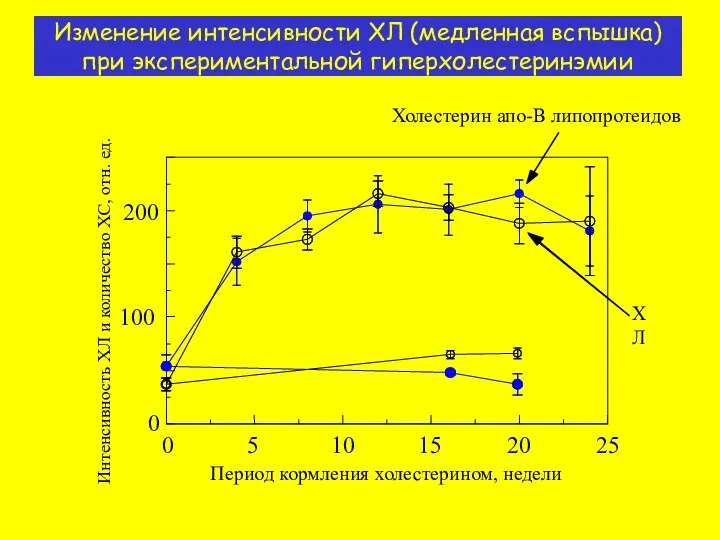
- 13. Изменение интенсивности ХЛ (медленная вспышка) при экспериментальной гиперхолестеринэмии Период кормления холестерином, недели Холестерин апо-B липопротеидов ХЛ
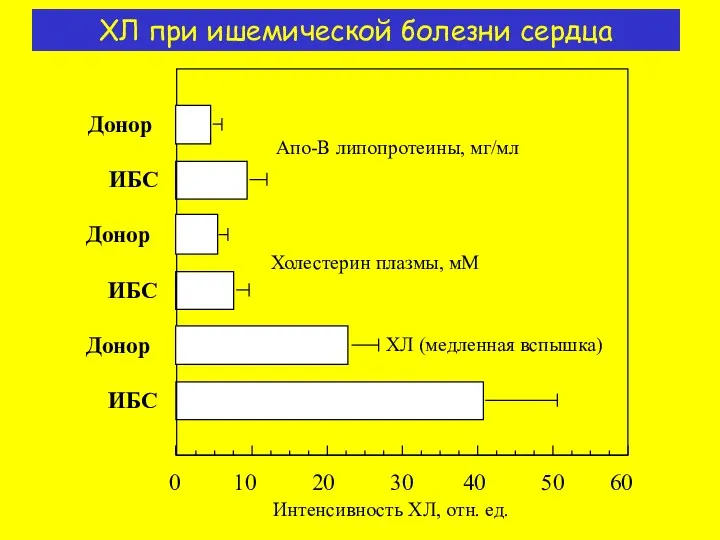
- 14. ХЛ при ишемической болезни сердца
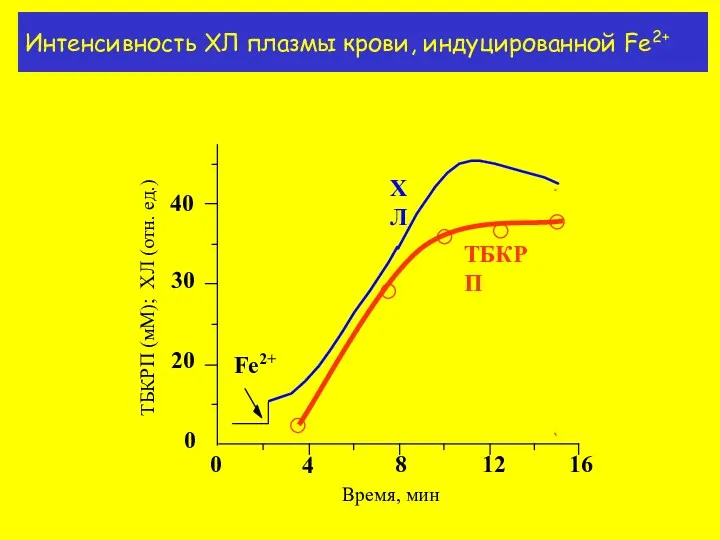
- 15. Интенсивность ХЛ плазмы крови, индуцированной Fe2+
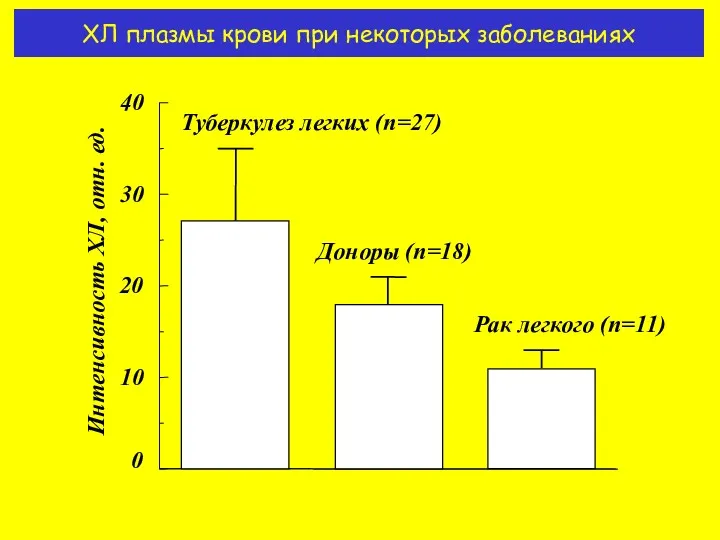
- 16. ХЛ плазмы крови при некоторых заболеваниях
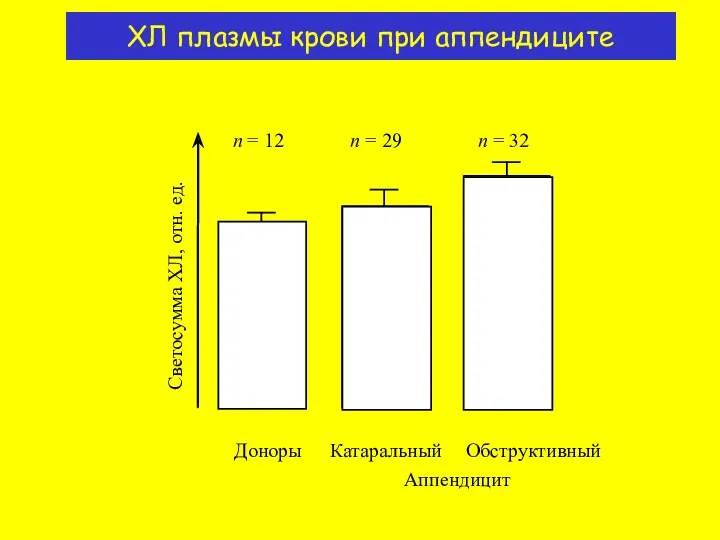
- 17. n = 12 n = 29 n = 32 Светосумма ХЛ, отн. ед. Доноры Аппендицит Катаральный
- 18. Действие радикалов на клеточные структуры
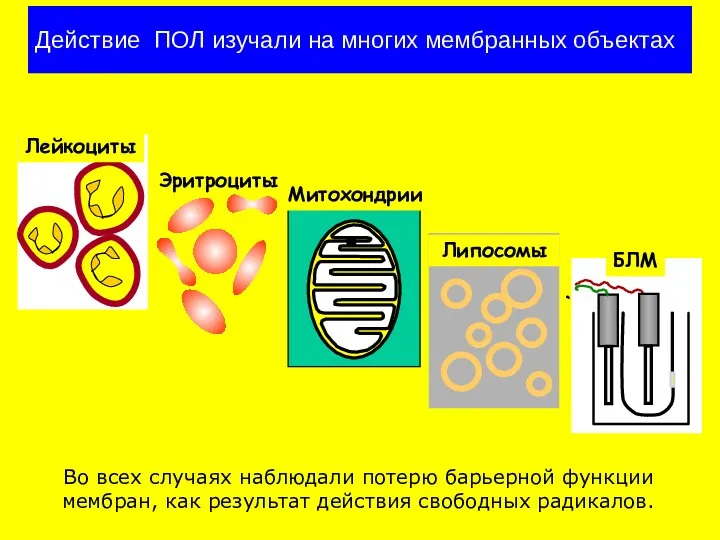
- 19. Действие ПОЛ изучали на многих мембранных объектах Во всех случаях наблюдали потерю барьерной функции мембран, как
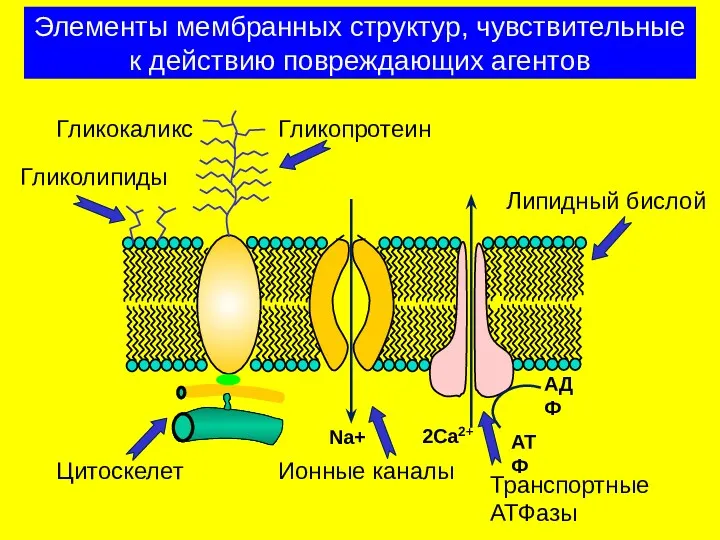
- 20. Элементы мембранных структур, чувствительные к действию повреждающих агентов АТФ АДФ Na+ 2Ca2+ Гликокаликс Гликопротеин Гликолипиды Ионные
- 21. Действие перекисного окисления липидов на –белки
- 22. Действие перекисного окисления липидов на мембранные белки Окисление тиоловых групп Обратимое: R1SH + HSR2 ⇔ R1SSR2
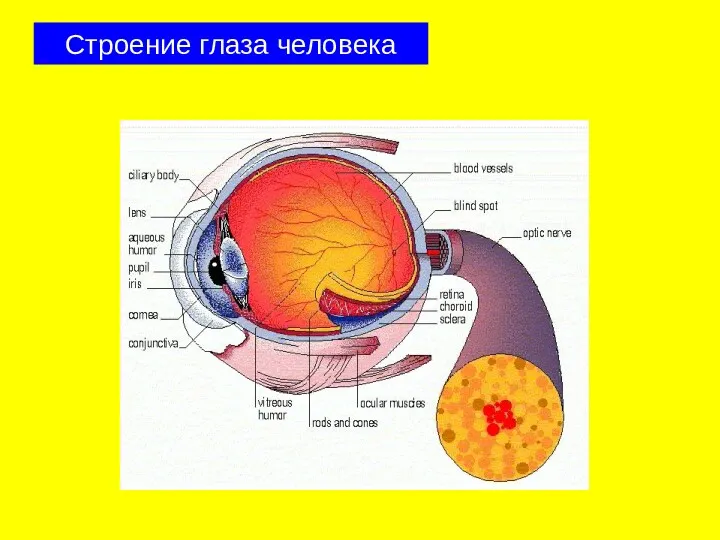
- 23. Строение глаза человека
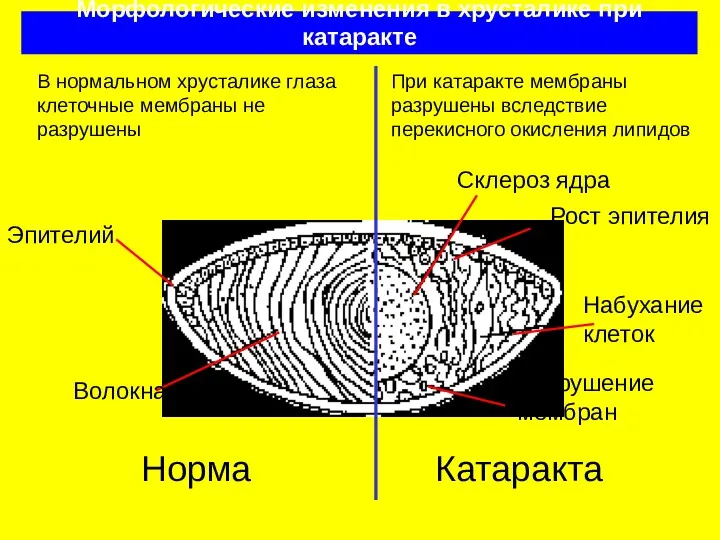
- 24. Морфологические изменения в хрусталике при катаракте Норма Эпителий Волокна Склероз ядра Набухание клеток Катаракта Рост эпителия
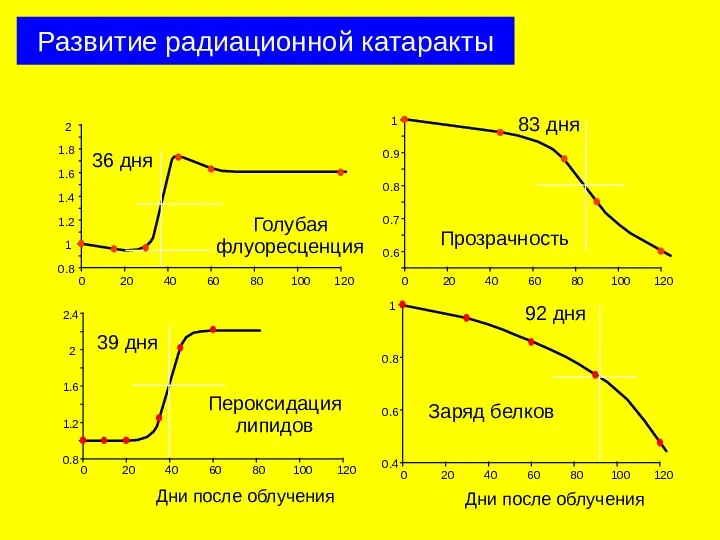
- 25. Развитие радиационной катаракты
- 26. 0 40 80 120 0.4 1.2 0.8 Lens transparency [GSH]/[GSH]0 0.4 1.2 0.8 0 0 40
- 27. Действие липопероксидации на –Ca2+-транспортную АТФазу
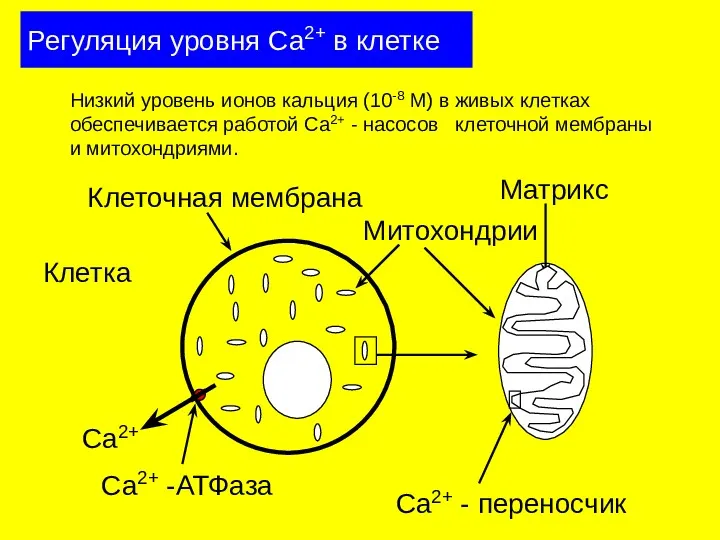
- 28. Регуляция уровня Са2+ в клетке Клетка Ca2+ Низкий уровень ионов кальция (10-8 М) в живых клетках
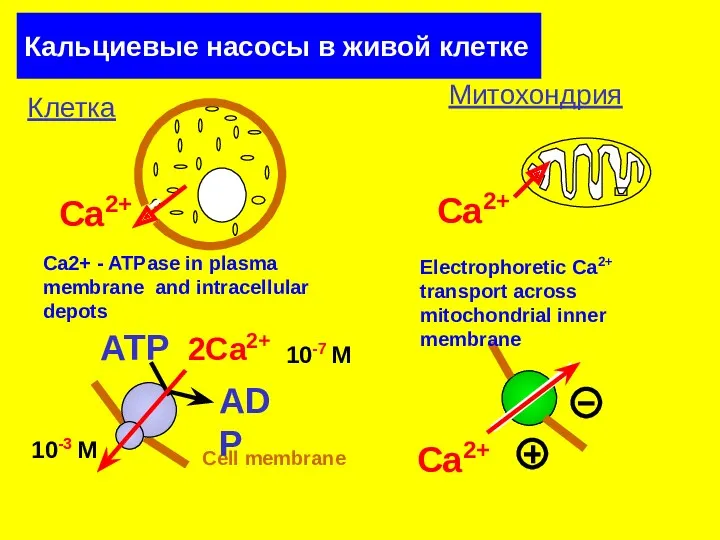
- 29. Кальциевые насосы в живой клетке Cell membrane 2Ca2+ 10-7 М 10-3 М Ca2+ Ca2+ - ATPase
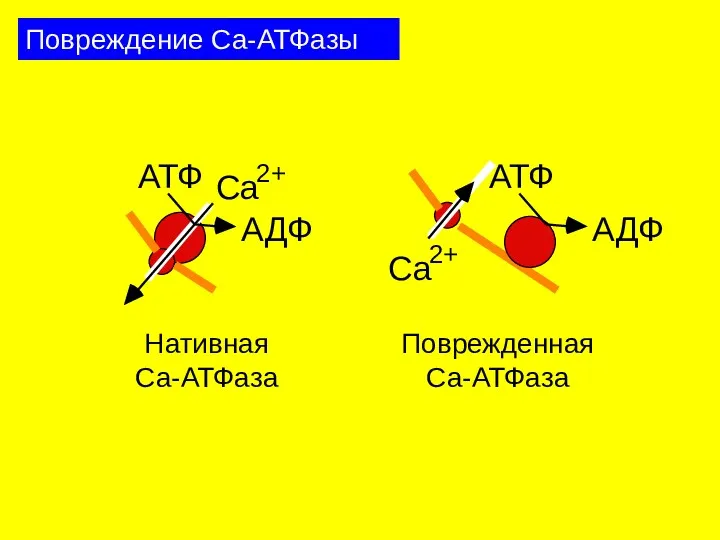
- 30. Повреждение Са-АТФазы Ca 2+ АТФ АДФ Нативная Ca-АТФаза Поврежденная Ca-АТФаза
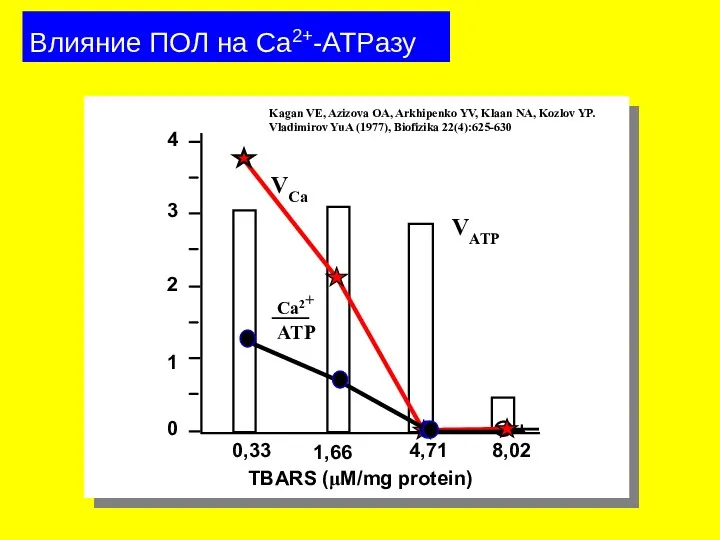
- 31. Влияние ПОЛ на Ca2+-ATPазу 0,33 1,66 4,71 8,02 0 1 2 3 4 VATP TBARS (μM/mg
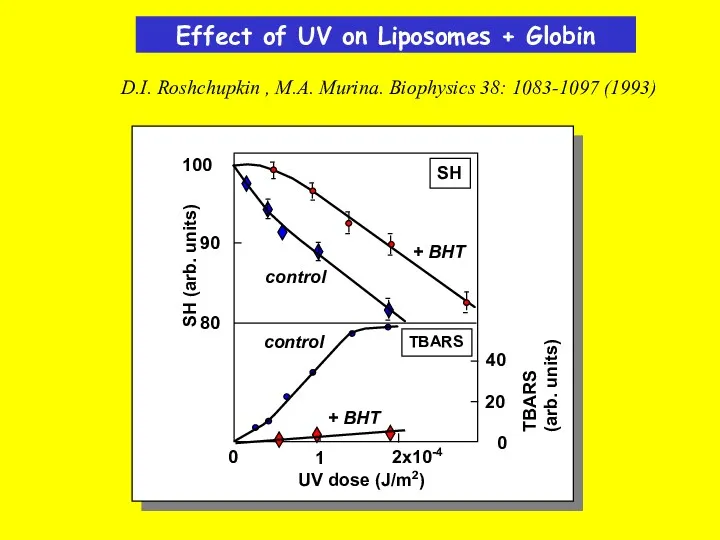
- 32. Effect of UV on Liposomes + Globin D.I. Roshchupkin , M.A. Murina. Biophysics 38: 1083-1097 (1993)
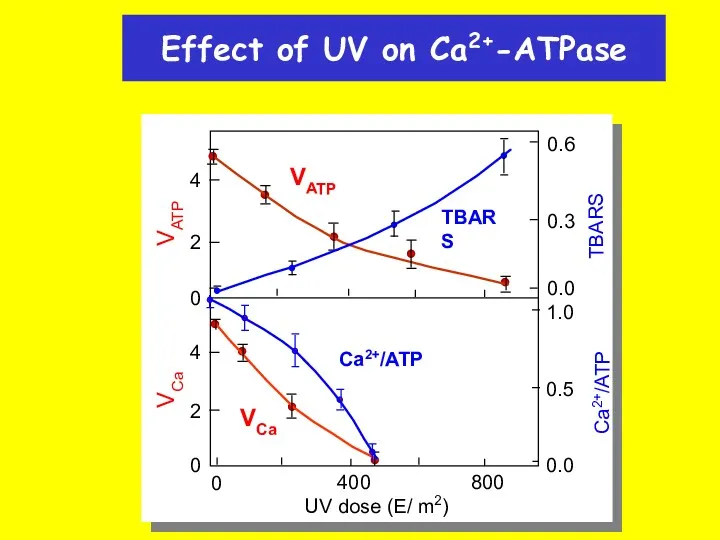
- 33. Effect of UV on Ca2+-ATPase VATP 4 2 0 4 2 0 VCa TBARS 0.6 0.3
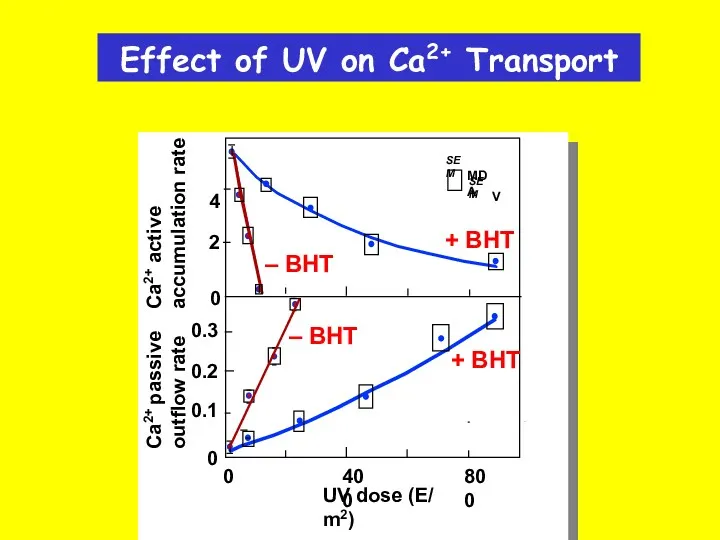
- 34. Effect of UV on Ca2+ Transport SEM MDA SEM V 0.3 4 0 2 0 0.2
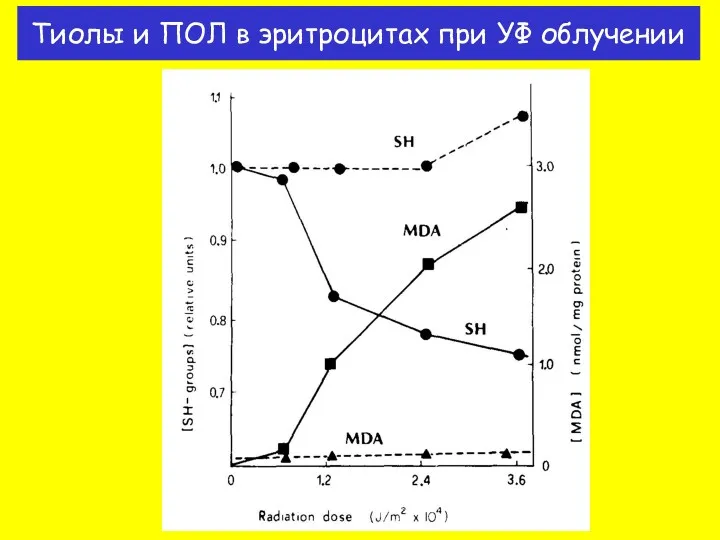
- 35. Тиолы и ПОЛ в эритроцитах при УФ облучении
- 36. На какие элементы биологических мембран действуют свободные радикалы? На каких объектах изучали действие липидной пероксидации на
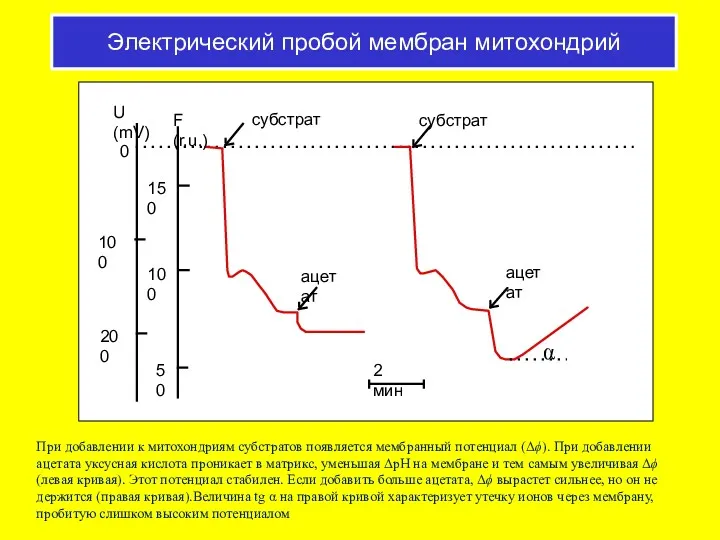
- 37. Электрический пробой мембран при перекисном окислении липидов
- 38. Изучение электрического пробоя на БЛМ
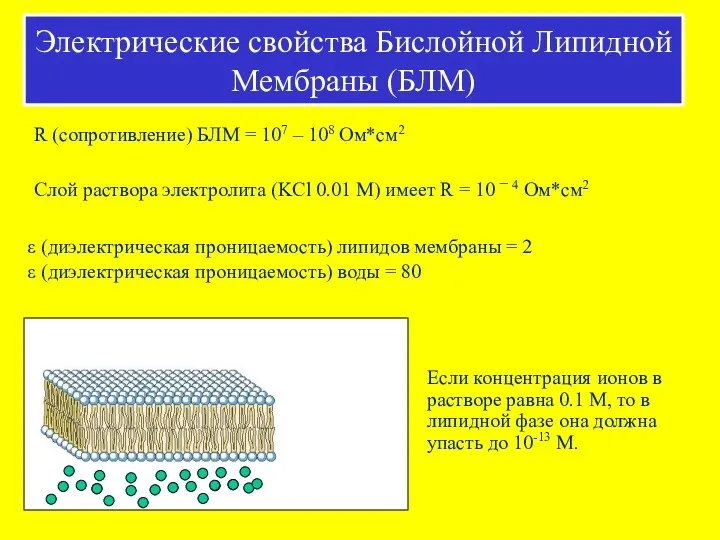
- 39. R (сопротивление) БЛМ = 107 – 108 Ом*см2 Слой раствора электролита (KCl 0.01 М) имеет R
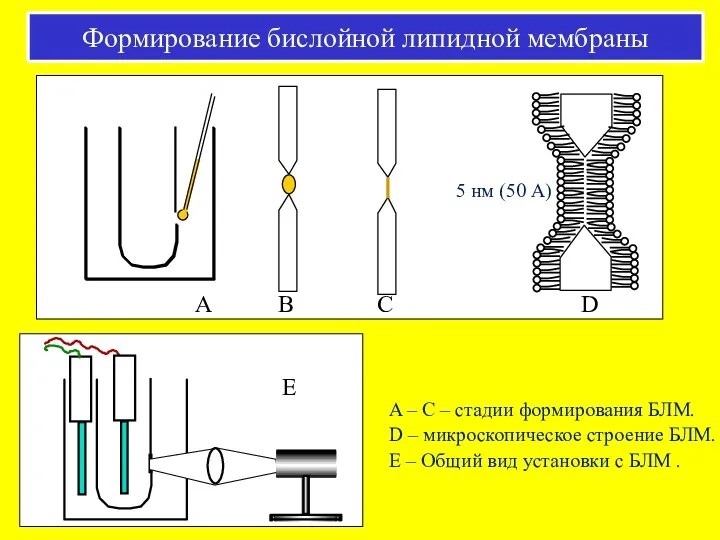
- 40. 5 нм (50 А) A – C – стадии формирования БЛМ. D – микроскопическое строение БЛМ.
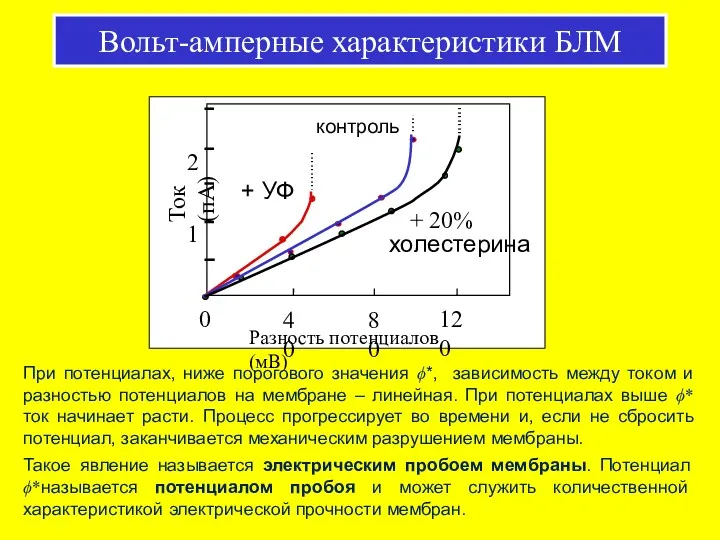
- 41. Вольт-амперные характеристики БЛМ При потенциалах, ниже порогового значения ϕ*, зависимость между током и разностью потенциалов на
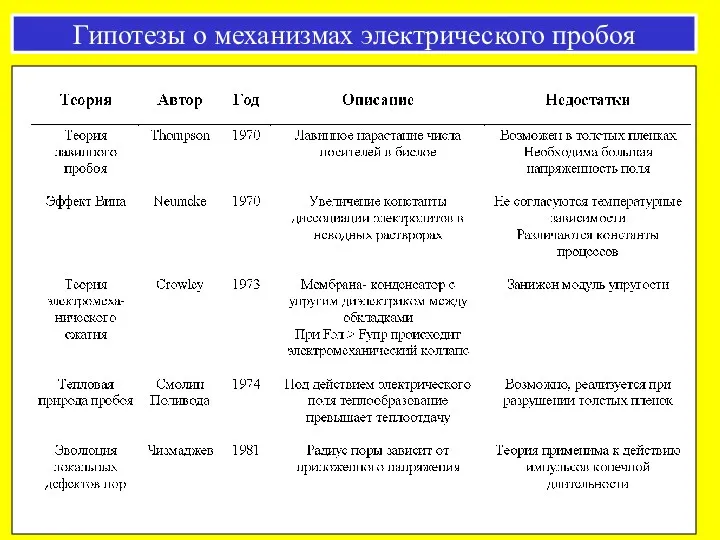
- 42. Гипотезы о механизмах электрического пробоя
- 43. Неспецифическая проницаемость для разных низкомолекулярных веществ; Локальность изменения свойств мембраны; Резкое увеличение скорости флип-флопа липидов; Существование
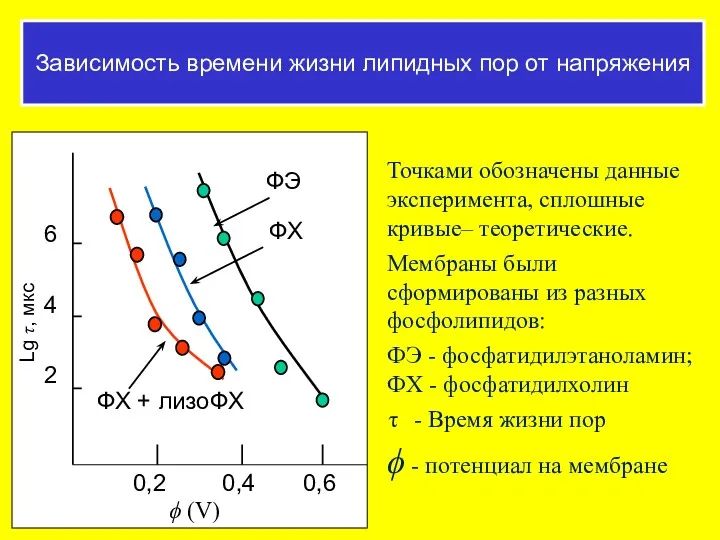
- 44. Зависимость времени жизни липидных пор от напряжения Точками обозначены данные эксперимента, сплошные кривые– теоретические. Мембраны были
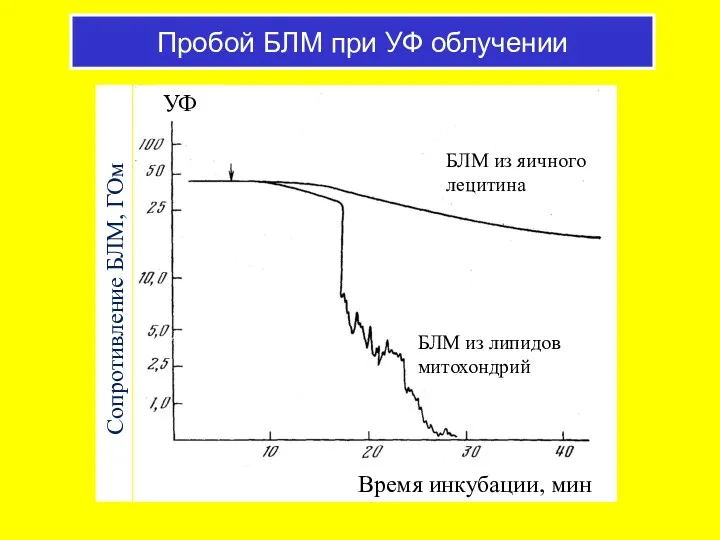
- 45. Пробой БЛМ при УФ облучении БЛМ из липидов митохондрий БЛМ из яичного лецитина УФ Сопротивление БЛМ,
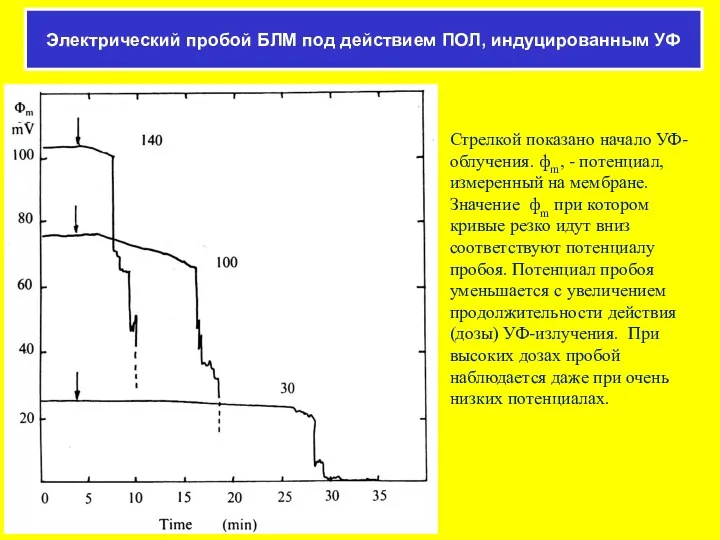
- 46. Стрелкой показано начало УФ-облучения. фm, - потенциал, измеренный на мембране. Значение фm при котором кривые резко
- 47. 1 2 3 4 5 6 7 8 9 120 100 80 60 40 20 0
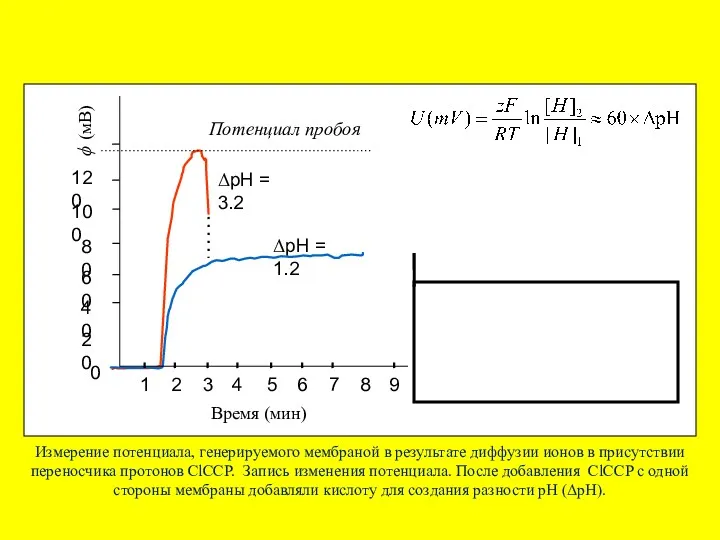
- 48. Электрический пробой мембран собственным мембранным потенциалом Источником электродвижущей силы в данном случае служит сама мембрана, по
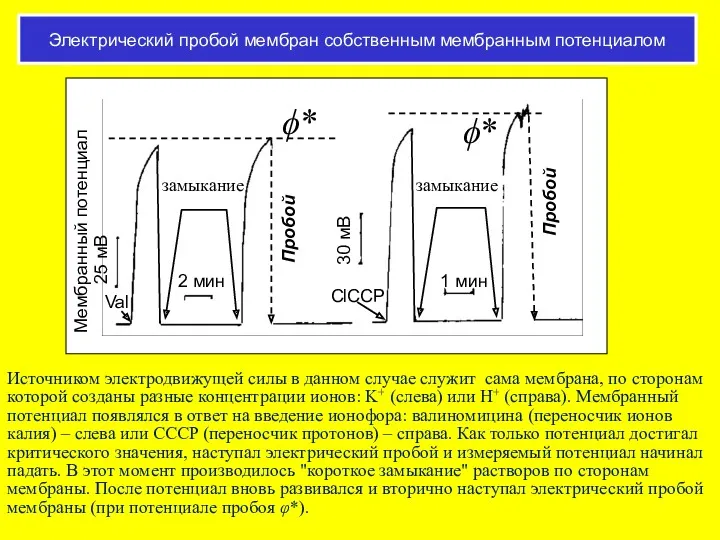
- 49. Пробой БЛМ при разном диффузионном потенциале Две величины - величина потенциала пробоя и время жизни мембраны
- 50. Изучение электрического пробоя в липосомах
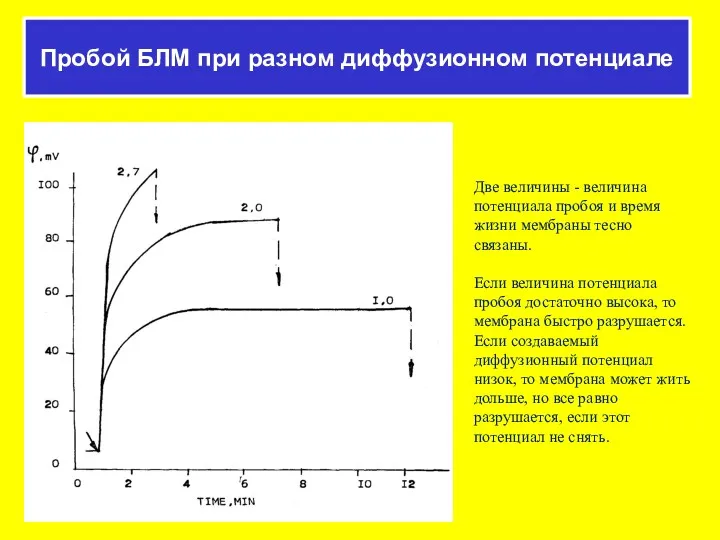
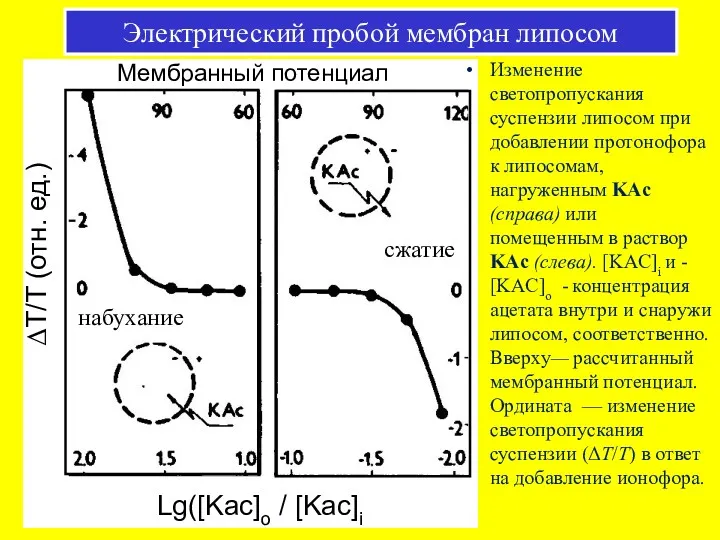
- 51. Электрический пробой мембран липосом Изменения светопропускания суспензии липосом при добавлении ацетата калия (KAc) и протонофора (ClCCP).
- 52. ΔT/T (отн. ед.) Мембранный потенциал Изменение светопропускания суспензии липосом при добавлении протонофора к липосомам, нагруженным KAc
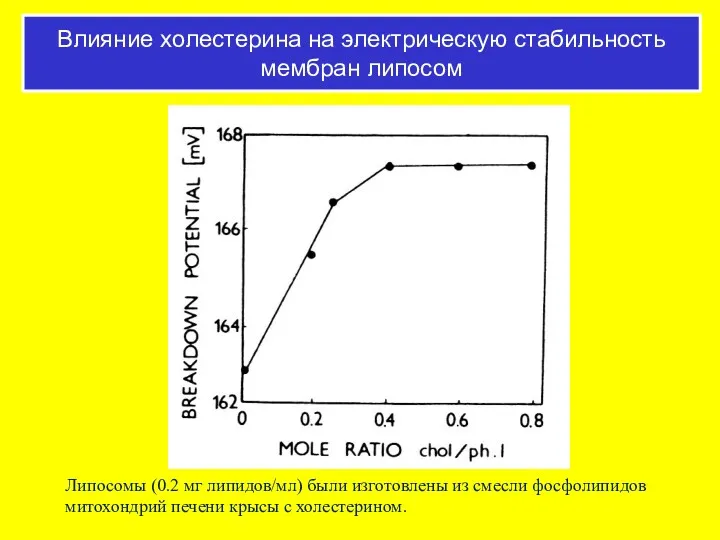
- 53. Липосомы (0.2 мг липидов/мл) были изготовлены из смесли фосфолипидов митохондрий печени крысы с холестерином. Влияние холестерина
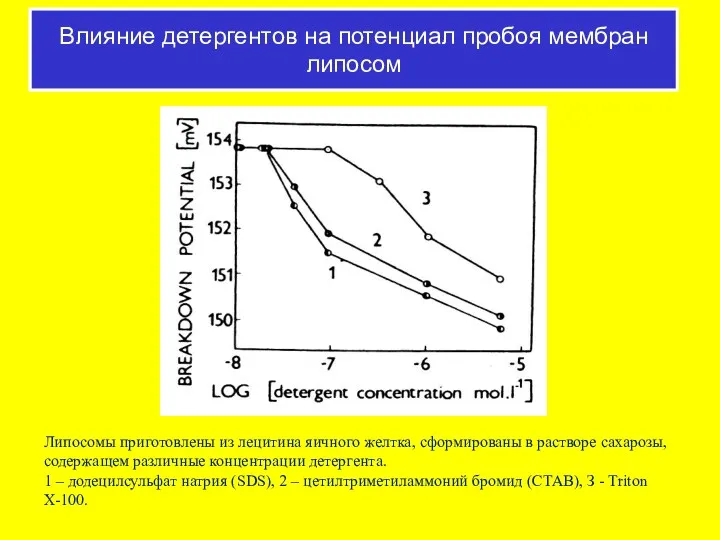
- 54. Липосомы приготовлены из лецитина яичного желтка, сформированы в растворе сахарозы, содержащем различные концентрации детергента. 1 –
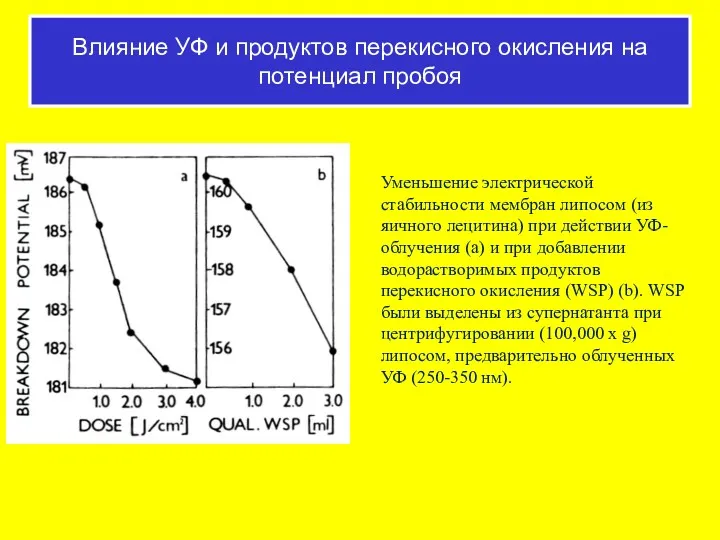
- 55. Уменьшение электрической стабильности мембран липосом (из яичного лецитина) при действии УФ-облучения (а) и при добавлении водорастворимых
- 56. Изучение электрического пробоя мембран митохондрий
- 57. Электрический пробой мембран митохондрий При добавлении к митохондриям субстратов появляется мембранный потенциал (Δϕ). При добавлении ацетата
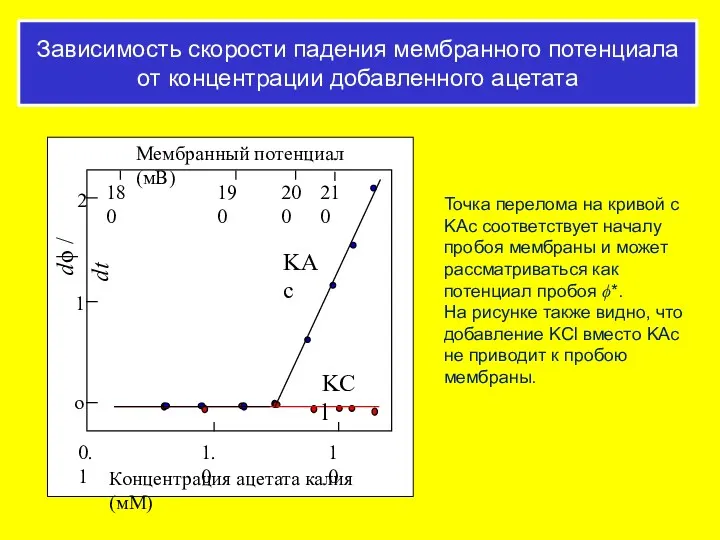
- 58. Зависимость скорости падения мембранного потенциала от концентрации добавленного ацетата Точка перелома на кривой с KAc соответствует
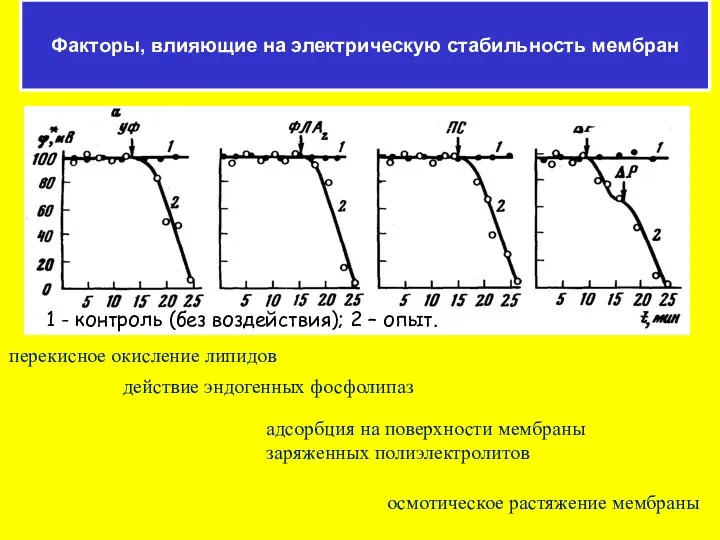
- 59. перекисное окисление липидов действие эндогенных фосфолипаз адсорбция на поверхности мембраны заряженных полиэлектролитов осмотическое растяжение мембраны Факторы,
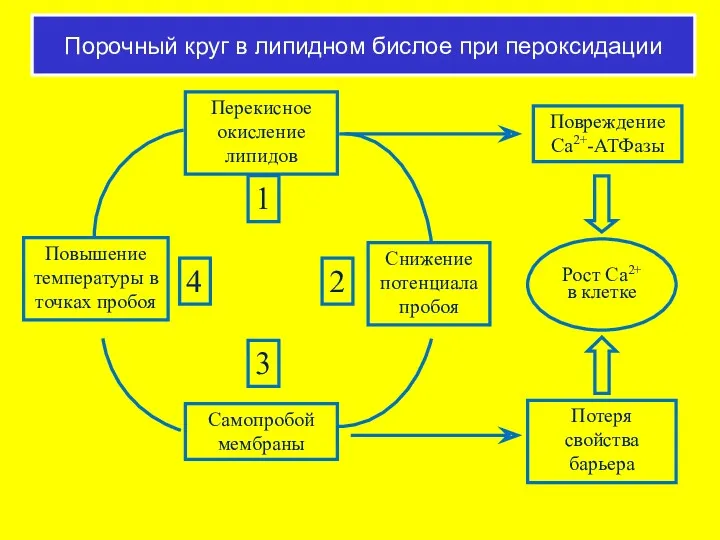
- 60. Порочный круг в липидном бислое при пероксидации Перекисное окисление липидов Самопробой мембраны Повышение температуры в точках
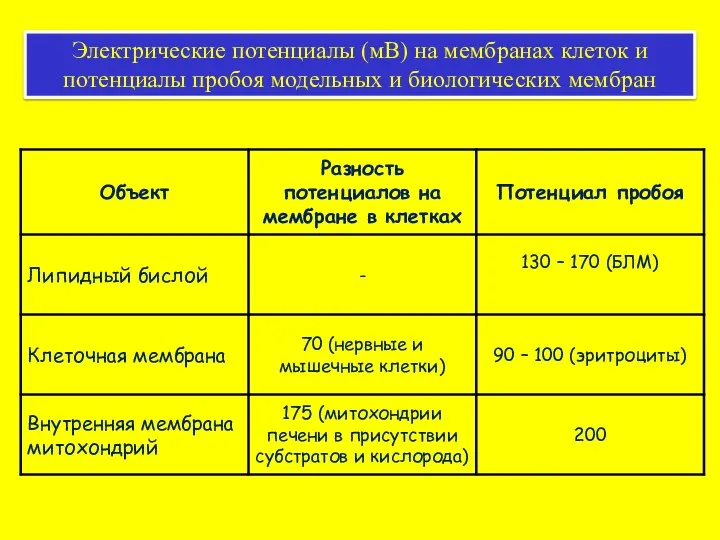
- 61. Электрические потенциалы (мВ) на мембранах клеток и потенциалы пробоя модельных и биологических мембран
- 62. Загрузка клеток лекарственными препаратами Электрослияние клеток Генная трансформация клеток Стерилизация Электростимуляция Применение явления электрического пробоя
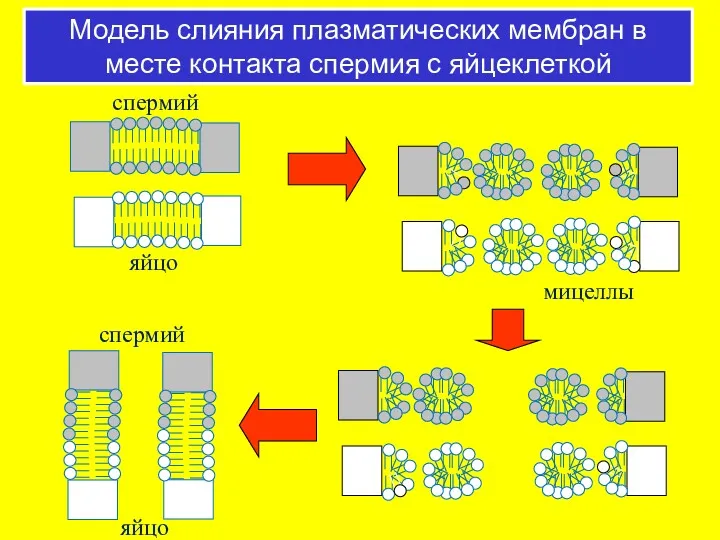
- 63. Модель слияния плазматических мембран в месте контакта спермия с яйцеклеткой
- 64. 1. Физические факторы Величина приложенного потенциала Температура Высокочастотное электромагнитное поле Гидростатическое давление УФ облучение и перекисное
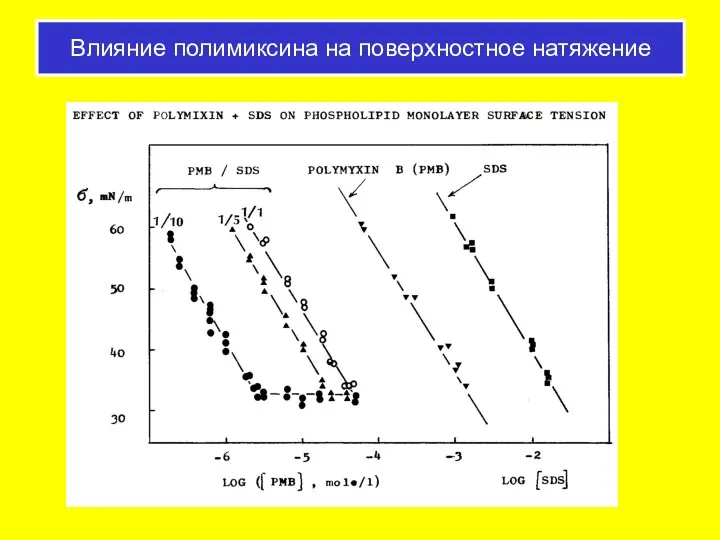
- 65. Влияние полимиксина на поверхностное натяжение
- 67. Скачать презентацию

![Триггерная функция Fe2+ При γ = 0 При [Fe2+] >](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/237160/slide-2.jpg)
![Железо как про- и антиоксидант [Fe2+] > [Fe2+] * γ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/237160/slide-3.jpg)




![0 40 80 120 0.4 1.2 0.8 Lens transparency [GSH]/[GSH]0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/237160/slide-25.jpg)









 Хлороводород и соляная кислота
Хлороводород и соляная кислота Типы химических связей
Типы химических связей Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Общие химические свойства металлов. Химия. 11 класс
Общие химические свойства металлов. Химия. 11 класс Biomass Feedstocks
Biomass Feedstocks Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Тканые армирующие материалы
Тканые армирующие материалы Щелочные металлы
Щелочные металлы Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Донорно-акцепторний механізм утворення ковалентного зв’язку
Донорно-акцепторний механізм утворення ковалентного зв’язку Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Total Synthesis of (−) - Lepenine
Total Synthesis of (−) - Lepenine Периодический закон химических элементов Д. И. Менделеева и периодическая система
Периодический закон химических элементов Д. И. Менделеева и периодическая система Сложные эфиры. Жиры
Сложные эфиры. Жиры Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Изучение и развитие понятия химический элемент в школьном курсе химии
Изучение и развитие понятия химический элемент в школьном курсе химии Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Щелочи
Щелочи Валентність хімічних елементів
Валентність хімічних елементів Реакционная способность соединений с карбонильной группой
Реакционная способность соединений с карбонильной группой Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Разделение неоднородных систем
Разделение неоднородных систем Органическая химия. Ацетилен
Органическая химия. Ацетилен Стекло, его виды и классификация
Стекло, его виды и классификация Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Алкины
Алкины