Содержание
- 2. Алкины Алкины (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд
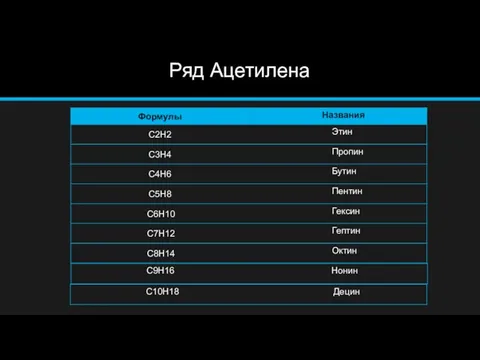
- 3. Ряд Ацетилена
- 4. Номенклатура Алкинов Тройную связь обозначают суффиксом -ин ацетилен (этин) H-C≡C-H CH≡C-CH2-CH3 бутин-1 3,6-диметилгептадиин-1,4 Главная цепь должна
- 5. Строение алкинов Атомы углерода тройной связи находятся в состоянии sp-гибридизации. Сигма-связи, образуемые sp-гибридными атомами углерода, расположены
- 6. Изомерия алкинов 1. Изомерия углеродного скелета CH≡C-CH2-CH2-CH3(пентин-1) 2.Изомерия положения тройной связи CH≡C-CH2-CH3(бутин-1) 3.Межклассовая изомерия CH2=CH-CH=CH2(бутадиен-1,3)
- 7. Физические свойства алкинов Ацетилен, пропин и бутин-1 при комнатной температуре – бесцветные газы, остальные алкины –
- 8. Химические свойства алкинов Гидрирование осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt),
- 9. Химические свойства алкинов Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов
- 10. Химическе свойства алкинов Гидрогалогенирование. Присоединение хлороводорода к ацетилену приводит к образованию винилхлорида (хлорэтена) – мономера для
- 11. Химические реакции алкинов Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл
- 12. Горение 2СН≡СН + 4O2 →CO2 + 2H2O + 3C↓ Так как много углерода в молекулах алкинов,
- 13. Применение Ранее ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план
- 15. Скачать презентацию











 Целлюлоза
Целлюлоза Механізми та наслідки ураження людини небезпечними хімічними речовинами та бойовими отруйними речовинами
Механізми та наслідки ураження людини небезпечними хімічними речовинами та бойовими отруйними речовинами Кислоты: классификация и химические свойства
Кислоты: классификация и химические свойства Правила техники безопасности. Приемы обращения с лабораторным оборудованием. Урок №2. Практическая работа №1
Правила техники безопасности. Приемы обращения с лабораторным оборудованием. Урок №2. Практическая работа №1 Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы Химический анализ состава йогуртов наиболее популярных торговых марок
Химический анализ состава йогуртов наиболее популярных торговых марок Алюминий
Алюминий Соли и их свойства
Соли и их свойства Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Химические реакции
Химические реакции Виртуозы химического эксперимента
Виртуозы химического эксперимента Органическая химия. Скорость химических реакций
Органическая химия. Скорость химических реакций Соединения серы
Соединения серы Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Геохимические показатели техногенеза
Геохимические показатели техногенеза Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Витамины
Витамины ВОДОРОД
ВОДОРОД Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Ароматические углеводороды (арены)
Ароматические углеводороды (арены)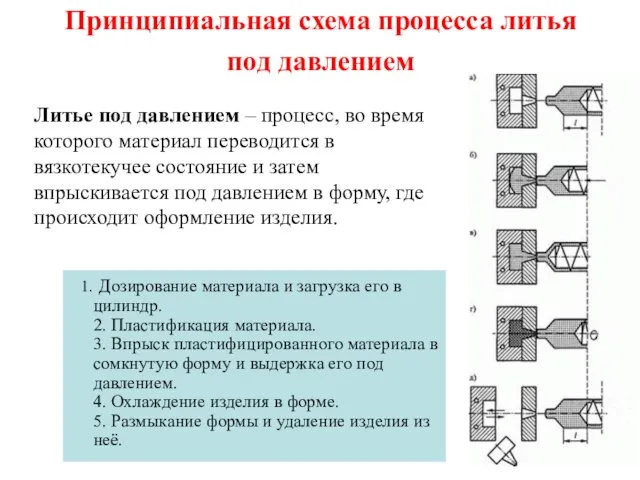 Принципиальная схема процесса литья под давлением
Принципиальная схема процесса литья под давлением Свойства кислот
Свойства кислот 9 Амины
9 Амины Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса