Содержание
- 2. Цели: Повторить, закрепить и обобщить знания учащихся о строении и свойствах атомов химических элементов с использованием
- 3. План занятия: Строение атомов. Изотопы. Состояние электронов в атомах. Классификация химических элементов. Свойства химических элементов. (
- 4. Эпиграф: «Другого ничего в природе нет Ни здесь, ни там в космических глубинах Все от песчинок
- 5. Великое открытие Д.И. Менделеева Кому-то сон веселый снится, Кому-то страшный снится сон. А Менделееву – Таблица
- 6. Химический элемент - это Определенный вид атомов
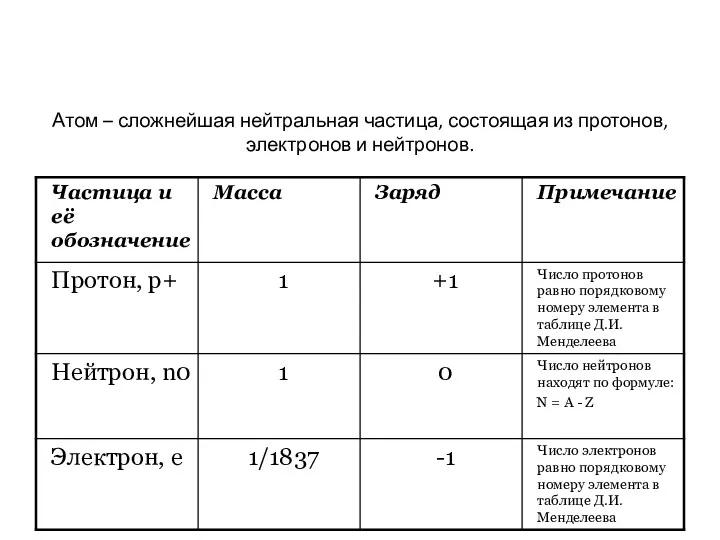
- 7. Атом – сложнейшая нейтральная частица, состоящая из протонов, электронов и нейтронов.
- 8. Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разное
- 9. Каждый изотоп характеризуется двумя величинами: Массовым числом (А) Проставляется вверху слева от химического знака: 37 16
- 10. Среди следующих определений найдите синонимическое понятию «Изотоп». Атомы, имеющие разное количество протонов в ядрах. Атомы одного
- 11. Состояние электронов в атоме. Электрон – это частица и волна. Число энергетических уровней. Виды электронов Максимальное
- 12. Na +11, 11 ē 1s22s22p63s1 1s2 2s2 2p6 3s1
- 13. Cl +17, 17 ē 1s22s22p63s23p5
- 14. Ar +18, 18 ē 1s22s22p63s23p6 1s2 2s2 2p6 3s2 3p6
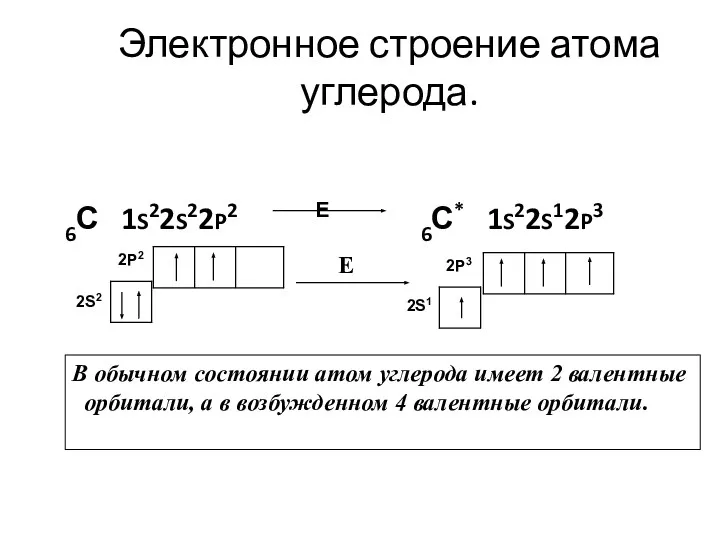
- 15. Электронное строение атома углерода. 6С 1S22S22P2 Е 6С* 1S22S12P3 2S2 2P2 2P3 2S1 Е В обычном
- 16. Определение: Гибридизация – смешение валентных орбиталей и выравнивание их по форме и энергии. (Л.Полинг 1931г.)
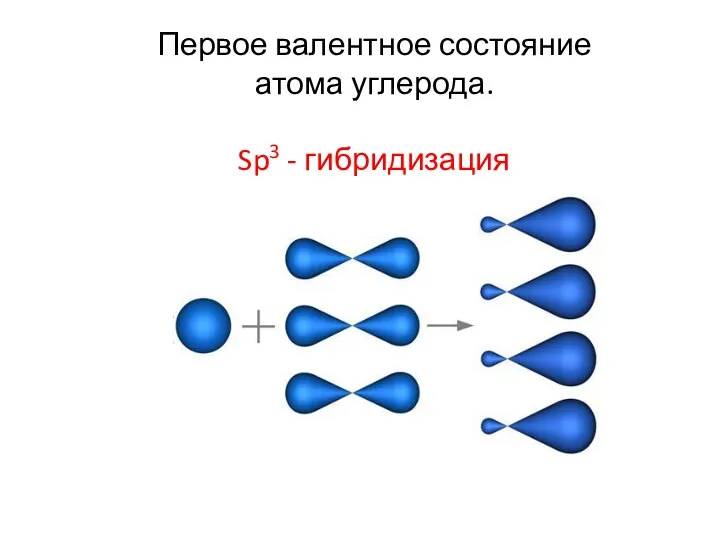
- 17. Первое валентное состояние атома углерода. Sp3 - гибридизация
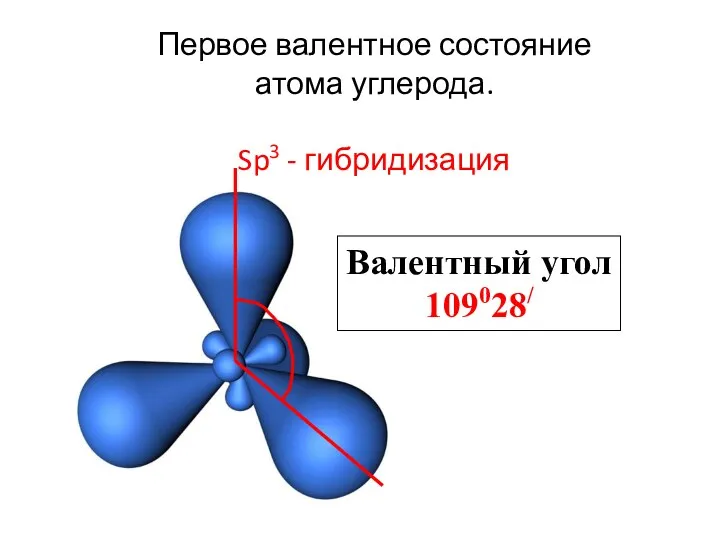
- 18. Первое валентное состояние атома углерода. Sp3 - гибридизация Валентный угол 109028/
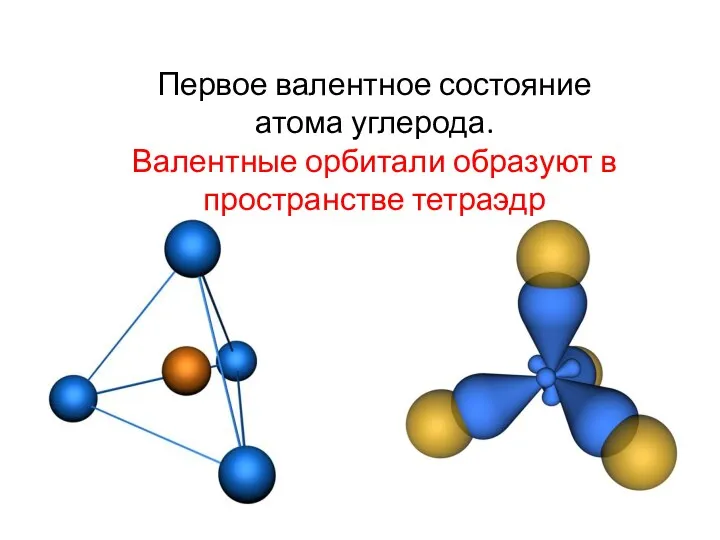
- 19. Первое валентное состояние атома углерода. Валентные орбитали образуют в пространстве тетраэдр
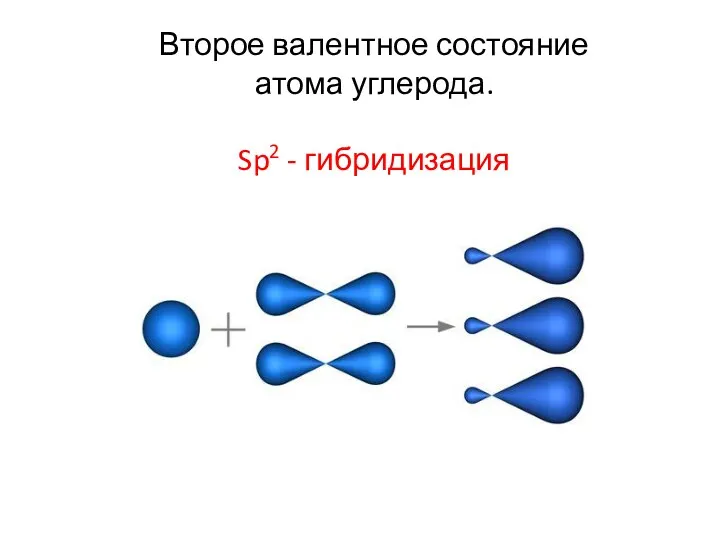
- 20. Второе валентное состояние атома углерода. Sp2 - гибридизация
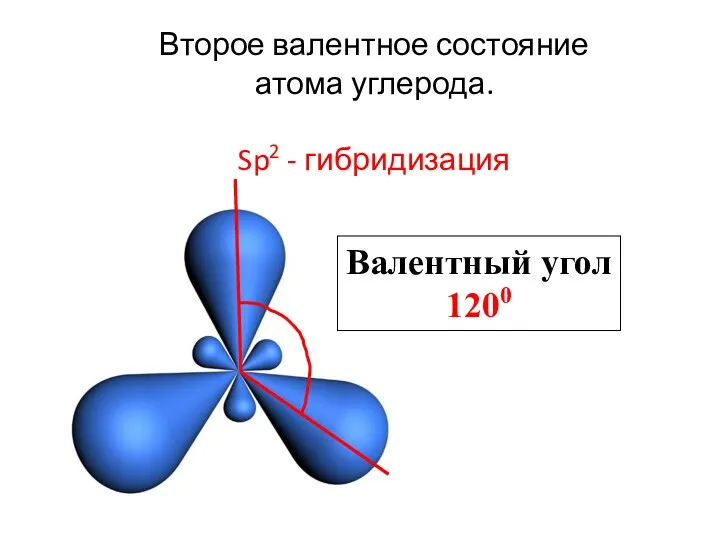
- 21. Второе валентное состояние атома углерода. Sp2 - гибридизация Валентный угол 1200
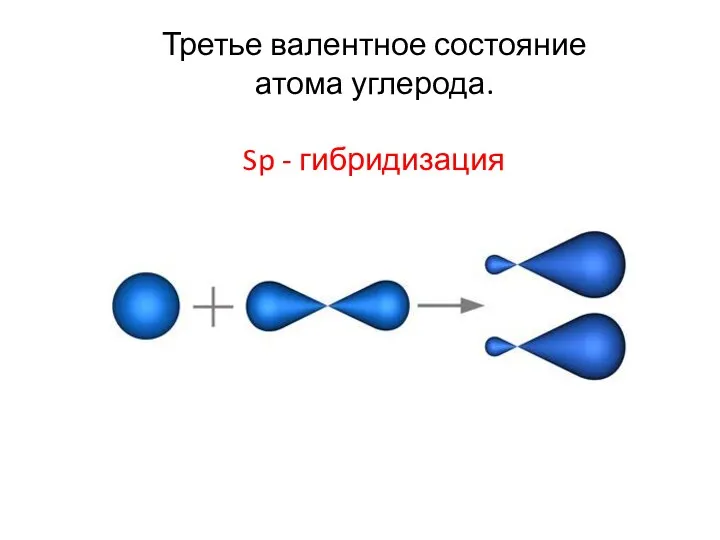
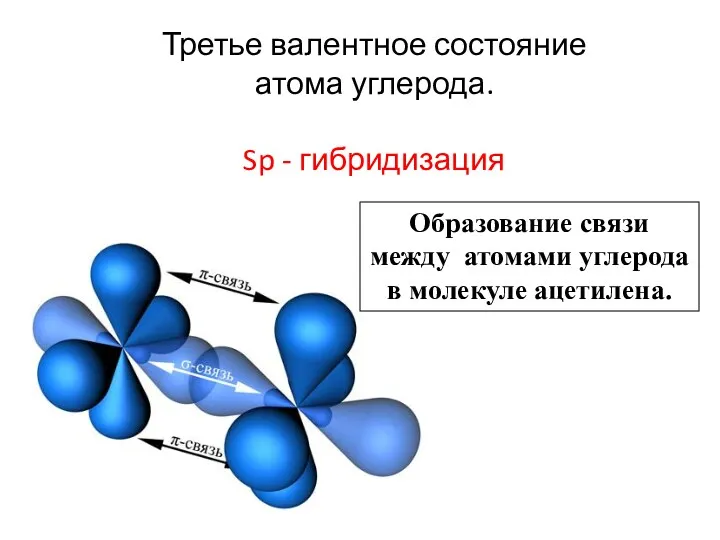
- 22. Третье валентное состояние атома углерода. Sp - гибридизация
- 23. Третье валентное состояние атома углерода. Sp - гибридизация Образование связи между атомами углерода в молекуле ацетилена.
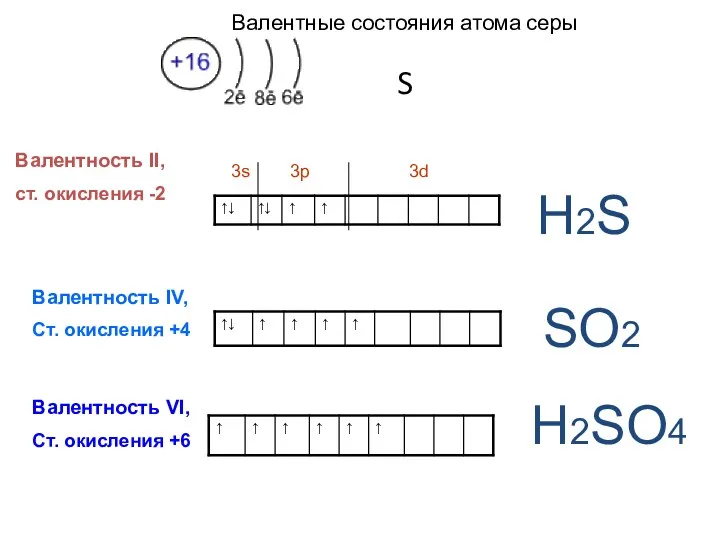
- 24. Валентные состояния атома серы S Валентность II, ст. окисления -2 3s 3p 3d Валентность IV, Ст.
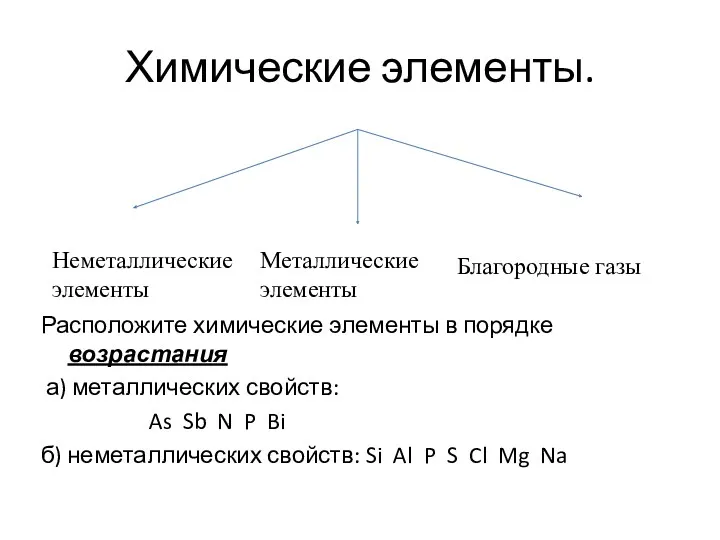
- 26. Химические элементы. Расположите химические элементы в порядке возрастания а) металлических свойств: As Sb N P Bi
- 27. Металлы – это … Химические элементы, атомы которых отдают электроны с внешнего ( а некоторые и
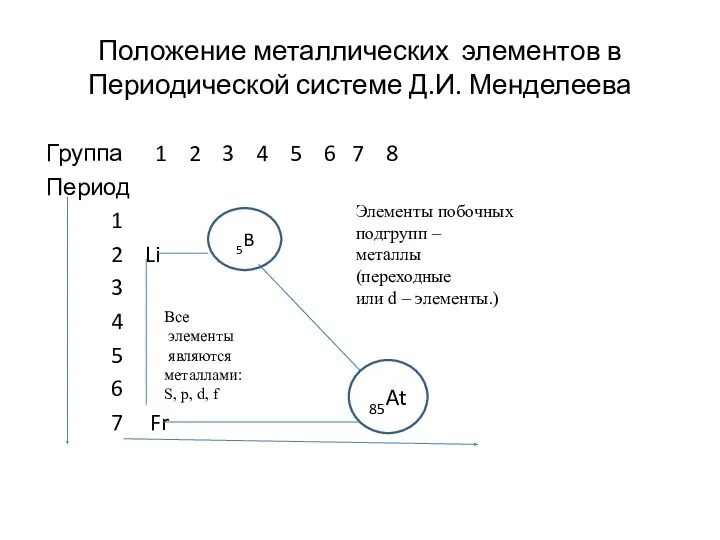
- 28. Положение металлических элементов в Периодической системе Д.И. Менделеева Группа 1 2 3 4 5 6 7
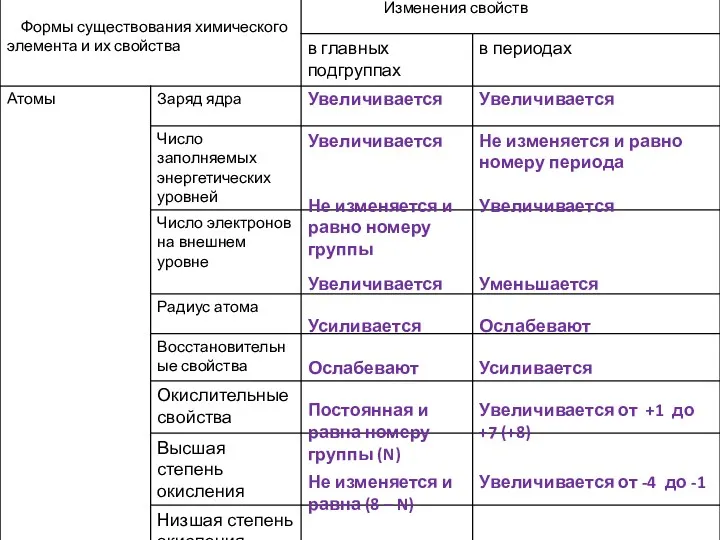
- 29. Изменение свойств металлических элементов В главной подгруппе: Число электронов на внешнем уровне _________________________________ Радиусы атомов________________________ Электроотрицательность
- 30. Изменение свойств металлических элементов В главной подгруппе: Число электронов на внешнем уровне Не изменяется Радиусы атомов
- 31. Неметаллы – это… Химические элементы, имеющие небольшой радиус атома и обладающие способностью принимать электроны, т.к. на
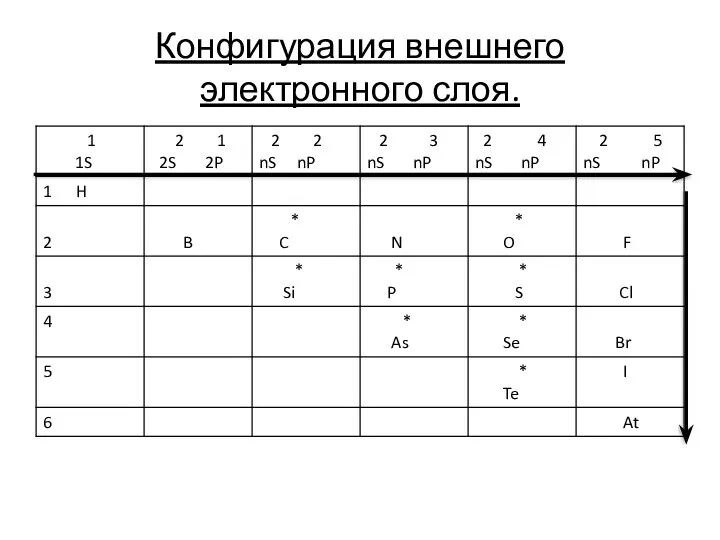
- 32. Конфигурация внешнего электронного слоя.
- 33. Неметаллические элементы и их свойства В периоде: Заряд ядра ________ Радиус атома _______ Число электронов на
- 34. Неметаллические элементы и их свойства В периоде: Заряд ядра увеличивается Радиус атома уменьшается Число электронов на
- 35. At B Te H As I Si P Se C S Br Cl N O F
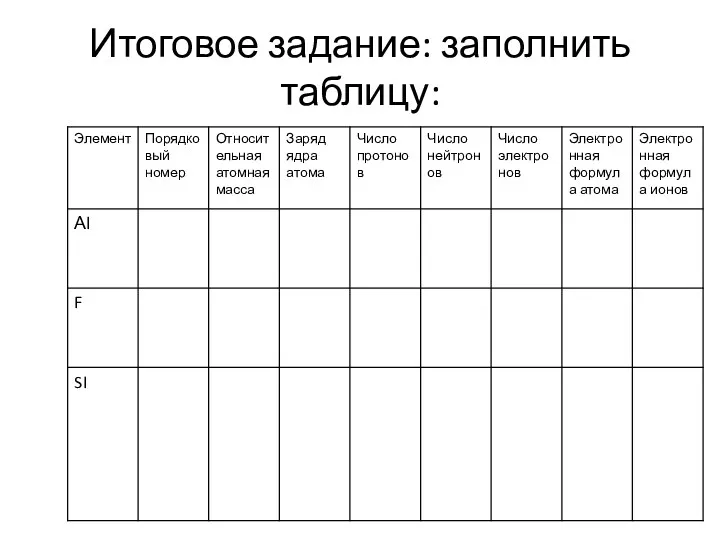
- 36. Итоговое задание: заполнить таблицу:
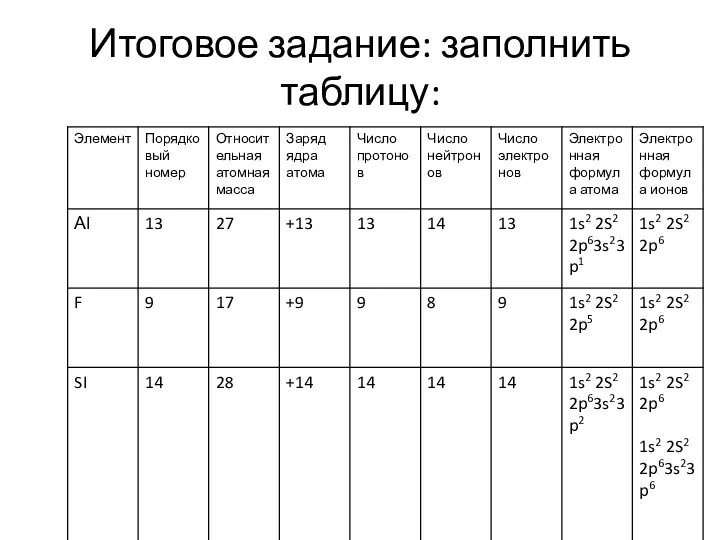
- 37. Итоговое задание: заполнить таблицу:
- 38. Домашнее задание 1. 8 и 9 класс – Составить презентацию по истории открытия химических элементов 10
- 40. Скачать презентацию





















 Роль М. В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М. В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Азотная кислота и ее соли. 9 класс
Азотная кислота и ее соли. 9 класс Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы
Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы Сложные эфиры
Сложные эфиры Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Химические свойства металлов
Химические свойства металлов Амінокислоти
Амінокислоти Кремний және оның қосылыстары
Кремний және оның қосылыстары Полимеры
Полимеры Хозяйственные товары из пластических масс
Хозяйственные товары из пластических масс Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Соли: получение, применение
Соли: получение, применение Циклические углеводороды
Циклические углеводороды Алюминий. Определите элемент
Алюминий. Определите элемент Удобрения и их классификация
Удобрения и их классификация Производство низших олефинов
Производство низших олефинов Углеводы. Моносахариды
Углеводы. Моносахариды Основные понятия химии. Законы стехиометрии
Основные понятия химии. Законы стехиометрии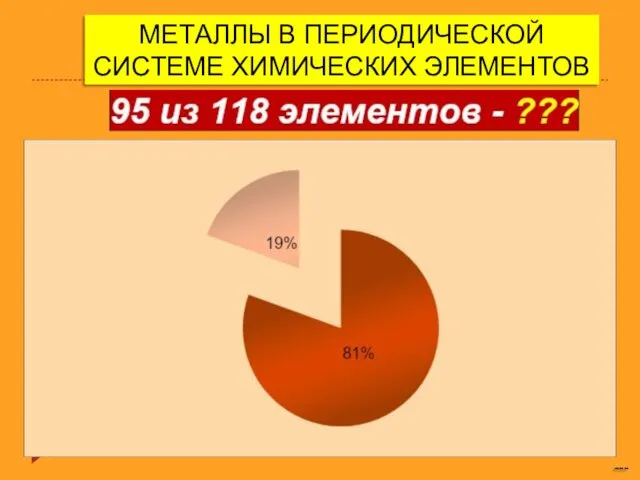 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Группы сходных химических элементов
Группы сходных химических элементов Химические свойства кислот
Химические свойства кислот Химия атмосферы
Химия атмосферы Жиры и масла
Жиры и масла Stirring in liquid media
Stirring in liquid media Химия көшбасшысы
Химия көшбасшысы Оксиды и их классификация
Оксиды и их классификация Материаловедение и технология обработки материалов
Материаловедение и технология обработки материалов