Содержание
- 2. Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2,
- 3. Способы получения оксидов. Взаимодействие простых веществ с кислородом: 2Mg + O2 = 2Mg O 2. Горение
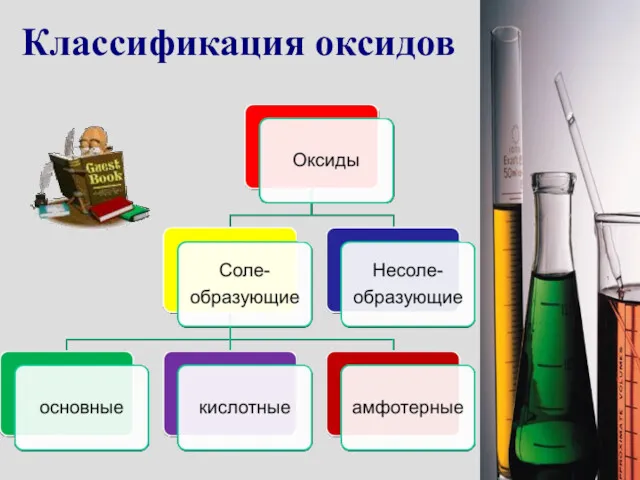
- 4. Классификация оксидов
- 5. Несолеобразующие оксиды Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют
- 6. Основные оксиды Это оксиды, которым в качестве гидроксидов соответствуют основания. Например: CuO → Cu(OH)2 Основные оксиды
- 7. Химические свойства основных оксидов. Взаимодействие с кислотами, с образованием соли и воды: MgO + HCl =
- 8. Кислотные оксиды Это оксиды, которым в качестве гидроксидов соответствуют кислоты. Например: SO3 → H2SO4 Кислотные оксиды
- 9. Химические свойства кислотных оксидов. С основаниями, образуя соль и воду: CO2 + 2KOH = K2CO3 +
- 10. АМФОТЕРНЫЕ ОКСИДЫ. Это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот. Например: BeO
- 11. Химические свойства амфотерных оксидов. В качестве основных оксидов. С кислотами, образуя соль и воду: ZnO +
- 13. Скачать презентацию









 Соединения водорода
Соединения водорода Химическая промышленность
Химическая промышленность Химические свойства неорганических соединений
Химические свойства неорганических соединений Алкины — углеводороды, содержащие тройную связь между атомами углерода
Алкины — углеводороды, содержащие тройную связь между атомами углерода Арены. Бензол
Арены. Бензол Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой Флотационные реагенты. Активаторы
Флотационные реагенты. Активаторы Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Получение, собирание и распознавание газов. Практическая работа
Получение, собирание и распознавание газов. Практическая работа Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Химическая посуда
Химическая посуда Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Производство серной кислоты
Производство серной кислоты Химические свойста воды
Химические свойста воды Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Гидросульфит натрия (пищевая добавка Е222)
Гидросульфит натрия (пищевая добавка Е222) Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды
Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды Бром. Общие сведения
Бром. Общие сведения Эко-упаковка
Эко-упаковка Проект Получение пресной и чистой воды
Проект Получение пресной и чистой воды Строение атома
Строение атома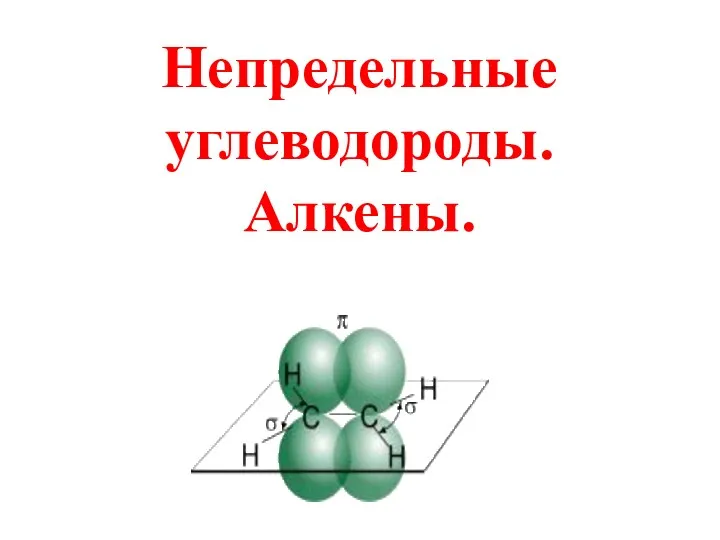 Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Изомерия. (11 класс)
Изомерия. (11 класс) Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Алмазы. Бриллианты
Алмазы. Бриллианты Использование горюче-смазочных материалов в автотранспорте
Использование горюче-смазочных материалов в автотранспорте Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия