Содержание
- 2. Состав атмосферы
- 3. Строение атмосферы * Тн — температура на нижней границе слоя. ** Тв — температура на верхней
- 4. Дисперсные системы в атмосфере Аэрозоли – это дисперсные системы, состоящие из твердых или жидких частиц, распределенных
- 5. радиус менее 0,1 мкм – ядра Айткена; радиус от 0,1 до 1 мкм – большие частицы;
- 6. Фоновое Океаническое Континентальное Распределение частиц в тропосфере
- 7. Атмосферная конвекция Внутри- и подоблачное вымывание Инерционный, диффузионный и центробежный механизм осаждения на препятствиях у земной
- 8. Реакции фотолиза Синтез солей Абсорбция водяными парами Гомогенная или гетерогенная конденсация Механизм образования аэрозолей По происхождению
- 9. Химические процессы в верхних слоях атмосферы Диссоциация О2 O0 + hν → O(1D) + O(3P) O(1D)
- 10. NO имеет наиболее низкую энергию ионизации, N2 – наиболее высокую. Образующиеся ионы участвуют в диссоциативной рекомбинации:
- 11. O2 + O +M → O3 + M• M – третье тело, присутствие которого необходимо для
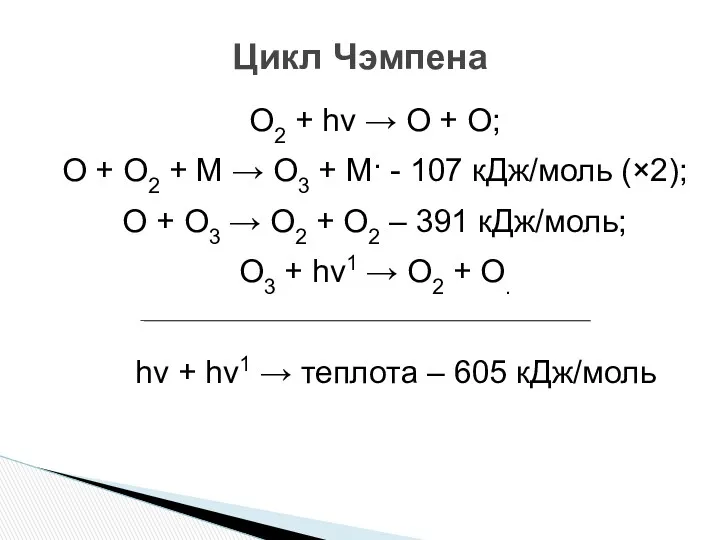
- 12. Цикл Чэмпена O2 + hν → O + O; O + O2 + M → O3
- 13. NO + O3 → NO2 + O2 NO2 + O → NO + O2 ••• O3
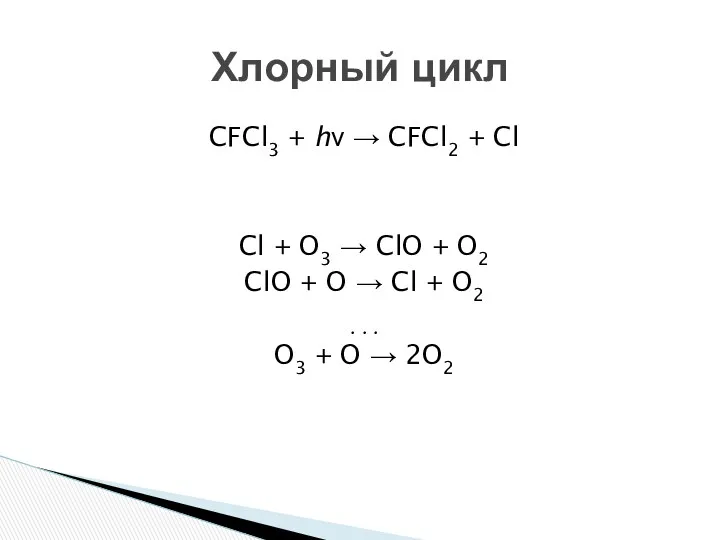
- 14. CFCl3 + hν → CFCl2 + Cl Cl + O3 → ClO + O2 ClO +
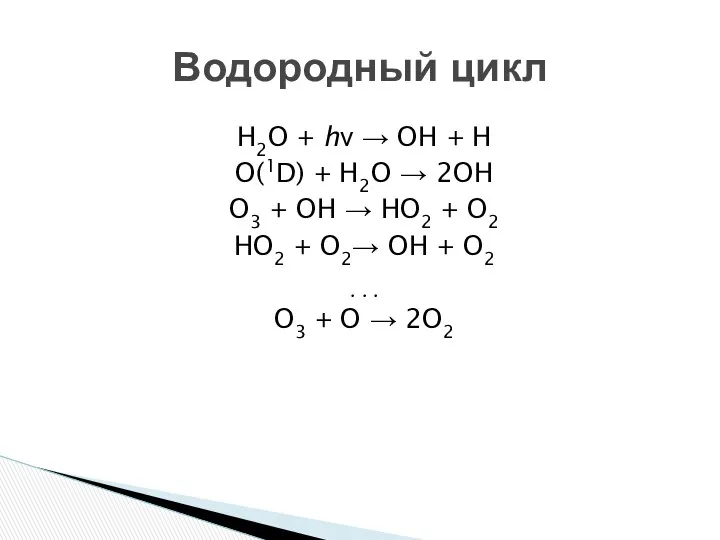
- 15. H2O + hν → OH + H O(1D) + H2O → 2OH O3 + OH →
- 17. Скачать презентацию











 Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Теория строения органических соединений
Теория строения органических соединений Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена 20230205_okislitelno-_vosstanovitelnye_reaktsii
20230205_okislitelno-_vosstanovitelnye_reaktsii Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Current Condition(Revision C)
Current Condition(Revision C) Состояние электронов в атоме
Состояние электронов в атоме Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Фосфор и его соединения
Фосфор и его соединения Прочность полимеров
Прочность полимеров Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Полімери. Їх властивості та застосування
Полімери. Їх властивості та застосування Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Щелочные металлы
Щелочные металлы Типы эмульсий. Фракционный состав нефти. Типы нефти
Типы эмульсий. Фракционный состав нефти. Типы нефти Счастливый случай. Право первого хода
Счастливый случай. Право первого хода Газообразные вещества
Газообразные вещества Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Алкины. Гомологический ряд
Алкины. Гомологический ряд Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Самое удивительное на свете вещество - вода
Самое удивительное на свете вещество - вода АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Физические свойства металлов
Физические свойства металлов