Содержание
- 2. Урок 10 класса Предельные углеводороды
- 3. Предельные углеводороды Углеводороды – соединения, молекулы которых содержат только атомы углерода и водорода. Поэтому любой углеводород
- 4. Предельные углеводороды Алканы – насыщенные, предельные, углеводородами, все свободные валентности атомов углерода заняты. Первый представитель –
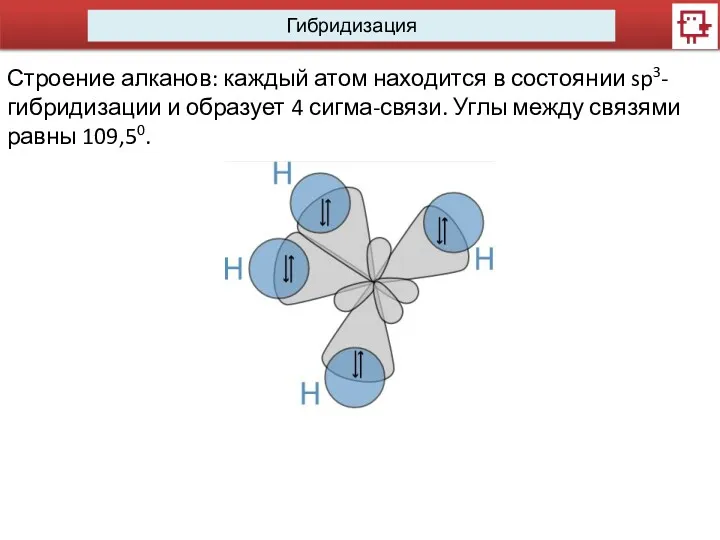
- 5. Предельные углеводороды Строение алканов: каждый атом находится в состоянии sp3-гибридизации…
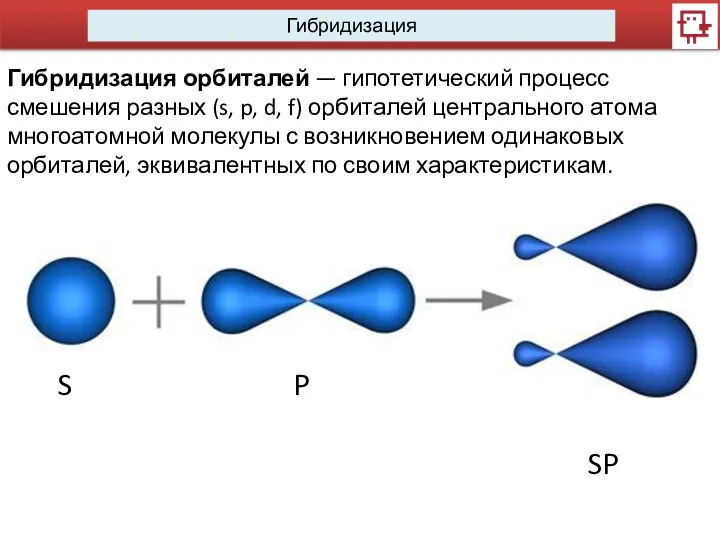
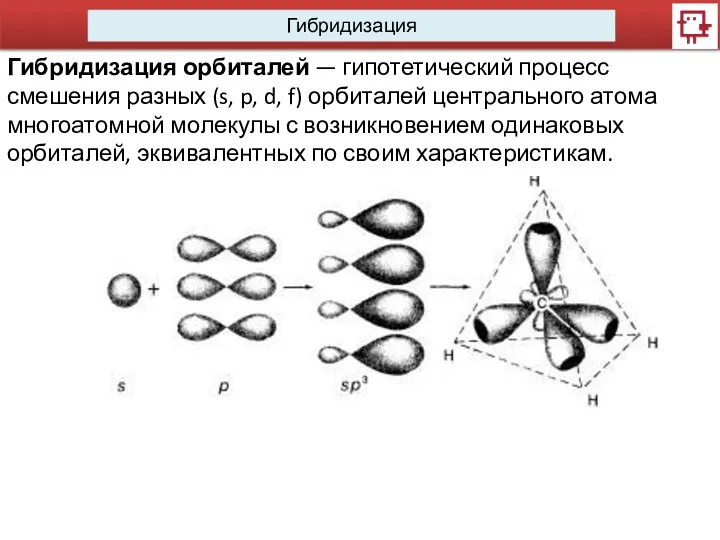
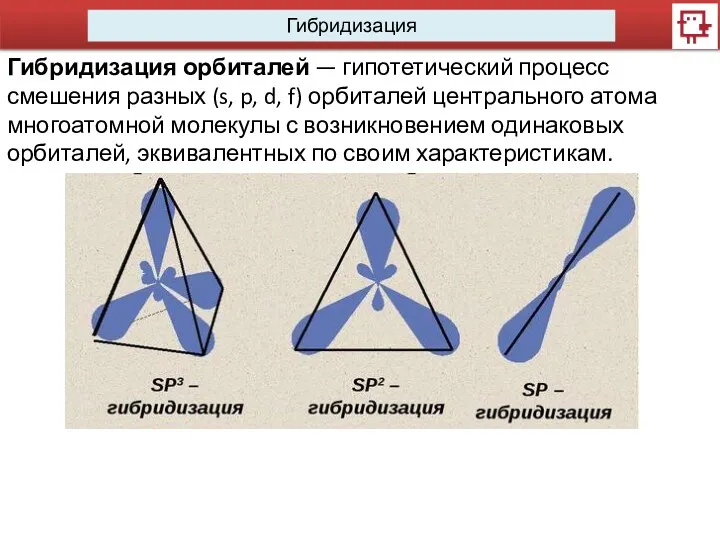
- 6. Гибридизация Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной
- 7. Гибридизация Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной
- 8. Гибридизация Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной
- 9. Гибридизация Строение алканов: каждый атом находится в состоянии sp3-гибридизации и образует 4 сигма-связи. Углы между связями
- 10. Изомерия Углеродный скелет может иметь самые разные геометрические формы при сохранении длин связей и углов между
- 11. Изомерия Основный вид изомерии для алканов – изомерия углеродного скелета. Одной молекулярной формуле может соответствовать несколько
- 12. Изомерия Основный вид изомерии для алканов – изомерия углеродного скелета. Одной молекулярной формуле может соответствовать несколько
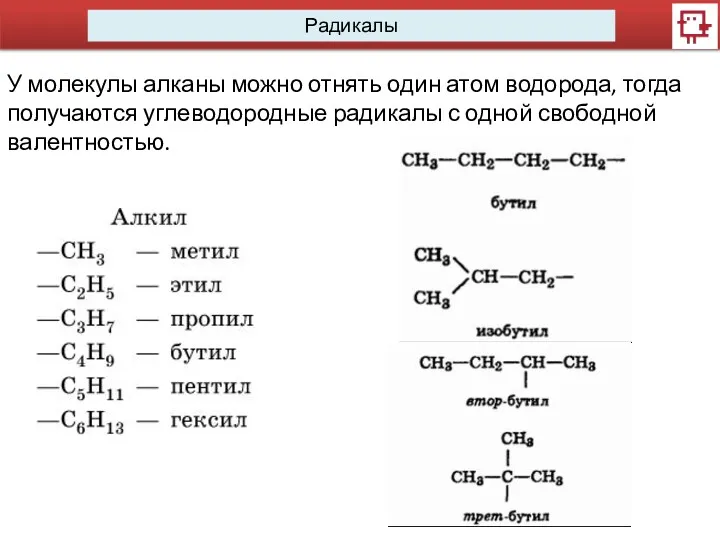
- 13. Радикалы У молекулы алканы можно отнять один атом водорода, тогда получаются углеводородные радикалы с одной свободной
- 14. Номенклатура В основу номенклатуры положен принцип замещения. Дело в том, что любую, даже самую сложную структуру
- 15. Номенклатура
- 16. Способы получения Природные источники алканов – нефть и природный газ. Различные фракции нефти содержат от С5H12
- 17. Химические свойства В обычных условиях алканы инертны. НЕ взаимодействуют с: серной кислотой (конц), азотной к-той (конц),
- 18. Химические свойства Нитрование (реакция Коновалова). Разбавленная азотная кислота, при 140С и с небольшим давлением. В реакциях
- 19. Химические свойства Изомеризация. Нормальные алканы при определенных условиях могут перегруппировываться в алканы с разветвлённой цепью. Крекинг
- 20. Химические свойства Окисление. При мягком окислении метана кислородом воздух в присутствии различных катализаторов могут быть получены
- 21. Природный газ Природный газ – смесь газов, состав зависит от месторождения. Иногда это почти чистый метан,
- 23. Скачать презентацию















 Растворы. Концентрация растворов
Растворы. Концентрация растворов Поливинилхлорид. Общие сведения
Поливинилхлорид. Общие сведения Самородные элементы
Самородные элементы Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Типы расчетных задач, способы их решения. Задания 39-40
Типы расчетных задач, способы их решения. Задания 39-40 Непредельные углеводороды
Непредельные углеводороды Переработка нефти
Переработка нефти Аминокислоты 2
Аминокислоты 2 Амины. Анилин
Амины. Анилин Внутренняя энергия и энтальпия. Классификация химических реакций по тепловому эффекту
Внутренняя энергия и энтальпия. Классификация химических реакций по тепловому эффекту Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Алюминий. Строение
Алюминий. Строение Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Теории химической кинетики Лекция 5
Теории химической кинетики Лекция 5 Глицерин. Свойства и применение
Глицерин. Свойства и применение Warm-Up
Warm-Up Щелочноземельные металлы
Щелочноземельные металлы Строение алкинов
Строение алкинов Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Метаболизм углеводов
Метаболизм углеводов Основания. Названия оснований
Основания. Названия оснований Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Химическая связь
Химическая связь Проблема содержания нитратов в пищевых продуктах
Проблема содержания нитратов в пищевых продуктах Пищевые добавки
Пищевые добавки Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения