Слайд 2

Цель обучения
1)Классифицировать химические реакции по тепловому эффекту;
2) Объяснять значимость теплового
эффекта химических реакций;
3) Рассчитывать тепловой эффект химической реакции;
4) Пояснять процессы разрыва и образования новых химических связей
5)Определять экспериментально изменение энтальпии реакции;
6)Производить расчеты на основе справочных данных.
Слайд 3

Вспомним еще раз, что же происходит с веществами, вступающими в реакцию?
Во всех случаях происходит разрушение химических связей в молекулах реагирующих веществ и образование новых связей в конечных продуктах реакции.
Процесс разрушения химических связей происходит с поглощением энергии, а образование новых связей (мы это уже знаем) — с выделением энергии. Эти энергии не могут быть равны, т. к. внутренняя энергия реагентов отличается от энергии конечных продуктов реакции.
Для химических реакций учитывается та энергия, которая связана с движением электронов в атоме, их притяжением к ядру — т. е. энергия химической связи. Поэтому любая химическая реакция сопровождается либо выделением энергии, либо поглощением энергии. Согласно закону сохранения энергии, энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую.
Слайд 4

Одни химические реакции протекают с выделением теплоты, а другие – с
поглощением.
Количество теплоты, которое выделяется в результате реакции, называется тепловым эффектом химической реакции.
По тепловому эффекту химические реакции делят на экзотермические и эндотермические.
Экзотермическими называются реакции, которые протекают с выделением теплоты. Например, реакция горения пропана.
Рис. 1. С3Н8 +О2→3СО2↑+4Н2О+Q
Эндотермическими называются реакции, которые протекают с поглощением теплоты. Например, реакция разложения гидроксида меди (II).
Сu(OH)2 СuО+Н2О - Q
Слайд 5

Химические уравнения, в которых указан тепловой эффект реакции, называются термохимическими. В них
указывается теплота процесса, соответствующая стехиометрическим коэффициентам.
Количество теплоты зависит от количества вещества. Ведь нельзя же обогреть помещение, сжигая одну спичку, а положив в камин несколько бревен – вполне. Хотя оба процесса – это горение древесины.
Слайд 6

Слайд 7

Слайд 8

Слайд 9

Слайд 10

Слайд 11











 Бензин. Производство бензина
Бензин. Производство бензина Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Азотсодержащие органические соединения
Азотсодержащие органические соединения Органическая химия. Лекция 13
Органическая химия. Лекция 13 Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Изотопный обмен
Изотопный обмен Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса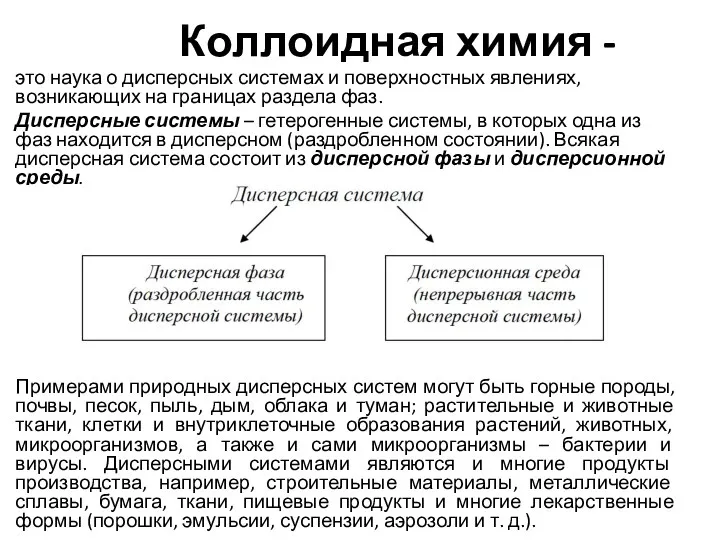 Коллоидная химия
Коллоидная химия Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины Nucleic acids
Nucleic acids Общая и медицинская химия
Общая и медицинская химия Создание косметических средств
Создание косметических средств Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат
Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат Алюминий и бор
Алюминий и бор Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа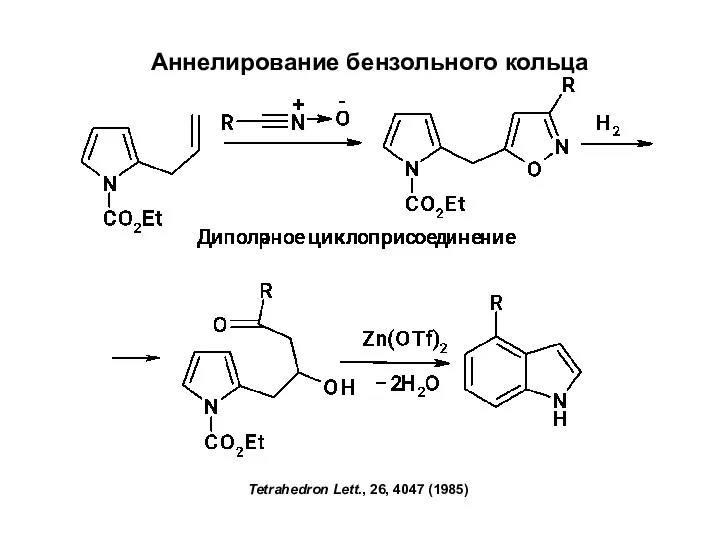 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение атома. Теории строения атома
Строение атома. Теории строения атома Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции Многоатомные спирты
Многоатомные спирты Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Азот и его свойства
Азот и его свойства Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Процесс электролиза
Процесс электролиза