Содержание
- 4. - знание законов химии, понимание химической сущности явлений и реакций, свойств веществ, характера их взаимодействия и
- 5. Задание 39 1. Инструкции по оцениванию
- 7. Углекислый газ объёмом 5,6 л (н.у.) пропустили через 164 мл 20%-ного раствора гидроксида натрия (ρ =
- 8. Элементы ответа: 1) рассчитаны количества веществ реагентов: 2) составлены уравнения возможных реакций между оксидом углерода (IV)
- 9. Элементы ответа: 1) рассчитаны количества веществ реагентов: 2) составлены уравнения возможных реакций между оксидом углерода (IV)
- 13. Медь, выделившаяся в результате взаимодействия 2,6 г цинка с 160 г 5% р-ра сульфата меди, полностью
- 14. Медь, выделившаяся в результате взаимодействия 2,6 г цинка с 160 г 5% р-ра сульфата меди, полностью
- 17. Если смесь хлоридов калия и кальция добавить к раствору карбоната натрия, то образуется 10 г осадка.
- 18. Элементы ответа: 1) записаны уравнения реакций: 2) рассчитано количество вещества реагентов: 3) вычислены массы веществ и
- 20. Элементы ответа: 1) записаны уравнения реакций: 2) рассчитано количество вещества реагентов: 3) вычислены массы веществ и
- 21. Смесь натрия и оксида натрия растворили в воде. При этом выделилось 4,48 л (н.у.) газа и
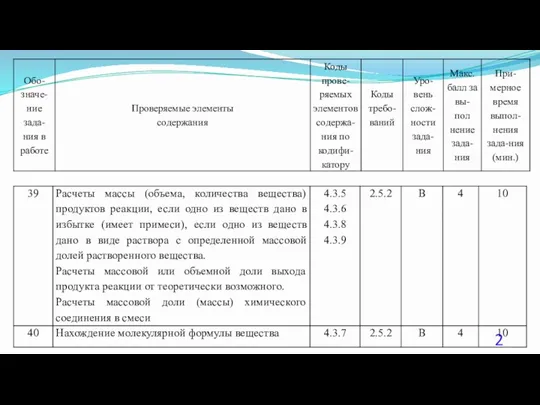
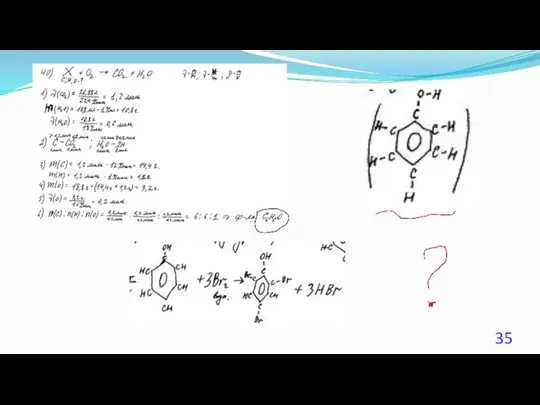
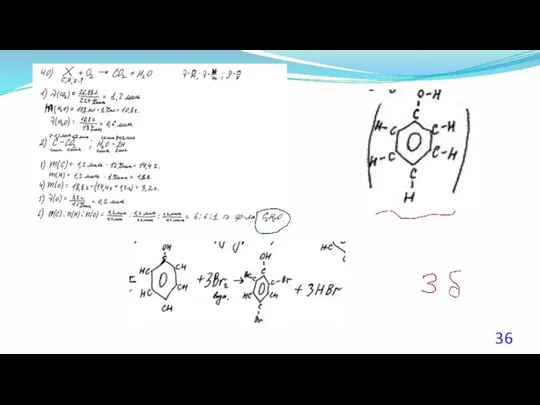
- 23. 40. (Демоверсия ЕГЭ 2016). При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г
- 24. Решение 1. Содержание верного ответа: (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа. 1)
- 25. Решение 2. Общая формула вещества CxHyOz n(CO2) = 35,2 /44 = 0,8 моль; n(С) = 0,8
- 26. Решение 3. Если при взаимодействии органического вещества с оксидом меди(II) образуется кетон, то это вещество –
- 27. Решение 4. n(CO2) = 35,2 /44 = 0,8 моль; n(H2O) = 18,0 / 18 = 1,0моль;
- 28. Решение 5. Если при взаимодействии органического вещества с оксидом меди(II) образуется кетон, то это вещество –
- 29. Задание 40 1. Инструкции по оцениванию
- 30. При сгорании 4,48 л (н.у.) газообразного органического вещества получили 35,2 г углекислого газа и 10,8 мл
- 41. Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе.
- 42. 1) Найдено соотношение атомов углерода, водорода и кислорода в соединении: w(H) = 100 – 40,0 –
- 44. Скачать презентацию






































 Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Хімія та їжа
Хімія та їжа Химическая связь
Химическая связь Литий
Литий Классификация органических соединений
Классификация органических соединений Гидролиз солей
Гидролиз солей Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Кремний и его соединения
Кремний и его соединения Гідроліз солей
Гідроліз солей Периодический закон Менделеева
Периодический закон Менделеева Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Минералы. Принципы классификации минералов
Минералы. Принципы классификации минералов Лекция 6. Электрофильное присоединение к кратным связям
Лекция 6. Электрофильное присоединение к кратным связям Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Фенолы
Фенолы Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Теория строения органических соединений А.М. Бутлерова
Теория строения органических соединений А.М. Бутлерова Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів
Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів Алюминий. Строение и свойство атомов
Алюминий. Строение и свойство атомов Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Алкадиены
Алкадиены Кремний и его соединения. Простое вещество - кристаллический кремний Si
Кремний и его соединения. Простое вещество - кристаллический кремний Si Аналитическая химия. Предмет и задачи
Аналитическая химия. Предмет и задачи Вода. Практическая работа
Вода. Практическая работа Спирти
Спирти Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление