Слайд 2
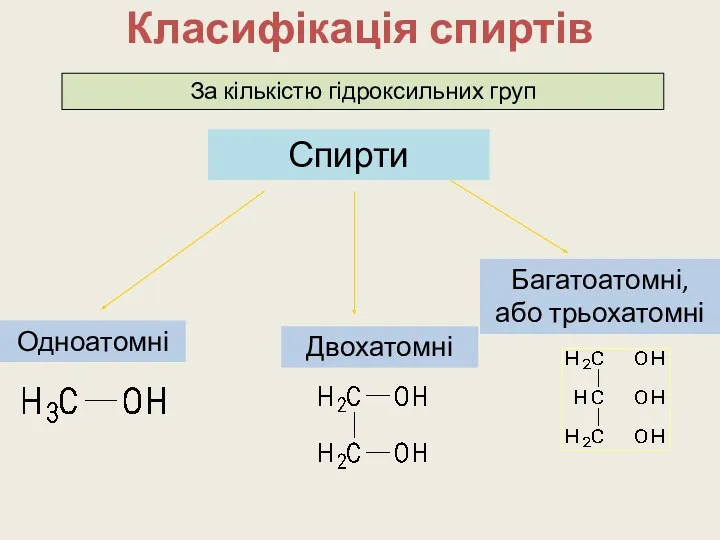
Класифікація спиртів
Одноатомні
Двохатомні
Багатоатомні, або трьохатомні
Спирти
За кількістю гідроксильних груп
Слайд 3

Слайд 4

НАЗВА СПИРТІВ
НАЗВА АЛКАНУ І СУФІКС ОЛ
МЕТАН + ОЛ = МЕТАНОЛ
ЕТАН +
ОЛ = ЕТАНОЛ
Слайд 5

Слайд 6

ІЗОМЕРІЯ СПИРТІВ
Ізомерія карбонового ланцюга
Ізомерія функціональної групи.
СН3 –СН2 – СН2 – СН2-
ОН
Слайд 7

Номенклатура (IUPAC)
Визначають найдовший вуглецевий ланцюг.
Знаходять з якого боку найближче знаходиться група
-ОН.
Нумерують ланцюг з того боку де ближче розміщена -ОН група. Якщо -ОН група рівновіддалена від кінців ланцюга, тоді з того боку де ближче розміщено радикал..
Називають вуглеводневі радикали. Перед назвою кожного радикалу ставлять цифру яка вказує біля якого атома вуглецю знаходиться радикал, цифру та назву радикалу відділяють дефісом.
Якщо вуглеводень має декілька однакових радикалів то записують в порядку зростання всі номери атомів (в порядку зростання, через кому) вуглецю до яких приєднані ці радикали. Перед назвою радикалу додають суфікс (ди-, три-, тетра, пента і т.д.), що вказує скільки цих радикалів містить вуглеводень. Якщо два однакових радикали знаходяться біля одного атома вуглецю то номер ставиться двічі.
Називають вуглеводень основного вуглецевого ланцюгу. Ставлять тире, вказують число біля якого атому вуглецю знаходиться -ОН група.
Якщо радикал розгалужений то радикал нумерують від місця приєднання (цифрами зі штрихами) і називають за тими правилами, що і алкан. Суфікс змінюють на -іл (ил), а назву радикала беруть у дужки.
Слайд 8

Номенклатура спиртів
1
3-етил -4,5-диметилгексан-1 -ол
2
3
4
5
6
Слайд 9

Номенклатура спиртів
1
2
3
4
5
6
7
4етил- 5,6-диметил гептан-2,3-діол
Слайд 10

Слайд 11
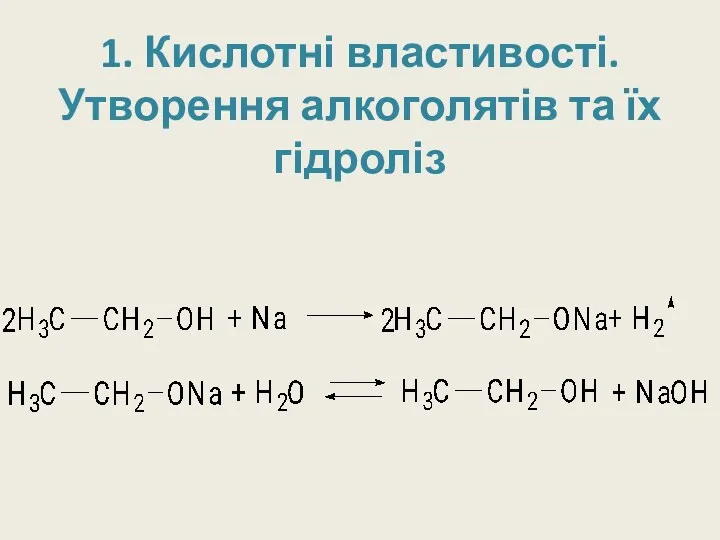
1. Кислотні властивості.
Утворення алкоголятів та їх гідроліз
Слайд 12

2. Основні властивості
Заміщення гідроксильної групи
Слайд 13
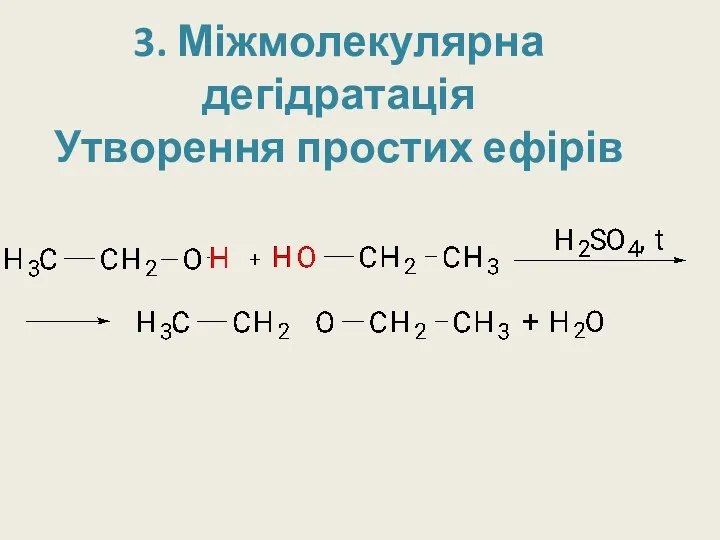
3. Міжмолекулярна дегідратація
Утворення простих ефірів
Слайд 14
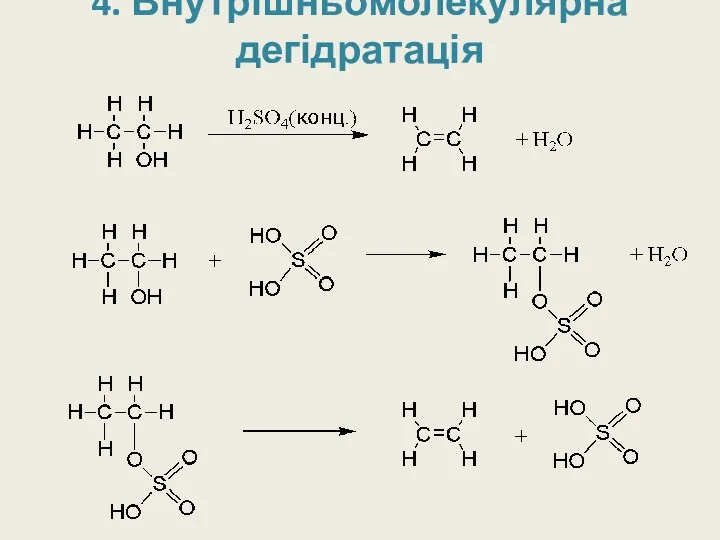
4. Внутрішньомолекулярна дегідратація
Слайд 15
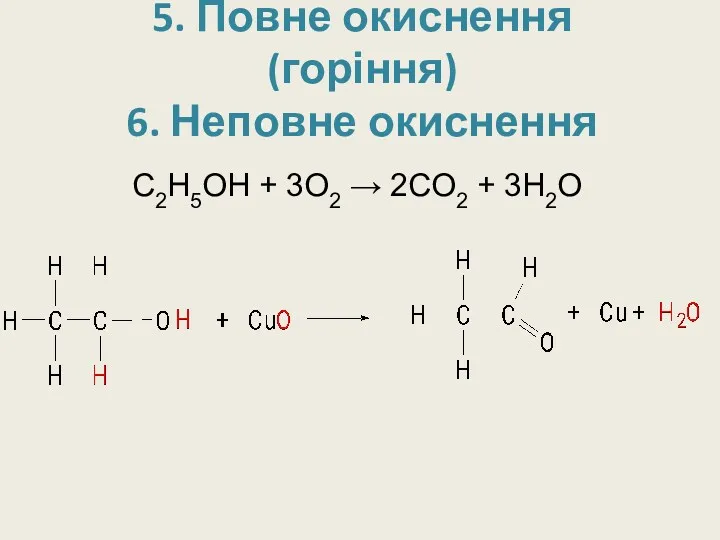
5. Повне окиснення (горіння)
6. Неповне окиснення
С2H5OH + 3O2 → 2CO2 +
3H2O
Слайд 16

Хімічні властивості
Взаємодія багатоатомних спиртів з Cu(OH)2
Слайд 17
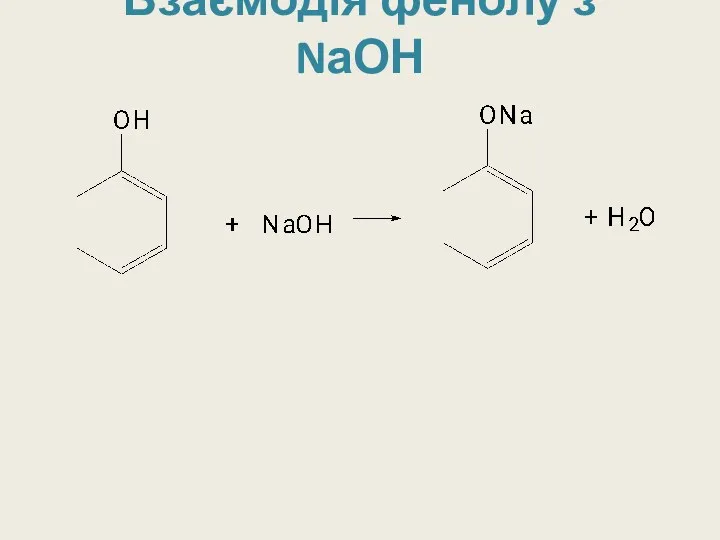
Слайд 18

Якісна реакція на фенол
3C6H5OH + FeCl3 → (C6H5O)3Fe +3HCl
Слайд 19

CO + 2H2 CH3OH
Отримання спиртів
C6H12O6 → 2C2H5OH + 2CO2↑
250-230°C, 5-30МПа
ZnO + ZnCr2O4
CO2 + 3H2 CH3OH +H2O
t, кат.


















 Основные понятия. Химический язык
Основные понятия. Химический язык Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2) Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Оксиди нітрогену
Оксиди нітрогену Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Диазины. Общая характеристика диазинов
Диазины. Общая характеристика диазинов Алкадиены
Алкадиены Энергетическое топливо и его классификация
Энергетическое топливо и его классификация Білки (протеїни)
Білки (протеїни) Строение и свойства материалов
Строение и свойства материалов Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Озон. Строние молекулы озона
Озон. Строние молекулы озона Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Растворимость малорастворимого сильного электролита
Растворимость малорастворимого сильного электролита яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля