Содержание
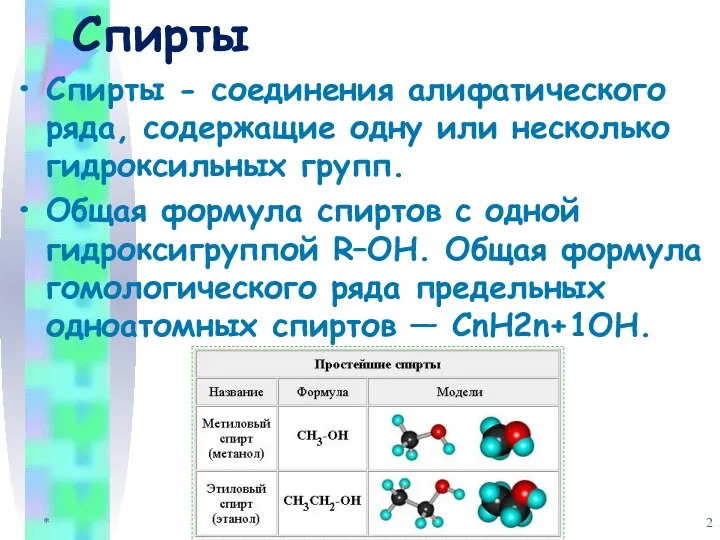
- 2. Спирты Спирты - соединения алифатического ряда, содержащие одну или несколько гидроксильных групп. Общая формула спиртов с
- 3. Номенклатура спиртов Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение
- 4. Номенклатура спиртов Нумерация ведется от ближайшего к ОН-группе конца цепи: *
- 5. Номенклатура спиртов В многоатомных спиртах положение и число ОН-групп указывают суффиксами диол, триол и цифрами: *
- 6. Классификация спиртов 1.По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН), многоатомные (две и
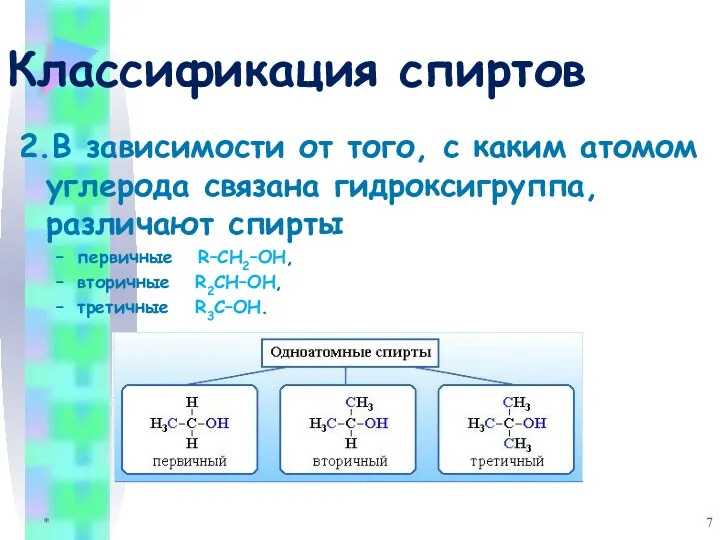
- 7. Классификация спиртов 2.В зависимости от того, с каким атомом углерода связана гидроксигруппа, различают спирты первичные R–CH2–OH,
- 8. Классификация спиртов 3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на: предельные, или алканолы
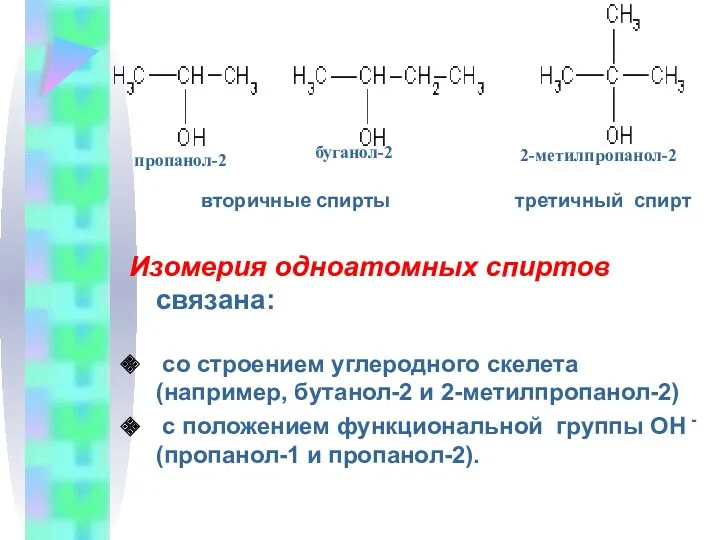
- 9. вторичные спирты третичный спирт Изомерия одноатомных спиртов связана: со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2)
- 10. Физические свойства Низшие спирты (до C15) — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются
- 11. 1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами: 2С2Н5-ОН +
- 12. 2. При действии на спирты органических кислот и минеральных кислот образуются сложные эфиры (реакция этерификации). Образование
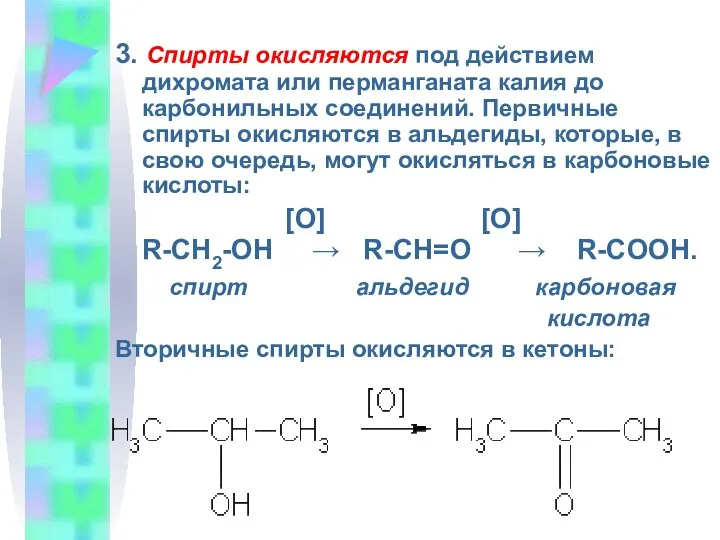
- 13. 3. Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в
- 14. Горение спиртов: С2Н5ОН+ 3О2 2СО2 + 3Н2О Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами.
- 15. При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров: H2SO4,t C2H5-O-C2H5 + H2O. медленно.
- 16. Получение 1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при
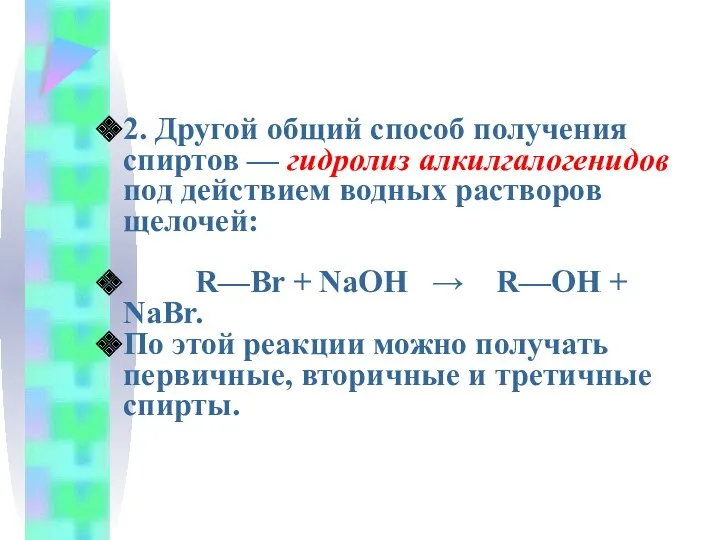
- 17. 2. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей: R—Br +
- 18. 4. Этанол получают при спиртовом брожении глюкозы: С6Н12О6 → 2С2Н5ОН + 2СО2↑.
- 19. Применение спиртов Спирты главным образом используют в промышленности органического синтеза. Метанол – сильный яд, при приеме
- 20. Простые эфиры Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода:
- 22. Скачать презентацию














 Концентрация кобальта
Концентрация кобальта 20230205_metally_pobochnyh_podgrupp
20230205_metally_pobochnyh_podgrupp Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Карбонаты. Классификация
Карбонаты. Классификация Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки Основы химической термодинамики
Основы химической термодинамики Prezentatciya
Prezentatciya №9 зертханалық жұмыс
№9 зертханалық жұмыс Роль хімії у суспільстві
Роль хімії у суспільстві Облучение. Радиационная окраска
Облучение. Радиационная окраска Растворимость малорастворимого сильного электролита
Растворимость малорастворимого сильного электролита Растворы. Приготовление растворов
Растворы. Приготовление растворов Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Радиусы атомов и ионов
Радиусы атомов и ионов История развития химии
История развития химии Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Понятие Химический элемент
Понятие Химический элемент Теплота горения
Теплота горения Жиры и масла в косметическом производстве
Жиры и масла в косметическом производстве Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Функциональные производные с простой связью C-“Э”. Часть 2. Галогенпроизводные
Функциональные производные с простой связью C-“Э”. Часть 2. Галогенпроизводные Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах 20230306_oksidy
20230306_oksidy Аминокислоты 2
Аминокислоты 2 Углеводороды. Алканы
Углеводороды. Алканы Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Water vapor. Nitrous oxide. Aerosols
Water vapor. Nitrous oxide. Aerosols