Содержание
- 2. При p,T=const При равновесии dG=0 При P,T=const изменение энергии Гиббса в системе равно суммарному изменению химических
- 3. Для 1 моля G= 0- стандартный химический потенциал, это химический потенциал системы когда р=1атм. 0- стандартный
- 4. Константы химического равновесия - константа равновесия
- 5. - мольная доля участников реакции Константа равновесия – это дробь, в числитель которой входят парциальные давления
- 6. При повышении давления состав равновесной смеси меняется, но константа равновесия (К0) остаётся той же величиной.
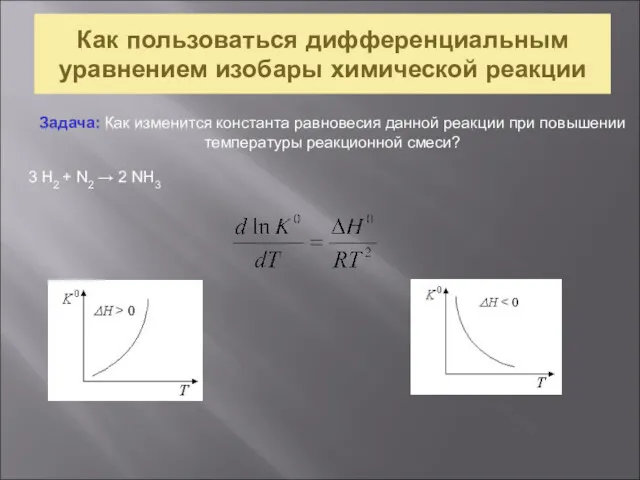
- 7. Влияние внешних условий на состояние равновесия. Принцип Гиббса-Ле Шателье Влияние температуры Для экзотермической реакции Для эндотермической
- 8. Влияние давление p не влияет Особенности равновесия в гетерогенных системах Влияние концентрации участников реакции
- 9. Уравнение изотермы химической реакции Вант-Гоффа Значение уравнения: Можно оценить направление протекания реакции и состояние равновесия, если
- 10. Анализ уравнения Вант-Гоффа(11) 1) Δlnṕ>lnKp; ΔG>0 т.е. реакция не идёт слева направо (так как записана), но
- 11. Подставив в уравнение (14) -рассчитывается по уравнению Кирхгоффа и закону Гесса (с помощью стандартных энтальпий образования)
- 12. По величине можно судить об устойчивости и реакционной способности данного соединения: Если ,это означает, что Крав
- 13. Зависимость константы равновесия от Т Уравнение изобары и изохоры Вант-Гоффа Уравнение изотермы Вант-Гоффа Уравнение Гиббса-Гельмгольца Уравнение
- 14. Как пользоваться дифференциальным уравнением изобары химической реакции Задача: Как изменится константа равновесия данной реакции при повышении
- 15. Как пользоваться интегральным уравнением изобары химической реакции Задача Известны константы равновесия при 2-х температурах: К01 при
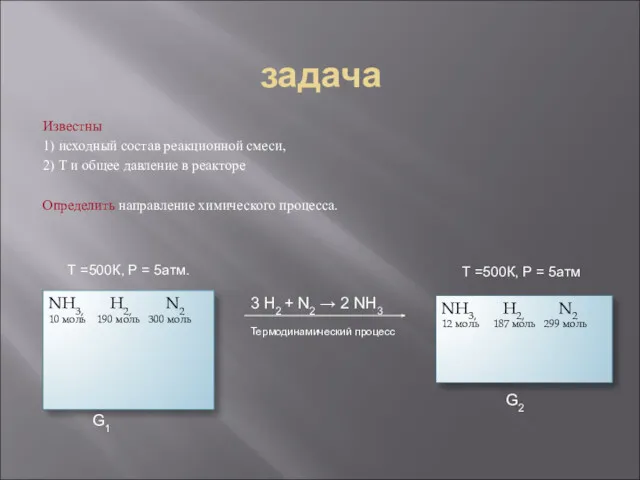
- 16. задача Известны 1) исходный состав реакционной смеси, 2) Т и общее давление в реакторе Определить направление
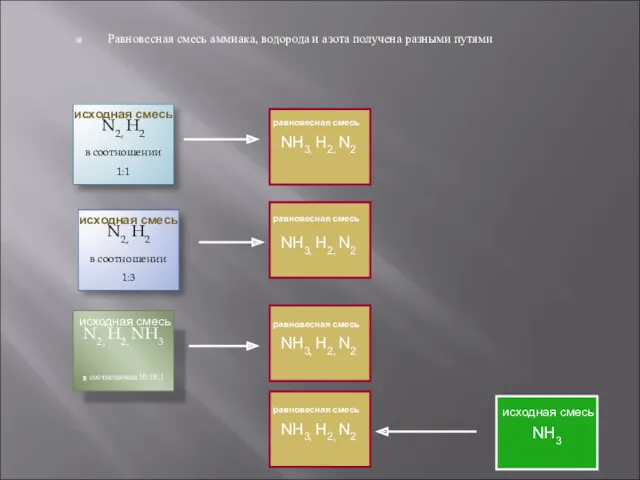
- 17. равновесная смесь N2, H2 в соотношении 1:1 исходная смесь Равновесная смесь аммиака, водорода и азота получена
- 19. Скачать презентацию













 Сероводород. Сульфиды
Сероводород. Сульфиды Буферные растворы
Буферные растворы Техника безопасности и правила работы в лаборатории. 10 класс
Техника безопасности и правила работы в лаборатории. 10 класс Стекло. Виды стекол
Стекло. Виды стекол Щелочные металлы
Щелочные металлы Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Классификация химических реакций
Классификация химических реакций Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов
Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Генетическая связь
Генетическая связь Гидрирование альдегидов и кетонов
Гидрирование альдегидов и кетонов Анилин. Строение. Физические и химические свойства
Анилин. Строение. Физические и химические свойства История микроскопа
История микроскопа Квест с Гарри Поттером
Квест с Гарри Поттером Дисперсные системы в медицине и пищевой промышленности
Дисперсные системы в медицине и пищевой промышленности Классификация и номенклатура неорганических веществ
Классификация и номенклатура неорганических веществ Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері Решение упражнений по теме: Углеводы
Решение упражнений по теме: Углеводы Природный газ
Природный газ Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7
Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7 Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат
Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Механизмы органических реакций
Механизмы органических реакций Водородные соединения неметаллов
Водородные соединения неметаллов