Содержание
- 2. ОКИСЛЕНИЕ
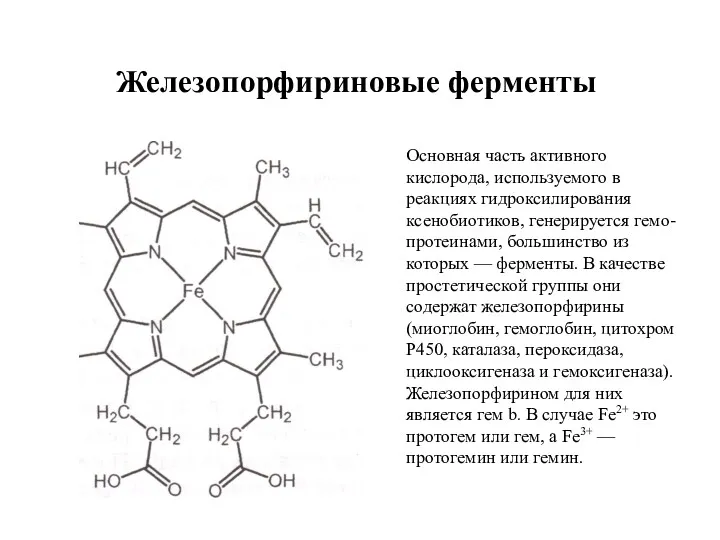
- 3. Железопорфириновые ферменты Основная часть активного кислорода, используемого в реакциях гидроксилирования ксенобиотиков, генерируется гемо-протеинами, большинство из которых
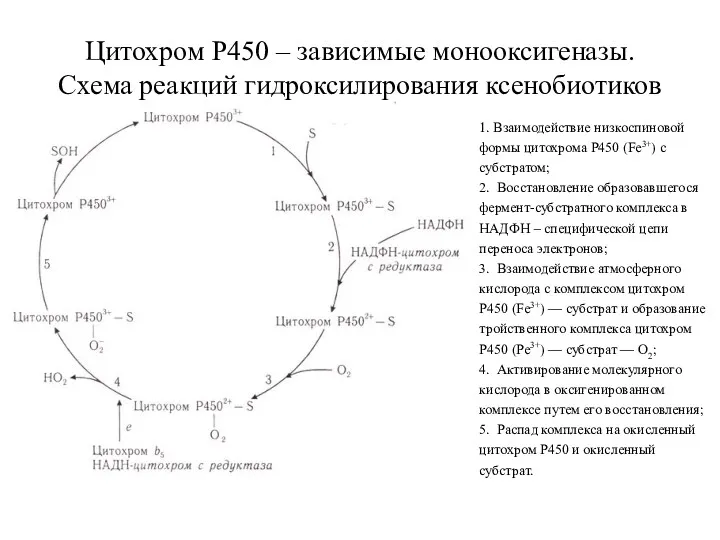
- 4. Цитохром Р450 – зависимые монооксигеназы. Схема реакций гидроксилирования ксенобиотиков 1. Взаимодействие низкоспиновой формы цитохрома Р450 (Fе3+)
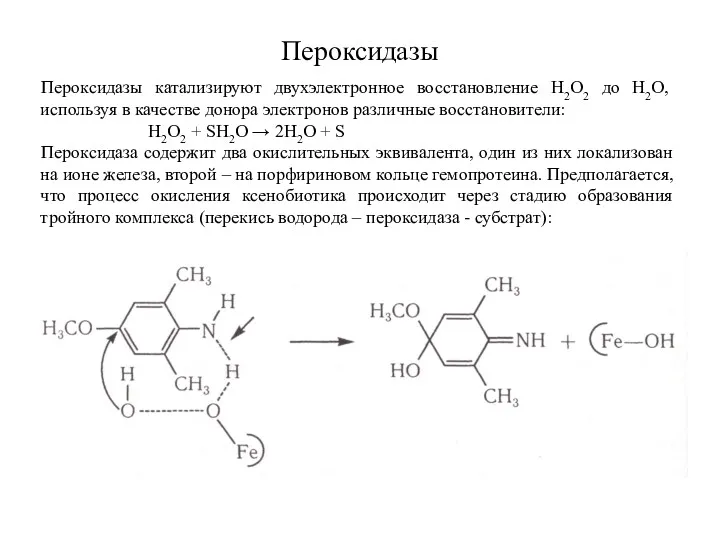
- 5. Пероксидазы Пероксидазы катализируют двухэлектронное восстановление Н2О2 до Н2О, используя в качестве донора электронов различные восстановители: Н2О2
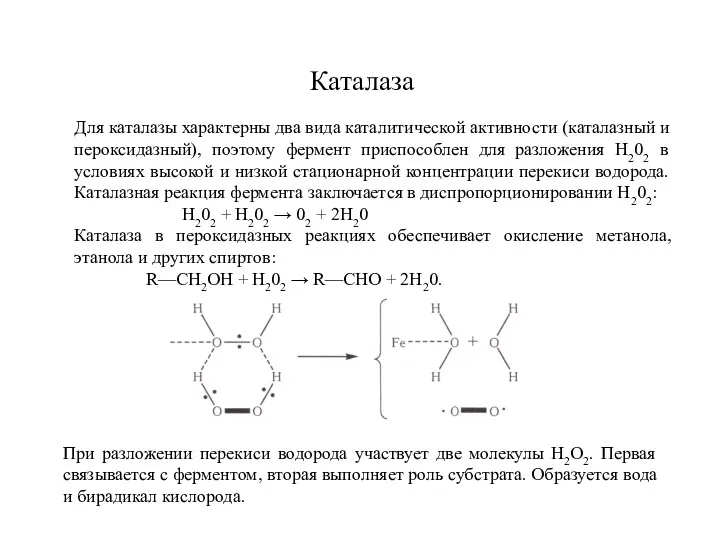
- 6. Каталаза Для каталазы характерны два вида каталитической активности (каталазный и пероксидазный), поэтому фермент приспособлен для разложения
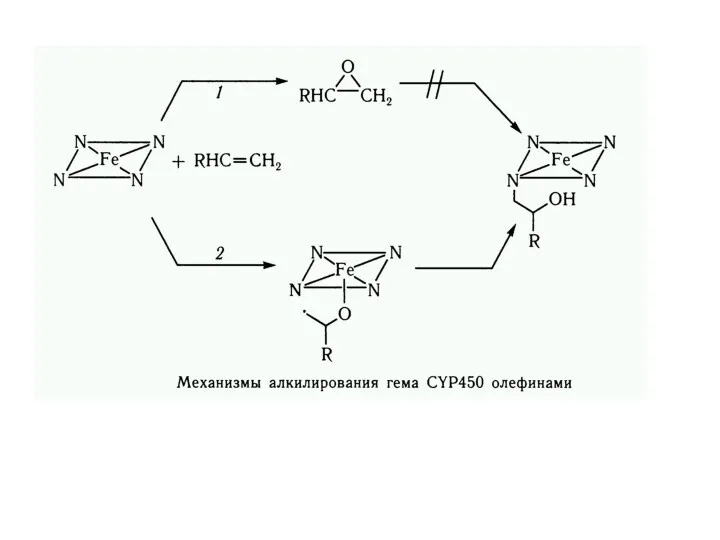
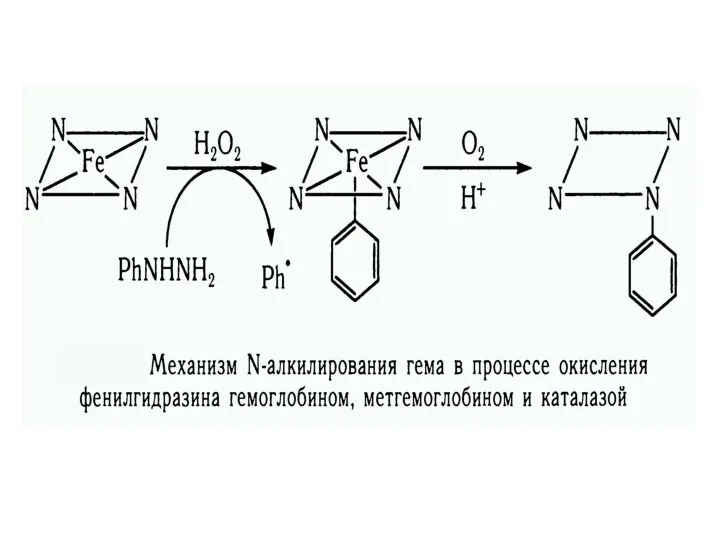
- 7. Ферментные свойства миоглобина и гемоглобина Ферментативные процессы: Автоокисление; Пероксидазные реакции; Монооксигеназные реакции; Реакции соокисления. Неферментативные процессы:
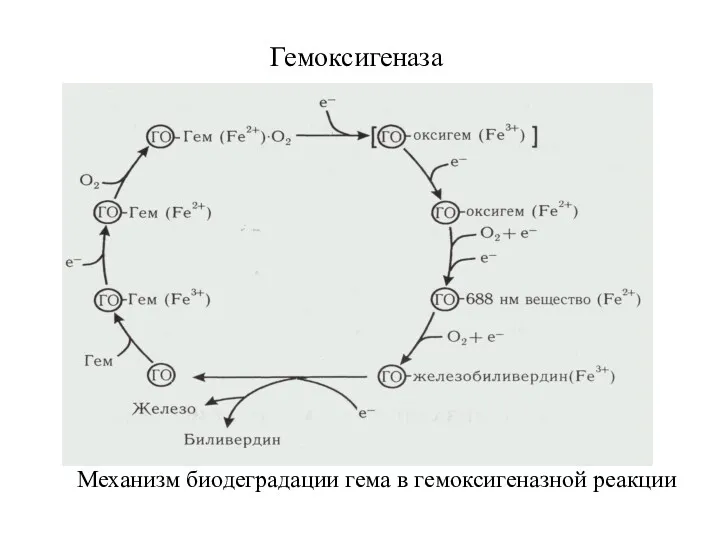
- 8. Гемоксигеназа Механизм биодеградации гема в гемоксигеназной реакции
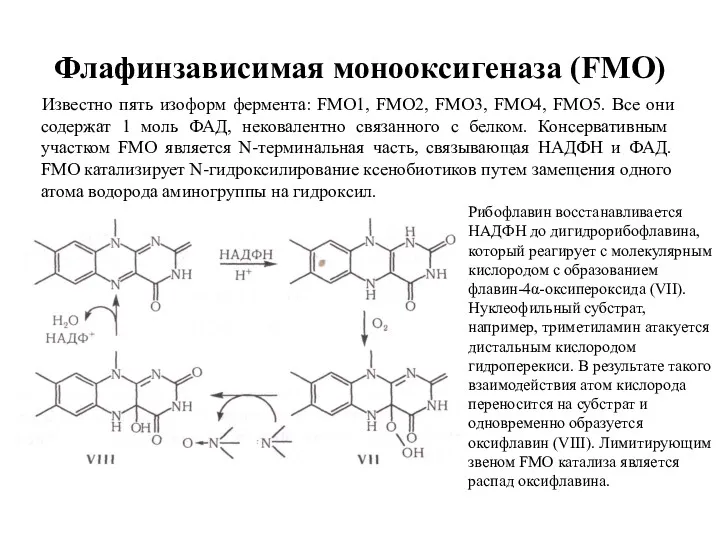
- 9. Флафинзависимая монооксигеназа (FMO) Известно пять изоформ фермента: FMO1, FMO2, FMO3, FMO4, FMO5. Все они содержат 1
- 10. Молибденсодержащие ферменты Чаще всего имеются в виду ксантиноксидаза, ксантиндегидрогеназа и альдегидоксидаза. Все ферменты представляют собой димеры
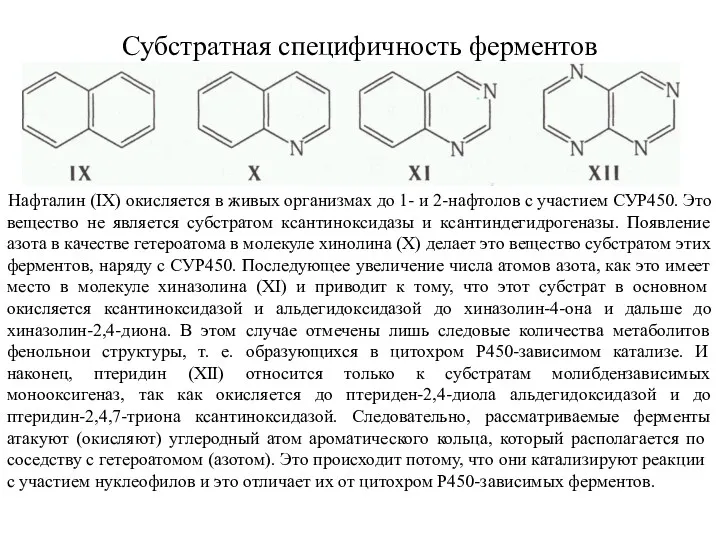
- 11. Субстратная специфичность ферментов Нафталин (IX) окисляется в живых организмах до 1- и 2-нафтолов с участием СУР450.
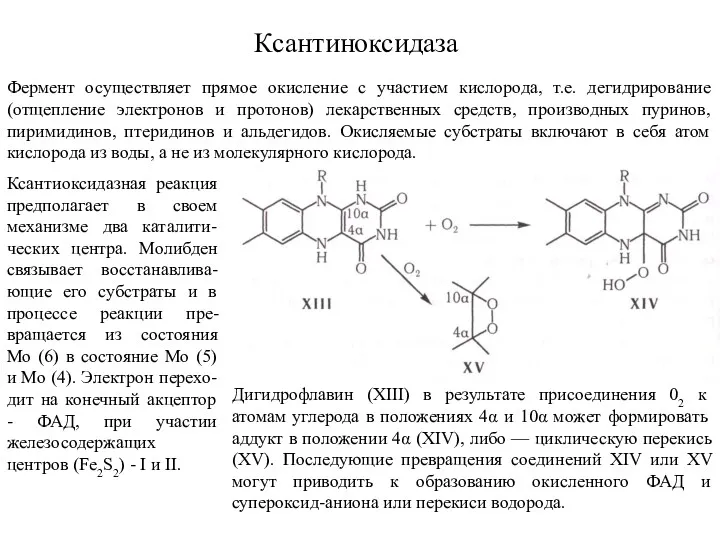
- 12. Ксантиноксидаза Ксантиоксидазная реакция предполагает в своем механизме два каталити-ческих центра. Молибден связывает восстанавлива-ющие его субстраты и
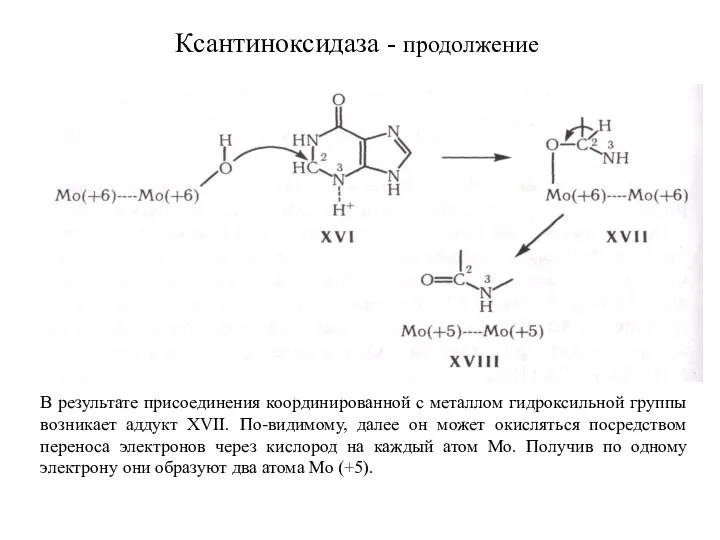
- 13. В результате присоединения координированной с металлом гидроксильной группы возникает аддукт XVII. По-видимому, далее он может окисляться
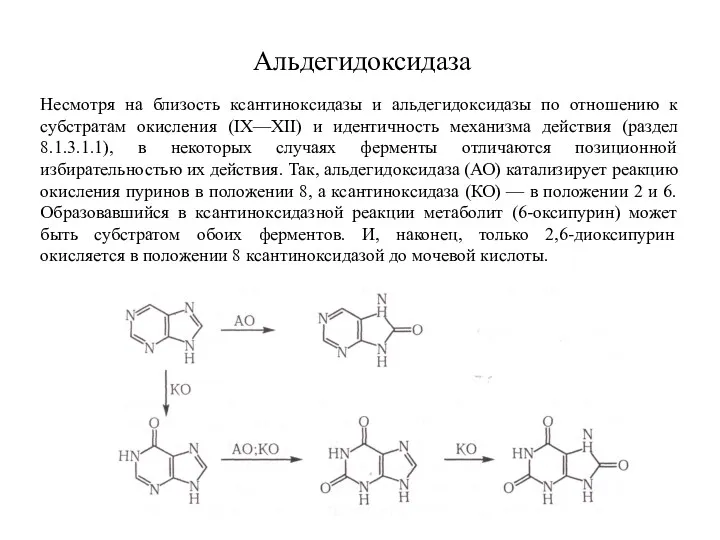
- 14. Альдегидоксидаза Несмотря на близость ксантиноксидазы и альдегидоксидазы по отношению к субстратам окисления (IX—XII) и идентичность механизма
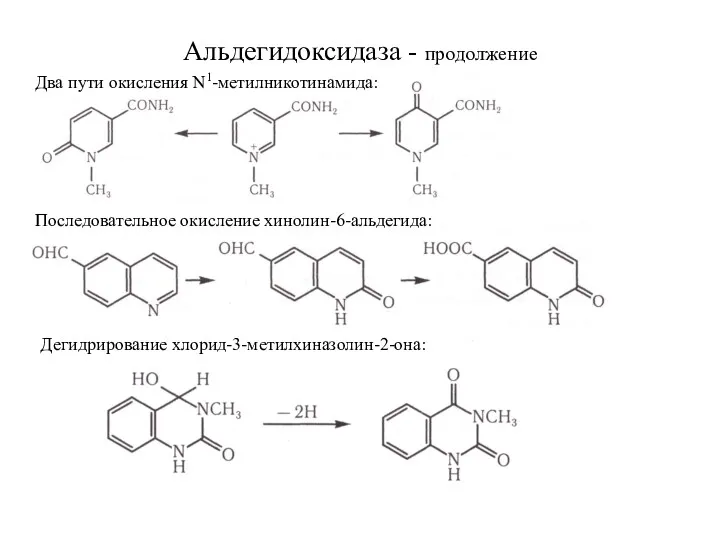
- 15. Альдегидоксидаза - продолжение Два пути окисления N1-метилникотинамида: Последовательное окисление хинолин-6-альдегида: Дегидрирование хлорид-3-метилхиназолин-2-она:
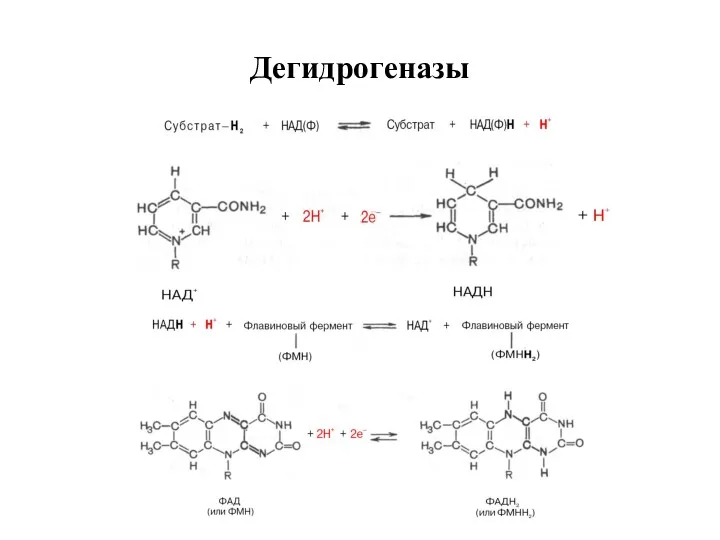
- 16. Дегидрогеназы
- 17. ВОССТАНОВЛЕНИЕ
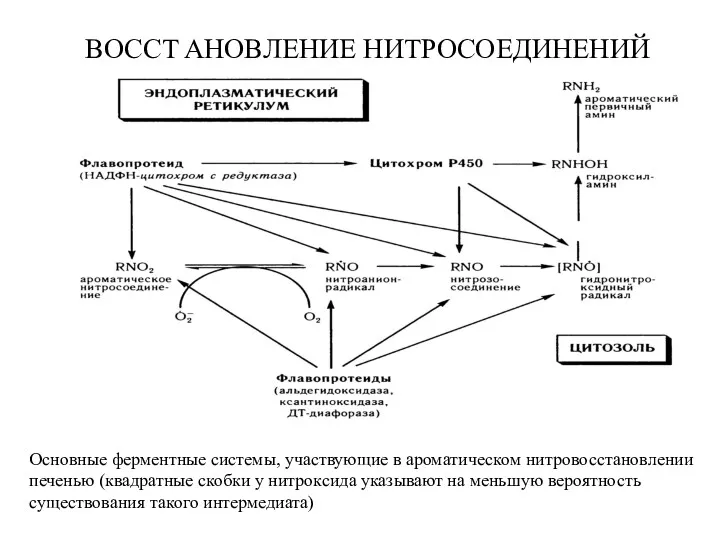
- 18. BOCCT AHOBЛEHИE HИTPOСOEДИHEHИЙ Основные ферментные системы, участвующие в ароматическом нитровосстановлении печенью (квадратные скобки у нитроксида указывают
- 19. Восстановление азосоединений Микросомальная азоредуктаза восстанавливает азосоединения в две стадии: восстановление субстратов до гидразосоединений и их восстановительное
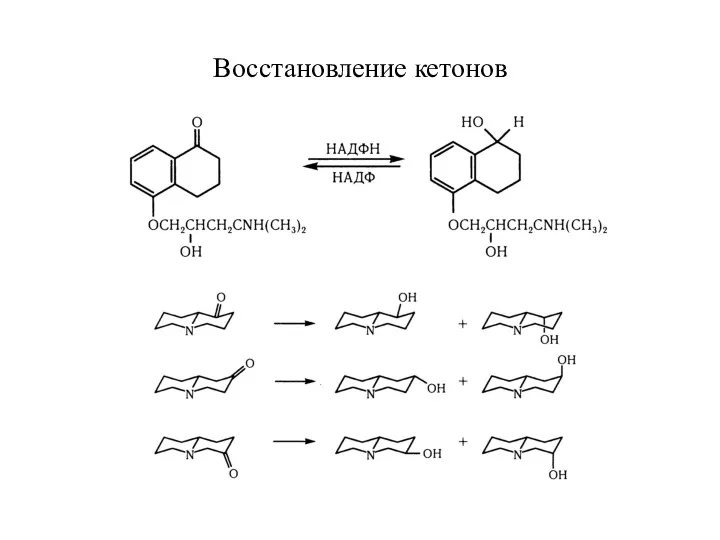
- 20. Восстановление кетонов
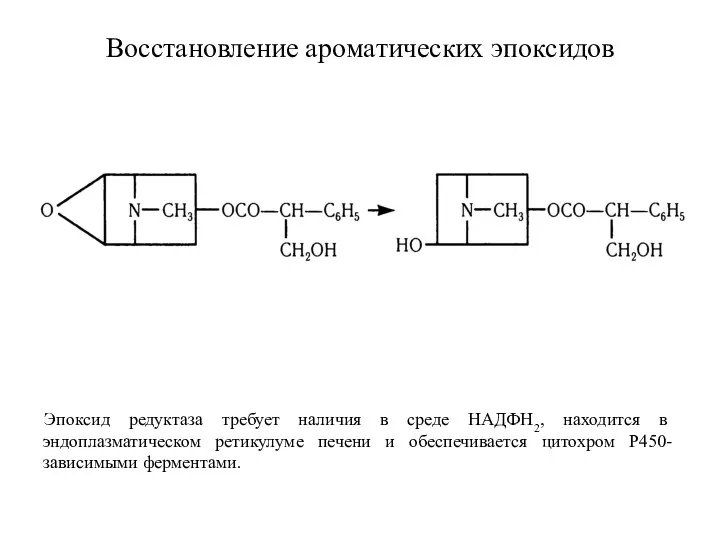
- 21. Boccтaнoвлeниe aрoмaтичecкиx эпоксидoв Эпоксид редуктаза требует наличия в среде НАДФН2, находится в эндоплазматическом ретикулуме печени и
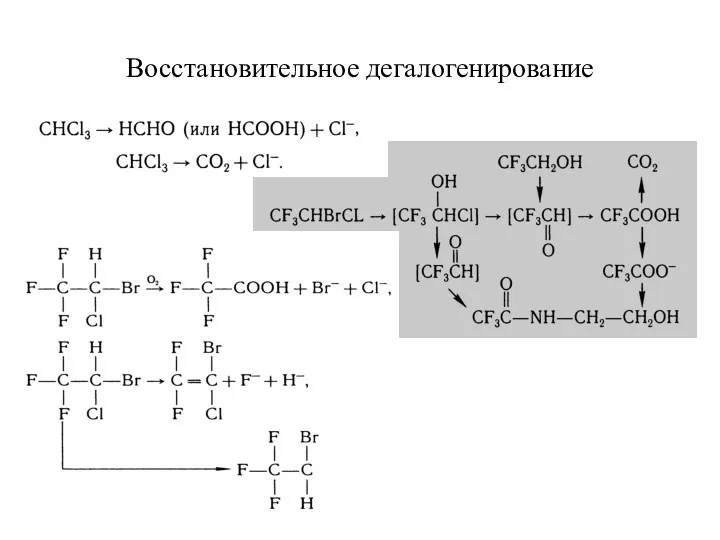
- 22. Восстановительное дегалогенирование
- 23. ГИДРОЛИЗ
- 24. Эстеразы Где R – aлкильная, a X – элиминирующая группы (алкокси, арилокси и др.). Образуются, соответствующие,
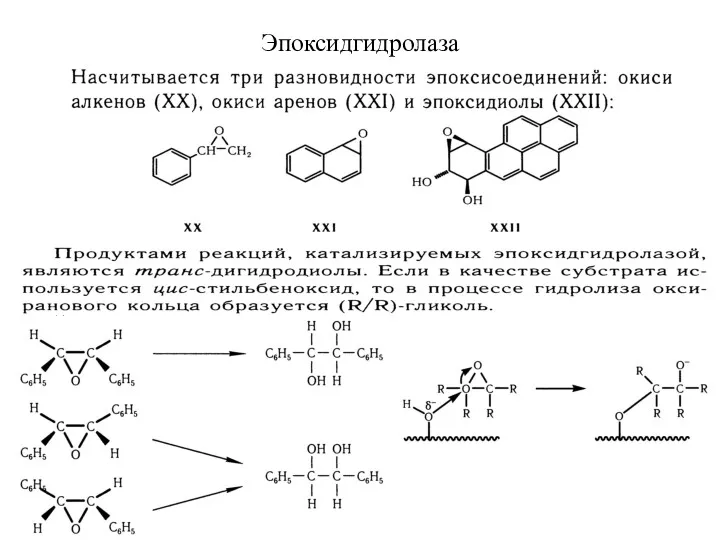
- 25. Эпоксидгидролаза
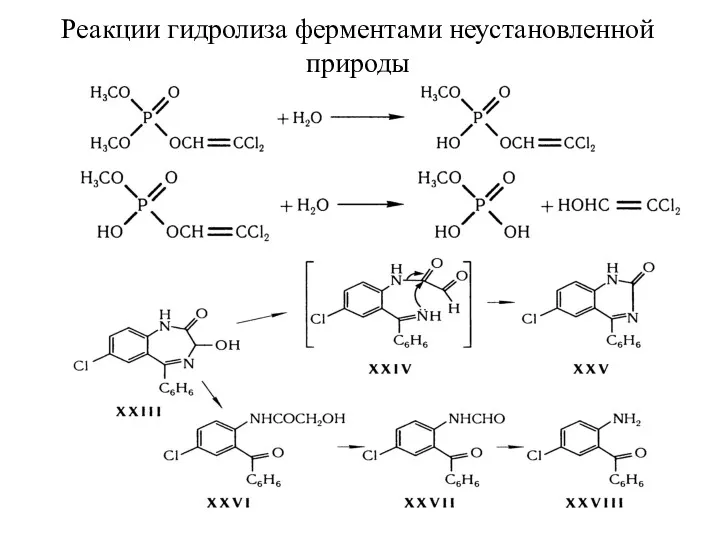
- 26. Реакции гидролиза ферментами неустановленной природы
- 27. Конъюгация
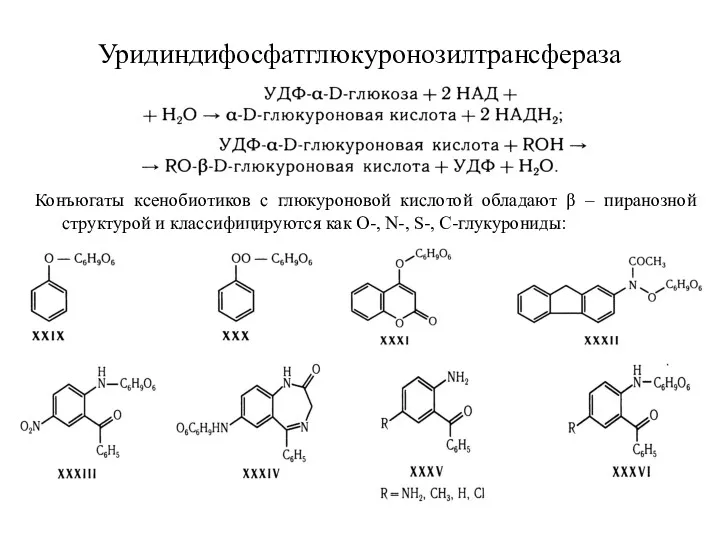
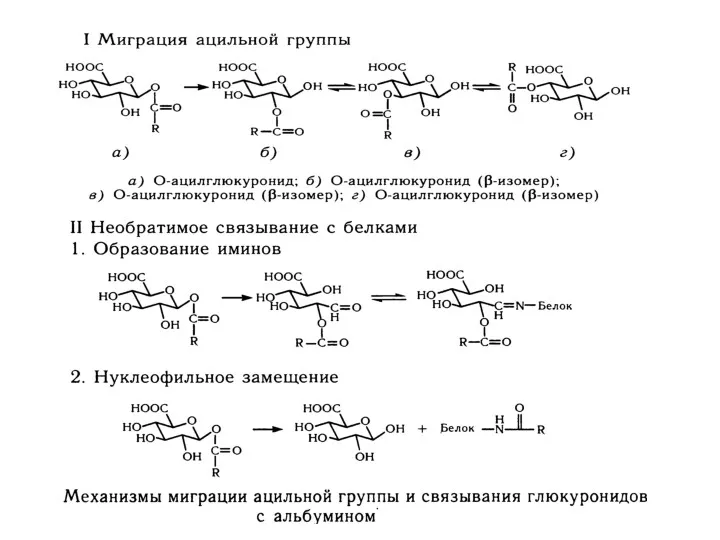
- 28. Уридиндифосфатглюкуронозилтрансфераза Конъюгаты ксенобиотиков с глюкуроновой кислотой обладают β – пиранозной структурой и классифицируются как О-, N-,
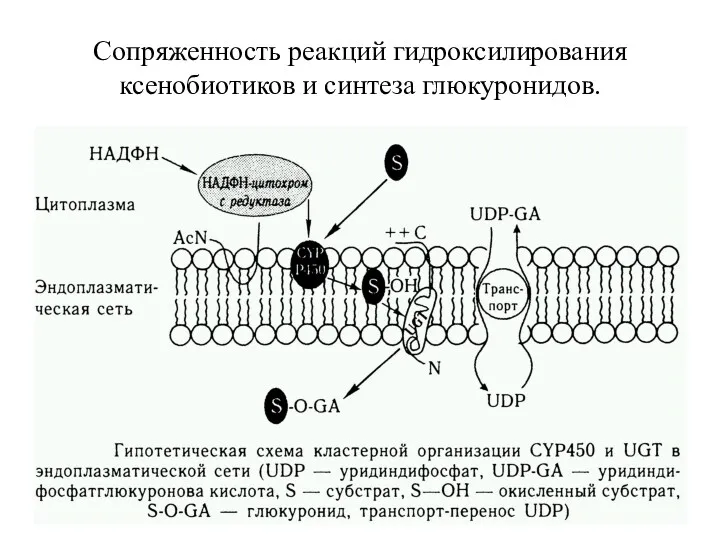
- 29. Сопряженность реакций гидроксилирования ксенобиотиков и синтеза глюкуронидов.
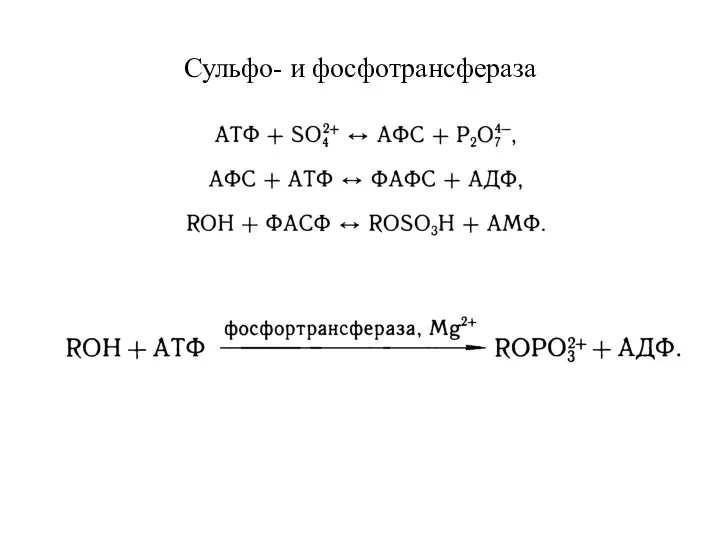
- 31. Сульфо- и фосфотрансфераза
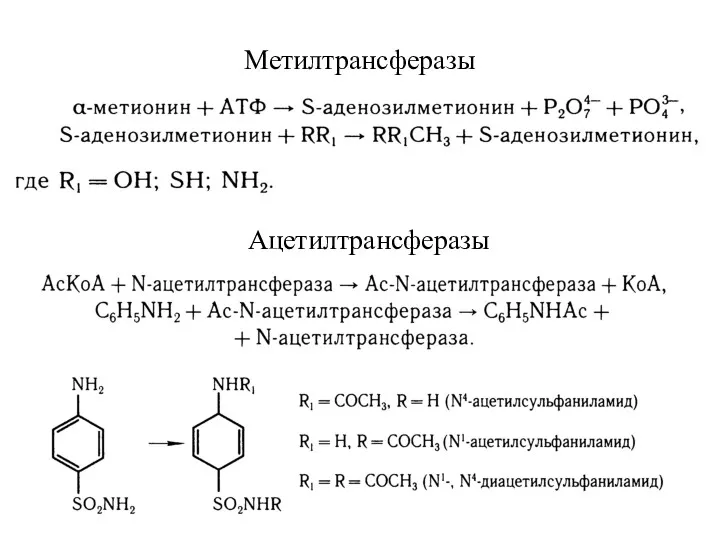
- 32. Метилтрансферазы Ацетилтрансферазы
- 33. Ферменты, катализирующие реакции конъюгации лекарств с аминокислотами и пептидами
- 34. Восстановленный глутатион (GSH) поддерживает сульфгидрильные группы цистеиновых групп белков в восстановленном состоянии:
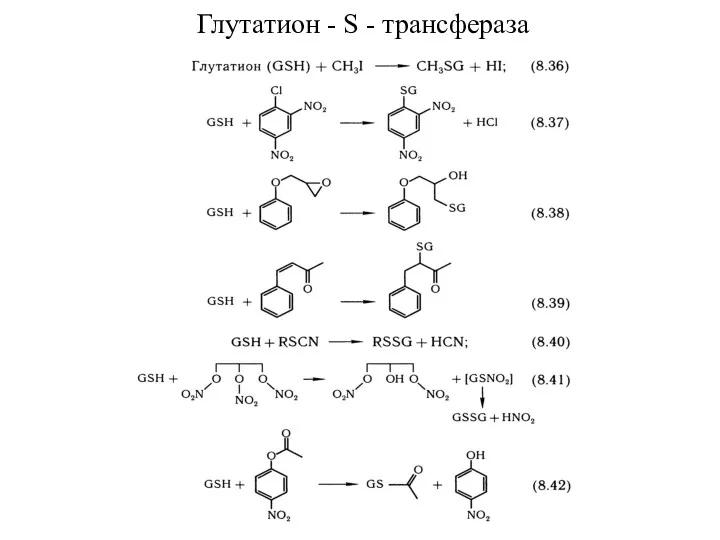
- 35. Глутатион - S - трансфераза
- 39. Скачать презентацию










 Основные характеристики различных сортов меда
Основные характеристики различных сортов меда Реакции ионного обмена
Реакции ионного обмена Комплексні сполуки
Комплексні сполуки Алкины
Алкины Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Алкадиены
Алкадиены Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Карбоновые кислоты, их нахождение в природе и применение
Карбоновые кислоты, их нахождение в природе и применение Углерод и его соединения
Углерод и его соединения Физические и химические свойства аренов
Физические и химические свойства аренов Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Основные химические понятия
Основные химические понятия Непредельные углеводороды: алкены, олефины
Непредельные углеводороды: алкены, олефины Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Аккумуляторные батареи
Аккумуляторные батареи Азот. Физические свойства
Азот. Физические свойства Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Знаки вторичной переработки
Знаки вторичной переработки Строение и свойства циклоалканов
Строение и свойства циклоалканов Коррозия металлов и способы защиты от коррозии
Коррозия металлов и способы защиты от коррозии Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Атомдар мен молекулалар
Атомдар мен молекулалар Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Цветные маталлы и сплавы
Цветные маталлы и сплавы Морфологія наноструктур. Особливості синтезу OD, 1D та 2D наносистем. Методи фракціонування наносистем
Морфологія наноструктур. Особливості синтезу OD, 1D та 2D наносистем. Методи фракціонування наносистем Нефть и продукты её переработки
Нефть и продукты её переработки Химическая промышленность
Химическая промышленность фосфор и его соединения
фосфор и его соединения