Содержание
- 2. Цель урока Систематизировать знания о предмете химии и об основных химических понятиях в свете атомно- молекулярного
- 3. План урока Алхимия – древнейший прообраз химии. Атомы. Химический элемент – язык химии. Химические формулы. Валентность
- 6. Алхимию постигнуть каждый рад: Безмозглый идиот, старик и юный фат, Портной, старуха, юркий адвокат, Монах плешивый,
- 7. В 1803г. Д. Дальтон составил первую таблицу символов и относительных атомных масс элементов.
- 8. «…Когда мы пытаемся выразить химические пропорции, мы ощущаем необходимость химических символов. Химия всегда пользовалась ими, однако,
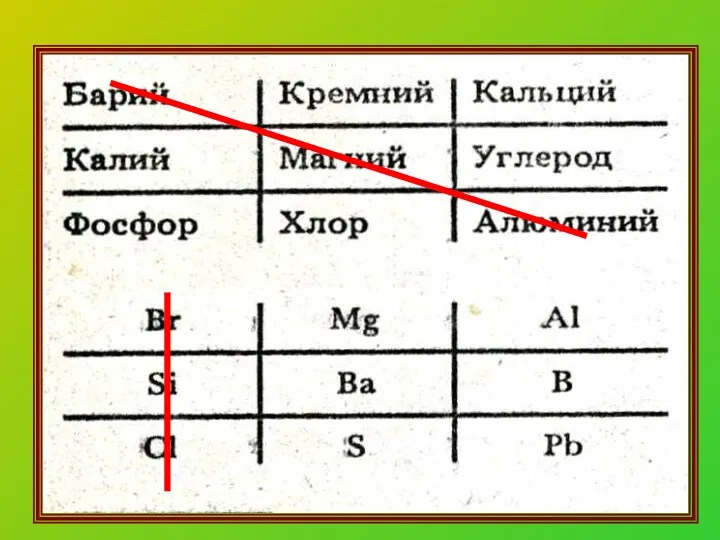
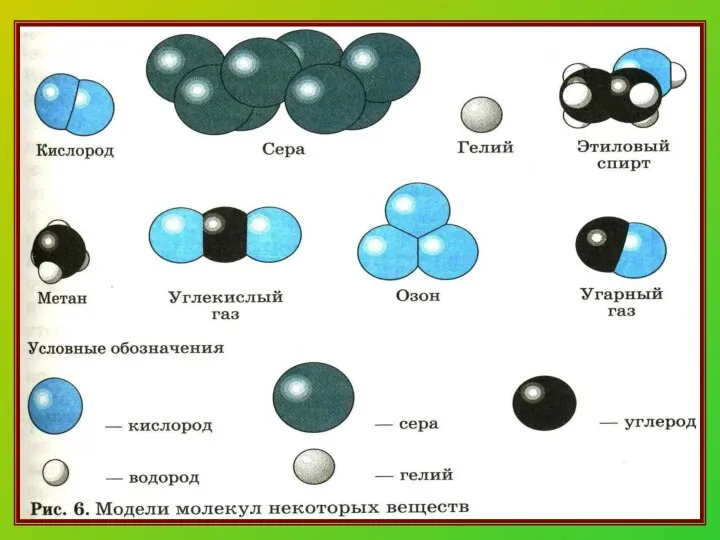
- 11. Химическая формула. Что она показывает? Качественный состав (какие химические элементы) Na2S количественный состав (сколько атомов химического
- 13. Распределите вещества на простые и сложные: Iвар. H2O; Mg; BaO; N2; O2; AlCl3; H2S IIвар. K2O;
- 14. Распределите вещества на простые и сложные: I вар. Простые: Mg; N2; O2 Сложные: H2O; BaO; AlCl3;
- 15. Английский химик Эдуард Франкленд в 1852г. ввел понятие о соединительной системе. Это свойство атомов позже стали
- 16. Определите валентность элементов и составьте химические формулы веществ по валентности Iвариант CaN; AlO ; HS; KCl;
- 17. Определите валентность элементов и составьте химические формулы веществ по валентности Iвариант II III III II I
- 18. В 1756г предложил общую формулировку закона сохранения вещества и движения: «…Все перемены, в натуре случающиеся, такого
- 20. Расставьте коэффициенты в схемах химических реакций и укажите тип реакции Iвариант А) Na + S =
- 21. Расставьте коэффициенты в схемах химических реакций и укажите тип реакции I вариант А) 2Na + S
- 22. А. Авогадро
- 23. Решите задачу: I вариант Какова масса 5,6л кислорода О2? II вариант Сколько молекул содержится в 9г
- 24. Решение задачи I вариант Дано: Решение: V (O2) = 5,6л 1) n = V/Vm ; 2)
- 25. II вариант Дано: Решение: m(H2O) = 9г 1) n=m/M; 2) N=nNA 1) n=9/18=0,5моль Найти: M(H2O)=1·2+16=18г/моль N(H2O)
- 27. Скачать презентацию






















 Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Особенности дисперсных систем
Особенности дисперсных систем Inert metals
Inert metals Урок 19. Практична робота №1. Реакції йонного обміну між електролітами у водних розчинах
Урок 19. Практична робота №1. Реакції йонного обміну між електролітами у водних розчинах Циклоалкандар
Циклоалкандар Полімери. Природні полімери
Полімери. Природні полімери Своя игра по химии
Своя игра по химии Алкилсульфонаттарды алу және технологиялық сызбанұсқасы
Алкилсульфонаттарды алу және технологиялық сызбанұсқасы Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Введение в органическую химию
Введение в органическую химию Хімія та їжа
Хімія та їжа История становления органической химии
История становления органической химии Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Plastics слайды
Plastics слайды Ртуть. Использование ртути
Ртуть. Использование ртути Газовые гидраты
Газовые гидраты Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Чипсы: вред или польза
Чипсы: вред или польза Химический элемент хлор
Химический элемент хлор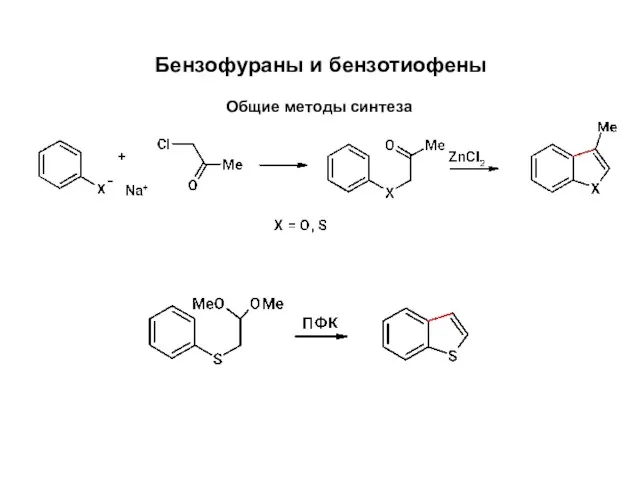 Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза Понятие о солях (8 класс)
Понятие о солях (8 класс) Фармацевтическая химия натрия гидрокарбоната
Фармацевтическая химия натрия гидрокарбоната Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн
Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов